人参皂苷Rb1经ERK1/2对H2O2诱导的乳鼠心肌细胞损伤的保护作用1)
2014-07-05任建勋吴红金王玉祥
杨 翠,任建勋,吴红金,王玉祥
生理状态下,心肌细胞内活性氧(reactive oxygen species,ROS)的产生与清除处于稳态平衡。氧化应激时,ROS在细胞内过量蓄积,产生细胞毒性,造成细胞功能障碍,最终导致其坏死和凋亡[1]。过度氧化应激导致心肌细胞凋亡明显增加,在冠心病、心肌梗死、心力衰竭、心肌缺血再灌注损伤等心血管病理过程中扮演重要角色。抑制氧化应激诱导的心肌细胞坏死和凋亡是防治缺血缺氧性心脏病的有效策略,成为许多中药活性成分心肌保护作用研究的切入点[2,3]。人参皂苷Rb1(Ginsenoside Rb1,Gs-Rb1)是从人参中提取出来的主要活性成分,大量研究表明 Gs-Rb1能减轻心肌缺血再灌注损伤[4,5],然而 Gs-Rb1抗氧化保护心肌细胞的确切的分子机制尚未完全阐明。本研究采用H2O2诱导乳鼠心肌细胞造成氧化性损伤,探索Gs-Rb1对氧化应激所致细胞损伤的直接保护作用,并对其相关机制进行研究。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 出生24h的SD大鼠乳鼠,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001。
1.1.2 主要试剂 人参皂苷Rb1购自中国食品药品检定研究院;DMEM高糖培养基、胎牛血清购于Hyclone公司;胰蛋白酶购于Amresco公司;胶原酶Ⅱ购于Worthington Biochemical公司;MTT购于Sigma公司;TUNEL试剂盒购于Roche公司;Phospho-p44/p42ERK1/2Antibody购于 Cell Signaling Technology公司;H2O2购于北京宏盛苑化工有限公司;原花青素购自上海康九化工有限公司。
1.1.3 主要仪器 CO2培养箱购自SANYO公司;505酶标仪购自BIO-RAD公司;荧光显微镜购自OLYMPUS公司。
1.2 实验方法
1.2.1 原代心肌细胞培养 出生24h内的SD大鼠乳鼠,无菌操作下取心脏并修剪。磷酸盐缓冲液(PBS)清洗3次,在50 mL的离心管中将其剪碎成1mm3~2mm3大小的组织碎块。随后用含0.25%胰蛋白酶和0.05%胶原酶Ⅱ的PBS轻柔吹打消化8min,静置后1min后收集细胞悬液,放入含有10%胎牛血清的高糖DMEM培养液中终止消化;以上过程反复进行,直至组织块完全消化。细胞悬液经200目筛网过滤去除未消化的组织,在4℃时以1 000r/min离心8min,弃上清,并用10%胎牛血清的高糖DMEM培养液重悬。台盼蓝染色计数,调整细胞数至5×106/L。接种到25mL培养瓶中,置37℃培养箱(含95%空气+5%CO2)中培养1.5h以纯化心肌细胞(差速贴壁法)。接种到12孔或96孔培养板中,每24h观察细胞贴壁及生长情况,并更换培养液。待72h细胞融合出现搏动进行后续实验。
1.2.2 原代心肌细胞H2O2损伤模型的建立及分组 上述原代培养的心肌细胞随机分为6组。空白对照组:37℃孵箱常规培养;模型组:加入终浓度为100μmol/L H2O2,37℃孵箱培养;阳性对照组:在加入终浓度为100μmol/L原花青素2h后,加入与模型组等量的 H2O2,37℃孵箱培养;Gs-Rb1低、中、高剂量组分别在加入50μmol/L、100μmol/L、200μmol/L Gs-Rb1 2h后,加入与模型组等量的H2O2,37℃孵箱培养。
1.2.3 MMT法检测细胞活性 各组加入H2O2后18h采用MMT法检测细胞活力。弃去细胞培养液,PBS冲洗后每孔加入 MTT 20μL(0.5mg/mL),置于CO2培养箱中继续培养4h,吸出孔内培养液后,加入DMSO 150μL/孔,将培养板置于微孔板震荡器上振荡10min,充分溶解,酶标仪在490nm波长检测各孔吸光度值(OD)。
1.2.4 心肌细胞凋亡的检测 各组加入H2O2后18h,吸取培养基,PBS冲洗3次,4%多聚甲醛固定。经0.2%Triton-X-100液通透处理,加rTdT酶、核苷混合物的混合液37℃避光孵育1 h后终止反应,PBS冲洗后在荧光显微镜下采用绿色荧光进行观察和分析,对同一片取5个不同视野计数所有细胞和凋亡细胞,计算凋亡率。凋亡率=凋亡细胞数/总细胞数×100%。
1.2.5 心肌细胞ERK1/2磷酸化水平检测 各组加入H2O220min后,采用 Western blot进行ERK1/2蛋白磷酸化检测。弃去培养基后预冷的PBS冲洗3次,加入预冷的细胞裂解液于冰上充分裂解,提取总蛋白并用BCA法检测蛋白浓度。所有不同组蛋白样本分别加入上样缓冲液后煮沸5min变性,蛋白进行12%SDS-PAGE凝胶电泳分离后采用湿法转膜转移至PVDF膜上,5%牛血清白蛋白室温封闭1h,加入磷酸化特异性单克隆ERK1/2抗体孵育、4℃过夜、TBST洗涤3次(每次10 min)后加入二抗孵育,室温孵育2h;TBST洗涤3次(每次10 min)后加入ECL处理、X线胶片曝光、显影及定影。采用IPP 6.0进行灰度分析,以p-ERK1/2蛋白条带灰度值与t-ERK1/2蛋白条带灰度值比值反映ERK1/2磷酸化的程度。
1.3 统计学处理 数据以均数±标准差(x±s)表示,采用One-Way ANOVA(单因素方差分析)方法,方差齐性应用Student-Newman-Keuls检验,方差不齐采用Tamhane’sT2检验。P<0.05为有统计学意义。
2 结 果
2.1 各组心肌细胞活性的比较 与空白对照组比较,模型组心肌细胞活力明显下降(P<0.05);与模型组比较,原花青素组以及Gs-Rb1低、中、高剂量组心肌细胞活力明显提高,差异有统计学意义(P<0.05或P<0.01)。详见表1。
2.2 各组心肌细胞凋亡率的比较 与空白对照组比较,模型组心肌细胞凋亡率明显升高(P<0.01);与模型组比较,原花青素组以及Gs-Rb1低、中、高剂量组心肌细胞凋亡率明显下降,具有统计学意义(P<0.05或P<0.01)。详见表1。
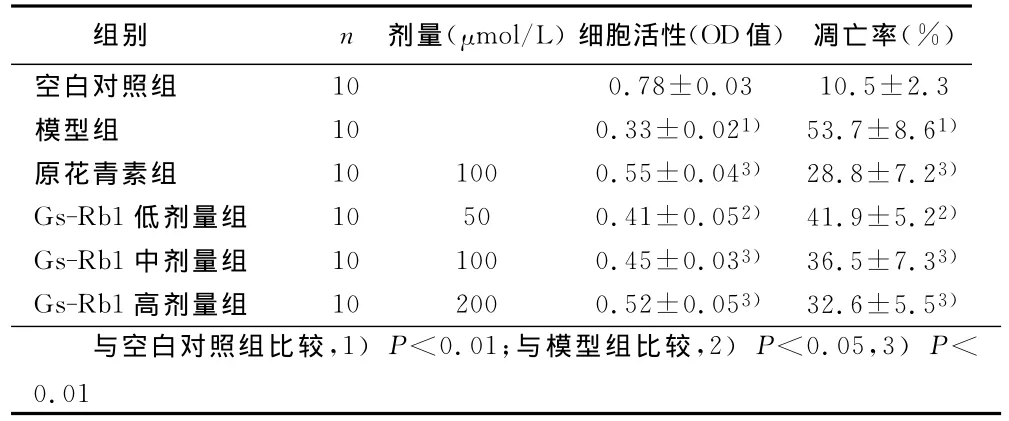
表1 各组乳鼠心肌细胞活力和凋亡率变化(x±s)
2.3 各组心肌细胞ERK1/2蛋白磷酸化水平的比较 与空白对照组比较,模型组心肌细胞p-ERK1/2表达明显减少(P<0.01);与模型组比较,原花青素组以及Gs-Rb1高剂量组心肌细胞p-ERK1/2表达则显著增加(P<0.05)。详见图1、表2。
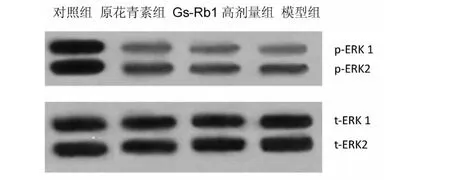
图1 Gs-Rb1对乳鼠心肌细胞p-ERK1/2蛋白表达的影响

表2 各组乳鼠心肌细胞p-ERK1/2蛋白表达的变化(x±s)
3 讨 论
细胞凋亡,又称程序性细胞死亡,是一种严格受基因调控的细胞自主性死亡,参与着机体多种病理生理过程。氧化应激是心肌细胞发生凋亡的重要介导因素,心肌缺血、缺氧时,大量内源性ROS在心肌细胞内发生蓄积,通过特殊的信号通路诱导细胞发生凋亡[1,6]。本研究采用H2O2作为外源性ROS作用于心肌细胞,MTT法和TUNEL法检测结果显示,H2O2成功造成心肌细胞氧化损伤,诱导心肌细胞发生凋亡。
一些特定的信号通路参与氧化应激所致的心肌细胞损伤与凋亡,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是其中重要的一条,而细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是 MAPK家族的重要组成部分,精细调控细胞的增殖、分化、存活及凋亡[7]。目前认为对于ERK磷酸化的调节是干预心肌细胞在缺血缺氧条件下凋亡的重要途径。研究发现,中药成分丹参素对缺氧所致的心肌细胞损伤具有保护作用,其机制可能与激活ERK1/2途径而抑制心肌细胞凋亡相关[8]。α-硫辛酸能增加ERK1/2磷酸化水平对葡萄糖/葡萄糖氧化酶诱导的心肌细胞损伤有保护作用,而使用ERK1/2抑制剂后,该保护作用消失[9]。此外,瘦素可能通过活化ERK1/2通路抑制H2O2诱导的H9c2心肌细胞凋亡[10]。
现代药理研究表明人参多种活性成分具有抗心肌细胞凋亡、清除氧自由基、改善心肌能量代谢和增加心肌收缩力等广泛的心血管调节作用。前期研究发现[11,12],人参皂苷Re和人参皂苷Rg1均能抑制60Co照射诱导的乳鼠心肌细胞凋亡,ERK、JNK和p38MAPK通路可能参与介导这种心肌细胞保护作用。Gs-Rb1作为人参的又一主要活性成分,研究显示其具有显著的抗心肌缺血再灌注损伤作用,可能与其上调eNOS表达,抑制自由基对心肌组织的氧化损伤有关[4]。同时,Gs-Rb1可能通过抗脂质过氧化与减轻细胞内钙超载抑制H2O2诱导的乳鼠心肌细胞凋亡[13]。还有研究发现Gs-Rb1通过稳定线粒体膜电位而发挥抗心肌细胞凋亡作用[14]。另有实验证明[15],Gs-Rb1能清除ROS,抑制ROS诱导的JNK通路的激活,从而产生心肌细胞保护作用。然而,Gs-Rb1是否通过ERK1/2途径而减轻氧化应激对心肌细胞的损伤还不得而知,本研究主要以ERK途径为切入点,细胞、分子两个层面来探讨Gs-Rb1对H2O2诱导的心肌细胞损伤的保护作用。原花青素作为一种强抗氧化剂,具有较强的清除氧自由基作用,被我们选用作为阳性药物对照组。本研究结果表明,原花青素及低、中、高剂量的Gs-Rb1均可抑制H2O2诱导的心肌细胞损伤和凋亡。进一步研究显示,与空白对照组相比,H2O2诱导的氧化损伤组心肌细胞的p-ERK1/2表达下调,原花青素组和高剂量Gs-Rb1可通过诱导心肌细胞p-ERK1/2表达增加的途径对抗H2O2引起的细胞氧化损伤和凋亡。
综上所述,H2O2可诱导乳鼠心肌细胞损伤和凋亡,而Gs-Rb1能减轻这种细胞损伤而具有心肌细胞保护作用,其作用机制可能与激活ERK信号通路相关。然而,Gs-Rb1介导的这种心肌保护作用是否与其他信号通路相关,其确切的分子机制还有待进一步的研究证明。
[1] Giordano FJ.Oxygen,oxidative stress,hypoxia,and heart failure[J].J Clin Invest,2005,115(3):500-508.
[2] Zhu XY,Zhang ZL,Li P,et al.Shenyuan,an extract of American Ginseng and Corydalis Tuber formula,attenuates cardiomyocyte apoptosis via inhibition of endoplasmic reticulum stress and oxidative stress in a porcine model of acute myocardial infarction[J].J Ethnopharmacol,2013,150(2):672-681.
[3] Wang XL,Wang X,Xiong LL,et al.Salidroside improves doxorubicin-induced cardiac dysfunction by suppression of excessive oxidative stress and cardiomyocyte apoptosis:Doxorubicin cardiotoxicity inhibited by salidroside[J].J Cardiovasc Pharmacol,2013,62(6):512-523.
[4] 陈红霞.人参皂苷Rb1对大鼠实验性心肌缺血再灌注损伤的保护作用[J].湖北科技学院学报(医学版),2012,26(6):465-467.
[5] Wang Z,Li M,Wu WK,et al.Ginsenoside Rb1preconditioning protects against myocardial infarction after regional ischemia and reperfusion by activation of phosphatidylinositol-3-kinase signal transduction[J].Cardiovasc Drugs Ther,2008,22(6):443-452.
[6] von Harsdorf R,Li PF,Dietz R.Signaling pathways in reactive oxygen species-induced cardiomyocyte apoptosis[J].Circulation,1999,99(22):2934-2941.
[7] Yoon S,Seger R.The extracellular signal-regulated kinase:multiple substrates regulate diverse cellular functions[J].Growth Factors,2006,24(1):21-44.
[8] Yin Y,Guan Y,Duan J,et al.Cardioprotective effect of Danshensu against myocardial ischemia/reperfusion injury and inhibits apoptosis of H9c2cardiomyocytes via Akt and ERK1/2phosphorylation[J].Eur J Pharmacol,2013,699(1-3):219-226.
[9] 张阳阳,姚玉珍,李荣荣,等.α-硫辛酸通过激活ERK1/2减轻葡萄糖/葡萄糖氧化酶所致心肌细胞损伤[J].实用老年医学,2013,27(7):547-550.
[10] 潘喆,李晓博,孙爱丽,等.瘦素抑制H2O2诱导的大鼠心肌细胞凋亡[J].中国病理生理杂志,2010,26(9):1704-1707.
[11] 吴红金,刘宇娜.人参皂甙Re对60Co照射诱导心肌细胞凋亡的保护作用[J].中西医结合心脑血管病杂志,2008,6(8):923-924.
[12] 吴红金,刘宇娜.人参皂甙Rg1抑制60Co照射诱导心肌细胞凋亡[J].医学综述,2008,14(21):3332-3334.
[13] 许浩,葛亚坤,邓同乐,等.人参皂苷Rb1对H2O2诱导新生大鼠心肌细胞凋亡的保护作用[J].中国药理学通报,2005,21(7):803-806.
[14] 文飞,张帆,冷沁.人参皂苷Rb1对过氧化氢诱导的心肌细胞凋亡的保护作用[J].湖北中医杂志,2010,32(7):5-7.
[15] Li J,Shao ZH,Xie JT,et al.The effects of ginsenoside Rb1on JNK in oxidative injury in cardiomyocytes[J].Arch Pharm Res,2012,35(7):1259-1267.
