化学储氢研究进展
2014-07-02周鹏刘启斌隋军金红光
周鹏,刘启斌,隋军,金红光
(1中国科学院工程热物理研究所,北京 100190;2中国科学院大学,北京 100049)
进展与述评
化学储氢研究进展
周鹏1,2,刘启斌1,隋军1,金红光1
(1中国科学院工程热物理研究所,北京 100190;2中国科学院大学,北京 100049)
氢气作为一种高效、清洁的能量载体,被视为21世纪最具发展潜力的能源。氢的储存是氢能规模化应用的关键,相比于物理储氢,化学储氢更加高效安全。常用的化学储氢方式主要有金属氢化物、配位氢化物、有机液体氢化物等。本文综述了上述3种主要储氢方式的研究进展并指出存在的问题。金属氢化物中,如新近发现的多相R-Mg-Ni系储氢合金储氢量较高,价格低廉,但其仍存在过于稳定、加/脱氢动力学性能差等问题;配位氢化物含有丰富的轻金属元素,储氢密度较高,但存在可逆循环性能差的问题,限制了其应用;液体有机物储氢量高,还可以同汽油一样在常温常压下运输,且环己烷、苯等液体有机储氢介质均为工业上可以大规模生产的化学品,如果能开发出高稳定性、高转化率和高选择性的脱氢催化剂,将大幅度推动氢能规模化应用。
氢;化学反应;金属氢化物;配位氢化物;有机液体氢化物;催化
随着能源危机的加剧,氢能受到普遍重视。氢能作为一种清洁、高效、安全、可持续的新能源,被视为21世纪最具发展潜力的能源,是人类战略能源的发展方向。美国、欧盟等都制定了氢能发展规划。2008年,欧洲议会通过《氢能源和燃料电池联合技术发展计划》,旨在把氢能源技术发展成为能源领域的一项战略高新技术。2010年,美国能源部(DOE)效率与可再生能源办公室制定了“氢能源计划”(Hydrogen Posture Plan),计划概括了能源部准备开展的重大活动及交付的成果。氢能利用主要包括氢的廉价制取、安全高效储运和规模应用。氢气作为一种高效能源至今没有商业化,根本的制约在于氢气大容量储运问题没有解决[1]。传统的储氢方式主要是物理法储氢,采用高压气态储氢和低温液态储氢。这两种储氢方式简单易行,但是能耗高,储氢量小,且储运具有潜在的危险性。美国能源部提出2015年使材料的储氢能力达到6.5%的目标[2],传统的物理法储氢方式远远达不到此标准,因此研究和发展新型的化学法储氢技术极其必要。化学储氢材料通过化学反应或化学变化生成含氢化合物,储氢密度远大于高压气态储氢和低温液态储氢,且安全性好,是未来储氢材料发展的重点。
目前常用的化学储氢技术主要有金属合金储氢、配位氢化物储氢、有机液体储氢等。本文通过综述上述主要化学储氢技术的研究进展,归纳了3种化学储氢方式的优缺点,阐述其存在的问题与瓶颈,并指出其发展趋势。
1 金属合金储氢
1.1 金属合金储氢原理及特点
金属与氢的反应平衡用压力/浓度/温度(PCT)曲线表示,如图1所示。温度不变时,随着氢压的增加,金属吸氢,形成含氢固溶体(α相),随着更多氢的加入,含氢固溶体(α相)继续反应生成金属氢化物(β相),反应过程中压力保持不变,该段氢浓度代表了合金在温度T时的有效储氢容量。在实际操作中,通过调节体系的温度和压力,可实现氢的吸收释放。
与传统的物理储氢方式相比,金属合金材料储氢的主要特点是储氢量较大,氢以原子状态储存于合金中,重新释放出来时经历扩散、相变、化合等过程。这些过程受热效应和速度的制约,因此输运更加安全,但同时由于这类材料的氢化物过于稳定,热交换比较困难,加/脱氢只能在较高温度下进行。

图1 压力/浓度/温度(PCT)曲线
1.2 金属合金储氢材料
储氢合金按合金分子组成不同可以划分为AB5型、AB2型和AB3.0-3.5型等。其中A是一种吸氢元素或与氢有很强亲和力的元素,B是一种吸氢量很小或根本不吸氢的元素,但氢很容易在其中移动。A控制着储氢量,B控制着吸放氢的可逆性,起调节生成热与分解压力的作用。
1.2.1 AB5型合金
AB5型合金是目前仅有的大规模产业化的储氢合金,商业镍氢电池的合金组成及性能如表1所示[3]。LaNi5是AB5型储氢合金代表,也是最早被发现的稀土系储氢材料,该合金为CaCu5结构,其最大特征是活化容易,平台压力较低,动力学性能优良。LaNi5的最大储氢密度为1.38%,初期氢化反应速度快,25℃时分解压仅约为0.2MPa。LaNi5储氢合金的缺点是La的价格较高,合金在在吸放氢过程中晶胞膨胀过大,易于粉化,储氢密度低等。改善其储氢性能、降低合金价格的有效方法是以Er、Pr、Nd、Sm、Gd、Y等稀土元素部分替代La,以Al、Cr、Fe、Co、Ag、Pd等部分替代Ni[4]。
An等[5]研究了Al部分替代合金LaNi5的中的Ni后的性能变化。在1.00MPa,30℃的条件下,运用Chou模型对LaNi5-xAlx(x=0,0.15,0.5,1.0)进行测试研究表明,4种金属合金吸氢反应速率比较为LaNi5< LaNi4Al < LaNi4.5Al0.5< LaNi4.85Al0.15。研究表明调整合适的Al组分可以明显提高材料的动力学性能。Kumar等[6]研究了合金Mm-Ni(Mm为混合稀土,主要成分为La、Ce、Pr、Nd)中Ni分别被Al、Co、Mn、Fe按不同比例组分替代得到的性能,研究表明替代后的储氢合金平衡压力降低,滞后系数减小,并且生成焓增加,即合金稳定性增强。

表1 商业镍氢电池合金组成及性能
以AB5型储氢合金为负极材料的镍氢电池因其高能量密度、长循环寿命、高倍率性能以及环境友好等优点已广泛地替代了镍镉电池。但AB5型储氢合金储氢容量较小,目前AB5型储氢合金已接近其理论容量极限,难以实现大规模应用。由于AB5型储氢合金有着实际应用的基础,因此其研究成果对新型储氢合金研发具有重要价值。
1.2.2 AB2型储氢合金
AB2型Laves相储氢合金有Zr基和Ti基两大类。该类合金包括C14(MgZn2型,立方晶)和C15(MgCu2型,正方晶)两种结构。这类材料的最大特征是放电容量高、活化性能好,但存在初期活化困难、高倍率放电性能较差、易被电解液腐蚀及成本较高等缺点。AB2型合金B侧元素主要包括B、Al、Si、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、Mo、Sn和W,A侧元素相对较少,主要包括Ti、Zr、Hf和Nb[7]。
Yadav等[8]在氩气保护下,采用熔炼法合成了 ZrFe2、Zr(Fe0.75V0.25)2和Zr(Fe0.5V0.5)2共3种AB2型合金。研究发现该3种合金均为C14型结构,采用扫描电子显微镜和射线能谱分析仪研究了合金的表面形态和化学组成,随着V替代Fe的量的增加,合金晶格常数增加,储氢容量增加,Zr(Fe0.5V0.5)2的储氢量可以达到1.45%,储氢可逆性却因形成更加稳定的金属氢化物而随之降低。研究还表明3种合金的平衡压力均小于大气压。Young等[9-10]研究了储氢合金的组成结构和储氢性能。研究发现该合金不仅只有C14和C15结构,还含有一些伴随着C14枝晶生长的非Laves结构。研究还表明,随着Mn的含量的增加,①C14相结构逐渐增加;②C15相结构逐渐减少直至消失;③Zr9Ni11逐渐减少;④Zr7Ni10先增加后减少;⑤TiNi从0增加至4%然后减小,最后稳定在2%。伴随着相结构的变化,合金的储氢性能也随之变化。随着Zr7Ni10量的增加,该合金PCT曲线倾斜度和滞后效应(吸氢曲线与放氢曲线的差别)减小;随着TiNi量的增加,该合金可逆储氢含量增加。
与AB5型合金相比,AB2型合金不需要采用退火过程去除杂相结构,AB2型合金性能还会因为这些杂相结构的存在而改善。元素选择的多样性和化学计量系数的灵活性使AB2型合金更加适应多变的市场需要。
1.2.3 AB3.0-3.5型储氢合金
AB3.0-3.5型储氢合金是新近发现的高容量储氢合金,又称为多相R-Mg-Ni系储氢合金。一些学者特别是在中国和日本对AB3.0-3.5型储氢合金进行了大量的相关理论分析和实验研究。对该合金可以看作是AB5亚结构单元和具有高容量特性的AB2亚结构单元交替层叠排列而成。其放电容量接近400mA·h/g,高出AB5型储氢合金近20%,并且容易活化,但在循环稳定性和循环寿命等方面较AB5型储氢合金差一些,一般循环充放电的前20次过程容量急剧下降,而后出现一个相对较缓慢的下降过程,但是较AB5型合金的下降速率还是大得多。
Qin等[11]在氩气保护下通过真空磁悬浮熔炼方法合成AB3.5型合金研究了其中Co和Al元素对合金性能的协同影响。研究表明合金主相为(LaPr)(NiCo)5、LaMg2Ni9、(LaNd)2Ni7和LaNi3,随着Co和Al元素的增加,晶胞参数变大;循环稳定性增强;储氢容量先增加后减小,x=0.3时得到最大容量1.47%;放电容量也是先增加后减小,x=0.3时得到最大容量384mA·h/g。
Gao等[12]研究了退火处理对La-Mg-Ni系储氢合金微观结构和循环稳定性的影响。研究表明Ni和La几乎是均匀分布的,而Mg是不均匀分布的。退火处理后合金的各相(LaNi5、Pr5Co19、Ce2Ni7、PuNi3)含量有着较大的变化。对合金PCT曲线分析后发现氢化过程包括两个阶段,初始阶段是由LaMgNi4和LaNi5控制,第二阶段则是由LaNi5单独控制。三维退火处理后的合金表现出储氢容量增加,循环稳定性增强,循环100次后放电容量仍能保持270mA·h/g。随着退火时间的继续增加,储氢容量会有微小的增加,但放电容量会有明显减少。Young等[13]研究了合金的储氢性能。研究表明合金主相为Nd2Ni7,还存在杂相 MgNdNi4、NdNi5、NdNi3、NdNi和CeNi3。对合金采用900℃退火处理后,合金主相增加;杂相减少,但并不会消失;储氢容量和放电容量增加;高倍率放电性能有微小的降低;研究还表明,退火处理后的AB3.5型合金具有最好的电化学性能。
与AB5型合金相比,AB3.0-3.5型储氢合金具有较高的储氢容量和较低的成本,如能采用合适的方法改善其循环寿命,是很有潜力的下一代储氢材料。
2 配位氢化物储氢
2.1 配位氢化物储氢原理及特点
配位氢化物主要是由[AlH4]-、[BH4]-、[NH2]-等配位阴离子和Li、Na、Mg等轻金属阳离子形成,如铝氢化物、硼氢化物、氮氢化物、氨硼烷化合物等,其与金属氢化物之间的最主要区别在于吸氢过程中向离子或共价化合物的转变。
配位氢化物含有丰富的轻金属元素,所以有着极高的储氢容量。其中LiBH4、Al(BH4)3的理论储氢量分别为18%、17%,但是配位氢化物存可逆性差、加/脱氢温度和压力过高、动力学性能差等问题,离实际应用还差的很远。
2.2 配位氢化物储氢材料
2.2.1 铝氢化物
铝氢化物以NaAlH4为代表。1955年,Finholt等[20]在270~280℃、压力大于17.5MPa的条件下首次合成了NaAlH4,反应机理为式(1)。

此后,一些学者对NaAlH4的制备做了大量的研究[15-17],归纳目前制备NaAlH4主要有以下3种途径:①将NaAlH4与掺杂物采用机械球磨或湿法合成处理;②将NaH/Al与掺杂物采用机械球磨或湿法合成处理,然后进行氢化处理;③在氢气气氛下,将NaH/Al与掺杂物采用机械球磨合成NaAlH4。
Walters等[18]通过测量反应过程中物质的变化分析了NaAlH4的分解反应机理,作者认为该反应分为两个阶段。
第1阶段反应过程为式(2)~式(5)。

第2阶段反应过程为式(6)~式(8)。

两个阶段的反应分别放出3.7%和1.8%的氢气,NaH需要在400℃以上的条件下才可以继续分解释放氢气,因此对应用已无实际意义。
NaAlH4和Na3AlH6在常温条件下是较为稳定的氢化物,加入掺杂物后可以改善体系的吸放氢性能及动力学性能。Schuth等[19]比较了TiCl3、Ti(OBu)4和胶体Ti掺杂对NaAlH4脱氢动力学的影响,研究发现三者都能有效提高动力学性能,但催化作用却差别较大,具体原因尚不清楚。Bogdanović等[17]研究了NaAlH4中掺杂SeCl3,CeCl3后的性能,研究发现掺杂4%SeCl3后,NaAlH4在123℃、10MPa条件下,氢化过程在4~12min完成;掺杂4% CeCl3后,NaAlH4在60~150℃、5~10MPa条件下,经过95次循环仍能保持良好的循环稳定性。肖学章[20]系统研究了单质Ti、Zr掺杂NaAlH4和二元Ti-Zr共掺NaAlH4复合物,结果表明,单一Ti的掺杂催化效果优于单一Zr,而合适的Ti-Zr配比催化剂的催化效果由于单一Ti。Ti-Zr二元催化剂成为为8%Ti+2%Zr(摩尔比)时,复合物可获得最佳的吸放氢速率和容量,其最大吸放氢容量分别为4.61%和4.34%。
由于掺杂物的添加,NaAlH4储氢量和脱氢速率等性能都得到改善,虽然NaAlH4的生产已实现商业化,但仍存在材料储氢可逆性差等问题,且目前对于掺杂剂的具体作用机制尚不完全清楚,有待于进一步研究。
2.2.2 硼氢化物
硼氢化物以NaBH4为代表,工业上生产NaBH4主要有Schlesinger法及Bayer法。Schlesinger法
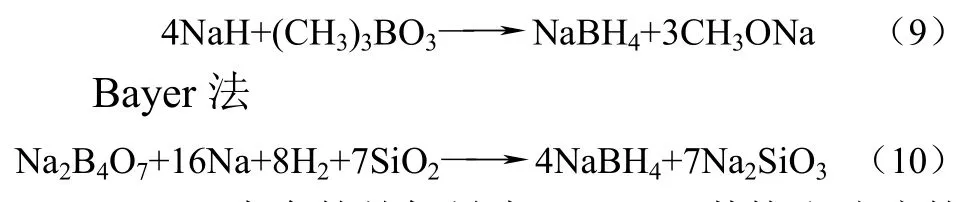
NaBH4本身的储氢量为10.6%,其饱和溶液的储氢量也可达到7.4%。NaBH4水解生成氢气的反应机理如式(11)。

NaBH4在水中的稳定性取决于溶液的酸碱度和温度,因此可以通过调节这两个参数以控制不同的脱氢速度。在常温下,NaBH4与水混合后,水解反应释放的氢气只是理论产量一小部分,这是因为水解生成的[BO2]-导致溶液pH值升高,抑制了水解反应。为了加速反应,通常要采用添加催化剂。Akdim等[21]发现CoCl2的催化产氢速率达到86.3L/min,为目前文献报道的较高的产氢速率。在保证制氢催化剂高活性的同时,努力实现催化剂稳定循环利用可大大降低NaBH4制取氢气的成本。
NaBH4已经广泛地应用于质子交换膜燃料电池的氢源,但仍存在副产物NaBO2回收难、金属钠和贵金属催化剂成本高等问题。
2.2.3 氮氢化物
氮氢化物以LiNH2/LiH为代表,其理论储氢量为10.4%。Chen等[22]首次提出Li3N可以在170~210℃下吸氢后通过两步生成LiNH2/LiH,其可逆吸放氢反应机理为式(12)。

目前关于LiNH2/LiH的脱氢机理的认识主要有两种。Chen等[23]认为脱氢反应为酸碱对机理,即LiNH2中的H带正电荷,而LiH中的H带负电荷,这样带正电和带负电的两个氢原子易于结合生成H2,反应式为式(13)。

Hu等[24]则认为脱氢反应为氨中间体机理,首先LiNH2随温度上升分解成Li2NH和NH3,随后生成的NH3和LiH继续反应,放出H2,如式(14)、式(15)。

Ichikawa等[25]研究了在LiNH2/LiH中掺杂TiCl3和VCl3后的脱氢效果,研究发现LiNH2/LiH在150~250℃的条件下呈现出良好的动力学和可逆性,同时该作者也认为脱氢反应为氨中间体机理。Leng等[26]研究了在LiNH2/LiH中掺杂MgCl2后的脱氢效果,实验表明脱氢效果与MgCl2掺杂量密切相关,但并不是线性关系。研究还发现MgCl2由于摩尔分数不同在脱氢反应过程中体现出3种不同的反应机理:①吸收氨(MgCl2<4%);②形成固溶体(MgCl2>4%);③与LiNH2反应(MgCl2>25%)。其中MgCl2与LiNH2反应形成Li-Mg-N-H体系表现出极好的脱氢效果。
LiNH2/LiH虽然储氢量较高,但脱氢温度过高、动力学性能较差,且脱氢机理仍存在争议,离实际应用仍有一定距离。
2.2.4 氨硼烷化合物
氨硼烷(NH3BH3,AB)的理论储氢量为19.6%,是储氢量极高的化学氢化物储氢材料之一。Wolf等[27]研究了AB热分解的反应机理,作者认为该反应分为两个阶段,如式(16)、式(17)。

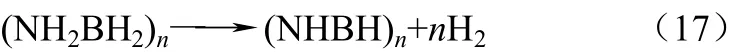
90℃时,AB开始分解产生等摩尔的氢气和多聚物的氨基硼烷,130~350℃时,另外等摩尔的氢气被释放出来,同时生成多聚物的亚氨基硼烷,温度达到350℃以上时,亚氨基硼烷可以继续分解为氮化硼和氢气,由于亚氨基硼烷的分解温度较高,因此对应用已无实际意义。
AB分解过程也可能发生下列反应产生有毒气体杂质B3N3H6,如式(18)、式(19)。
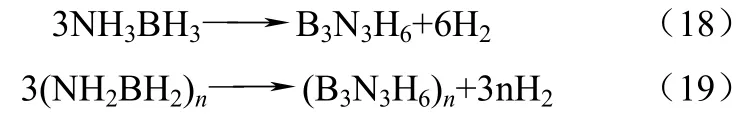
Xiong等[28]研究了利用Na、Li替代氨基中的H以促进阴离子的去氢聚合作用,研究发现在90℃时LiNH2BH3和NaNH2BH3分别可以快速释放出10.9%和7.5%的氢气,并且不产生杂质气体。
此外,AB还可以在酸或金属的催化下发生催化水解反应,如式(20)。

贵金属Ph、Pt、Ru、Ir、Pd、Co、Pa等显示了很好的催化活性,但由于价格昂贵限制了他们在实际中的应用。Liu等[29]采用少量Ru和Co为催化剂研究了AB在酸性环境下的水解反应,研究证明该反应为一级反应,即反应速度与AB和催化剂浓度的一次方成正比。该作者通过色谱分析发现气体产物除氢气外,还含有氨气,因此实际应用过程中要排除氨气。此外,该作者还通过射线衍射仪发现水解产物中主要为硼酸而不是偏硼酸。通过对水解产物的研究,可以推动AB可再生技术的发展。
李韶峰[30]研究了纳米作用对氨硼烷放氢速率以及放氢纯度的影响,通过“氨液化”方法将氨硼烷注入Pt/CNTs以后,纳米效应可以消除氨硼烷分解放氢过程中的诱导期,同时降低了放氢过程的活化能。用Pt/CNTs做模板对氨硼烷进行改性,把纳米效应和催化效应结合了起来,不仅提高了放氢速率,也抑制了杂质气体的释放。
虽然AB的理论储氢量极高,但仍存在脱氢温度高、易产生杂质气体等问题,其中最大的技术瓶颈是其可再生技术。不同条件下AB脱氢反应的生成物各不相同,寻找有效的再生加氢技术是未来的研究重点[31]。
3 有机液体储氢
3.1 有机液体储氢原理及特点
有机液体储氢技术主要是借助不饱和液体有机物与氢的可逆反应来实现加/脱氢。有机液体储氢的原理为:首先,有机液体通过催化加氢反应实现氢能的储存;然后,将加氢后的有机液体利用现有的设备进行储存和输运;最后,通过催化脱氢反应,将储存的氢气释放出来。
有机液体储氢优点是:储氢量大,较好的有机液体储氢材料是苯和甲苯,其理论储氢量分别为7.19%和6.18%;安全性高,性能稳定,有机液体可以同汽油一样在常温常压下储存和运输;储氢成本低且可多次循环使用。缺点是:加氢脱氢条件苛刻,操作费用高;催化脱氢过程还伴有副反应发生,导致氢气不纯;所使用的催化剂易发生孔结构破坏、结焦失活;过高的脱氢温度与燃料电动汽车理想的工作温度范围有一定差距。
3.2 有机液体储氢材料
目前研究较多的有机液体储氢材料主要有环己烷、甲基环己烷、萘烷等。原因在于这几种烷烃的熔沸点区间合适,在室温下都处于液态,而且原料易得,脱氢转化率也较高。表2列出了3种有机液体储氢材料环己烷、甲基环己烷、萘烷的熔沸点和理论储氢量[32]。
Pez等[33]最早从理论计算上对新型液态有机分子进行了设计与预测。研究表明,在多环芳香烃中引入氮杂环可以有效降低脱氢焓,因而脱氢温度也相应的得到降低。该作者还提出了一种新的热力学计算方法来确定有机分子脱氢的温度,并通过此方法从理论上筛选出一系列可能的新型有机液体储氢材料,并对之进行了相应的实验测试。
氮乙基咔唑是最早发现的脱氢温度低于200℃的、可完全加/脱氢的有机液体储氢材料。氮乙基咔唑的熔点为68℃,脱氢反应焓约为50kJ/mol,其理论储氢密度可以达到5.8%,氢气纯度高达99.9%,且完全没有CO、NH3等可能毒化催化剂的气体产生[34]。
3.3 脱氢催化剂
由于有机液体的加氢反应是一个热力学放热过程,完全催化加氢反应相对容易,而脱氢反应是一个强吸热、高度可逆的反应,高温和低压有利于反应的进行,因此,寻找合适的脱氢催化剂是有机液体氢化物储氢技术应用的关键。目前迫切需要开发出低温高效、长寿命脱氢催化剂。通常使用的脱氢催化剂为负载型金属催化剂,活性组分为Pt、Pd、Rh、Ni、Co等,载体为Al2O3、SiO2、活性炭等[32]。
Pt基催化剂在脱氢反应过程中得到广泛应用[35],在Pt/Al2O3的催化作用下,脱氢反应选择性很高,接近100%。但从经济角度考虑,应减少Pt贵金属的使用量。催化剂中第二组分如Ni、Mo、W、Re、Rh、Pd、Ir、Sn等的添加,可以提高催化脱氢活性并减少贵金属的使用量。Pt-Sn/γ-Al2O3是目前采用较多的脱氢催化剂,Sn的加入可以抑制催化剂结焦失活,提高催化剂稳定性,并抑制氢解破坏作用,但是Sn的加入也使Pt/Al2O3的催化活性尤其是初始活性降低[36]。Kariya等[37]研究了Pt催化剂中添加另一种金属组分(Mo、W、Re、Rh、Pd、Ir、Sn)后形成的双金属催化剂。研究发现双金属催化剂可以加快脱氢速率,其原因可能是第二金属组分使得C—H键断裂更加容易,增强了芳香族产物的脱附能力,使氢气快速离开反应体系,推动化学平衡向脱氢方向移动。此外,研究还发现将Pt/AC和Pd/AC催化剂混合后用于脱氢反应,催化活性比单独使用Pt/AC或Pd/AC催化剂更好,其原因可能是氢在Pt和Pd催化剂上的溢出-迁移-再结合过程的协同作用。
El-Nabarawy[38]研究发现脱氢催化剂金属组分的分散度(表面金属原子和总金属原子之比)是影响其低温脱氢活性的主要因素,金属组分分散度越高,催化剂反应活性越强。实验结果表明,300℃时纳米脱氢催化剂对MCH的脱氢转化率比Pt-Sn-K/Al2O3提高了近30%。因此,开发纳米级脱氢催化剂,提高活性组分的分散度,可望获得低温脱氢性能优异的催化剂。
有机液体储氢材料由于其较高的储氢容量和便于运输等优点备受关注,是一种很有发展潜力的化学储氢材料。目前该技术的主要问题是如何提高过程的脱氢效率、开发低温高效脱氢催化剂、选择合适的反应模式、优化反应条件等。

表2 环己烷、甲基环己烷、萘烷的物理化学性质及储氢性能
4 结 语
氢能作为一种高效、清洁的能源至今没有商业化,根本制约在于氢的储存问题难以解决。尽管储氢材料的研究近年来取得了重要的进展,但在储氢容量、工作温度、可逆循环性能等方面还不能同时满足实用化要求。金属氢化物过于稳定,加/脱氢只能在较高温度下进行,热交换比较困难。配位氢化物储氢密度较高,然而可逆循环性能较差直接限制了其规模应用。液体有机物储氢量高,还可以同汽油一样在常温常压下运输,如果能开发出高稳定性、高转化率和高选择性的脱氢催化剂,将大幅度推动氢能利用。
除上述3种主要储氢材料外,一些学者还研究了其他新型化学储氢方法。文献[39-40]报道了利用生物酶催化二氧化碳加氢的方式制取甲酸盐,氢可以通过甲酸盐实现安全的储存和运输。文献[41]报道了利用金属有机骨架化合物储氢,这类新型固体材料比表面积大,在氢的储存方面展示出了广阔的应用前景。
未来储氢研究的重点将集中在高容量、高安全性、高可逆性的储氢材料研发,如果上述重点问题能够得到有效解决,必将推动“氢经济”时代的早日到来。
[1] Orimo S,Nakamori Y,Eliseo J R,et al. Complex hydrides for hydrogen storage[J].Chemical Reviews,2007,38:4111-4132.
[2] Satyapal S,Petrovic J,Read C,et al. The U.S. department of energy’s national hydrogen storage project:Progress towards meeting hydrogen-powered vehicle requirements[J].Catalysis Today,2007,120:246-256.
[3] 应燕君. La-Mg-Ni系AB3.0-3.5型储氢合金结构与储氢性能研究[D].上海:上海交通大学,2012.
[4] Zhang Y H,Wang G Q,Dong X P,et al. Effect of substituting Co with Fe on the cycle stabilities of the as-cast and quenched AB5-type hydrogen storage alloys[J].Journal of Power Sources,2005,148:105-111.
[5] An X H,Pan Y B,Luo Q,et al. Application of a new kinetic model for the hydriding kinetics of LaNi5-xAlx(0≤x≤1.0)alloys[J].Journal of Alloys and Compounsd,2010,506:63-69.
[6] Kumar E A,Maiya M P,Murthy S S,et al. Structural,hydrogen storage and thermodynamic properties of some mischmetal-nickel alloys with partial substitutions for nickel[J].Journal of Alloys and Compounsd,2009,476:92-97.
[7] Bououdina M,Grant D,Walker G. Review on hydrogen absorbing materials——Structure,microstructure,and thermodynamic properties[J].International Journal of Hydrogen Energy,2006,31:177-182.
[8] Yadav T P,Shahi R R,Srivastava O N. Synthesis,characterization and hydrogen storage behaviour of AB2[ZrFe2,Zr(Fe0.75V0.25)2,Zr(Fe0.5V0.5)2] type materials[J].International Journal of Hydrogen Energy,2012,37:3689-3696.
[9] Young K,Ouchi T,Yang J,et al. Studies of off-stoichiometric AB2metal hydride alloy:Part 1. Structural characteristics[J].International Journal of Hydrogen Energy,2011,36:11137-11145.
[10] Young K,Nei J,Huang B,et al. Studies of off-stoichiometric AB2metal hydride alloy:Part 2. Hydrogen storage and electrochemical properties[J].International Journal of Hydrogen Energy,2011,36:11146-11154.
[11] Qin M,Lan Z,Ding Y,et al. A study on hydrogen storage and electrochemical properties of La0.55Pr0.05Nd0.15Mg0.25Ni3.5(Co0.5Al0.5)x(x=0.0,0.1,0.3,0.5) alloys[J].Journal of Rare Earths,2012,30:222-227.
[12] Gao J,Yan X L,Zhao Z Y,et al. Effect of annealed treatment on microstructure and cyclic stability for La-Mg-Ni hydrogen storage alloys[J].Journal of Power Sources,2012,209:257-261.
[13] Young K,Ouchi T,Huang B. Effects of annealing and stoichiometry to (Nd,Mg)(Ni,Al)3.5metal hydride alloys[J].Journal of Power Sources,2012,215:152-159.
[14] Finholt A,Jacobson E,Ogard A,et al. Organic reductions by sodium aluminum hydride[J].Journal of the American Chemical Society,1955,77:4163-4163.
[15] Zaluski L,Zaluska A,Ström-Olsen J. Hydrogenation properties of complex alkali metal hydrides fabricated by mechano-chemical synthesis[J].Journal of Alloys and Compounsd,1999,290:71-78.
[16] Wang P,Kang X,Cheng H. Dependence of H-storage performance on preparation conditions in TiF3doped NaAlH4[J].Journal of Alloys and Compounsd,2006,421:217-222.
[17] Bogdanović B,Felderhoff M,Pommerin A,et al. Cycling properties of Sc- and Ce-doped NaAlH4hydrogen storage materials prepared by the one-step direct synthesis method[J].Journal of Alloys and Compounsd,2009,471:383-386.
[18] Walters R T,Scogin J H. A reversible hydrogen storage mechanism for sodium alanate:The role of alanes and the catalytic effect of the dopant[J].Journal of Alloys and Compounsd,2004,379:135-142.
[19] Schuth F,Bogdanovic B,Felderhoff M. Light metal hydrides and complex hydrides for hydrogen storage[J].Chemical Communications,2004,20:2249-2258.
[20] 肖学章. 纳米/非晶镁基复合物与配位铝氢化物的合成、微结构及储氢性能研究[D]. 杭州:浙江大学,2008.
[21] Akdim O,Demirci U B,Muller D,et al. Cobalt (Ⅱ) salts,performing materials for generating hydrogen from sodium borohydride[J].International Journal of Hydrogen Energy,2009,34:2631-2637.
[22] Chen P,Xiong Z,Lin J,et al. Interaction of hydrogen with metal nitrides and imides[J].Nature,2002,420:3.
[23] Chen P,Xiong Z,Luo J,et al. Interaction between lithium amide and lithium hydride[J].The Journal of Physical Chemistry B,2003,107:10967-10970.
[24] Hu Y H,Ruckenstein E. Ultrafast reaction between LiH and NH3during H2storage in Li3N[J].The Journal of Physical Chemistry A,2003,107:9737-9739.
[25] Ichikawa T,Hanada N,Isobe S,et al. Hydrogen storage properties in Ti catalyzed Li-N-H system[J].Journal of Alloys and Compounsd,2005,404-406:435-438.
[26] Leng H,Wu Z,Duan W,et al. Effect of MgCl2additives on theH-desorption properties of Li-N-H system[J].International Journal of Hydrogen Energy,2012,37:903-907.
[27] Wolf G,van Miltenburg J C,Wolf U. Thermochemical investigations on borazane (BH3-NH3) in the temperature range from 10 to 289K[J].Thermochimica Acta,1998,317:111-116.
[28] Xiong Z,Yong C K,Wu G,et al. High-capacity hydrogen storage in lithium and sodium amidoboranes[J].Nature Materials,2007,7:138-141.
[29] Liu C H,Wu Y C,Chou C C,et al. Hydrogen generated from hydrolysis of ammonia borane using cobalt and ruthenium based catalysts[J].International Journal of Hydrogen Energy,2012,37:2950-2959.
[30] 李韶峰. 氨基硼烷(NH3BH3)复合储氢材料及其烷基衍生物的热分解性能与机理研究[D]. 上海:复旦大学,2012.
[31] Sutton A D,Burrell A K,Dixon D A,et al. Regeneration of ammonia borane spent fuel by direct reaction with hydrazine and liquid ammonia[J].Science,2011,331:1426-1429.
[32] Shukla A,Karmakar S,Biniwale R B. Hydrogen delivery through liquid organic hydrides:Considerations for a potential technology[J].International Journal of Hydrogen Energy,2012,37:3719-3726.
[33] Pez G P,Scott A R,Cooper A C,et al. Hydrogen storage by reversible hydrogenation of pi-conjugated substrates:US,7351395 B1[P]. 2008-04-01.
[34] Sotoodeh F,Smith K J. Kinetics of hydrogen uptake and release from heteroaromatic compounds for hydrogen storage[J].Industrial and Engineering Chemistry Research,2010,49:1018.
[35] Song H,Wu X,Wang H,et al. Promoting effects of Pt on the catalytic performance of supported NiB amorphous alloy catalysts for benzene hydrogenation[J].Chinese Journal of Chemical Engineering,2011,19:698-702.
[36] González-Marcos M P,Iñarra B,Guil J M,et al. Development of an industrial characterisation method for naphtha reforming bimetallic Pt-Sn/Al2O3catalysts throughn-heptane reforming test reactions[J].Catalysis Today,2005,107-108:685-692.
[37] Kariya N,Fukuoka A,Ichikawa M. Efficient evolution of hydrogen from liquid cycloalkanes over Pt-containing catalysts supported on active carbons under “wet-dry multiphase conditions”[J].Applied Catalysis A:General,2002,233:91-102.
[38] El-Nabarawy T. Dehydrogenation of cyclohexane in relation to some textural and catalytic properties of Ni/Al2O3and Co/Al2O3catalysts[J].Adsorption Science and Technology,1997,15:25-37.
[39] Pereira I A. An enzymatic route to H2storage[J].Science,2013,342:1329-1330.
[40] Kåhrström C T. Industrial microbiology:Bacterial enzyme fuels CO2hydrogenation[J].Nature Reviews Microbiology,2014,12:74-74. [41] Furukawa H,Cordova K E,O’Keeffe M,et al. The chemistry and applications of metal-organic frameworks[J].Science,2013,341:6149.
Research progress in chemical hydrogen storage
ZHOU Peng1,2,LIU Qibin1,SUI Jun1,JIN Hongguang1
(1Institute of Engineering Thermophysics,Chinese Academy of Sciences,Beijing 100190,China;2University of Chinese Academy of Sciences,Beijing 100049,China)
As a high-efficient and clean energy carrier,hydrogen is regarded as the most potential energy in the 21th century. The key to large-scale hydrogen applications is hydrogen storage. Compared to physical hydrogen storage,chemical hydrogen storage is more efficient and safer. There exist three main chemical hydrogen storage technologies,which are metal hydrides,complex hydrides and organic liquid hydrides. The research progresses of these technologies were briefly reviewed. R-Mg-Ni type hydrogen storage alloy is a cheap alloy with high capacity found in recent years,but they are still too stable,and their hydrogenation / dehydrogenation performances are poor. Complex hydrides are rich in light metal elements so that they can store large quantities of hydrogen. But their reversible cycling performances are often too poor which limit their applications. Organic liquid hydrides not only have high hydrogen storage capacity,but also can be transported as gasoline at ordinary temperature and pressure. Furthermore,cyclohexane,benzene and other organic hydrogen storage medium can be produced in the industry of large scale. If dehydrogenation catalysts with good stability,high activity and large selectivity are developed,the large-scale application of hydrogen will be promoted substantially.
hydrogen;chemical reaction;metal hydrides;complex hydrides;organic liquid hydrides;catalysis
TK 91
A
1000-6613(2014)08-2004-08
10.3969/j.issn.1000-6613.2014.08.011
2013-12-19;修改稿日期:2014-03-16。
周鹏(1988—),硕士研究生。E-mail 826091915@qq.com。
联系人:刘启斌,研究员。E-mail qibinliu@iet.cn。
