小鼠17β-hsd10的克隆、表达及双抗夹心ELISA方法的建立
2014-06-24刘传志牛莹莹陈元安武成于源华
刘传志,牛莹莹,陈元安,武成,于源华
长春理工大学生命科学技术学院,吉林长春130022
小鼠17β-hsd10的克隆、表达及双抗夹心ELISA方法的建立
刘传志,牛莹莹,陈元安,武成,于源华
长春理工大学生命科学技术学院,吉林长春130022
原核表达小鼠17β-羟基类固醇脱氢酶(17β-hsd10),制备抗17β-hsd10多克隆抗体,建立17β-hsd10双抗夹心酶联免疫检测方法(Enzyme linked immunosorbent assay,ELISA)。采用RT-PCR技术克隆得到小鼠肝脏17β-hsd 10基因,构建原核表达体系pET15b-17β-hsd10/Escherichia coli BL21(DE3),IPTG诱导重组蛋白表达,并优化表达条件;目的蛋白用His融合蛋白纯化柱(His-Binding-resin)纯化并免疫BALB/c小鼠和新西兰大耳白兔,免疫血清总IgG采用硫酸铵沉淀法纯化,用获得的高效价鼠源和兔源两种多克隆抗体,建立17β-hsd10双抗夹心酶联免疫检测方法。表达蛋白约为29.5 kDa,纯化后浓度为1.5 mg/m L,鼠源和兔源多克隆抗体效价分别为1.25×104和2.5×104,建立的检测方法对于多种羟基类固醇脱氢酶无交叉反应,特异性良好,可检出含量约为0.05−0.1µg/m L的阳性血清。建立的17β-hsd10双抗夹心ELISA方法,简便、快速、敏感,适合实验室研究科研广泛应用。并可能为检测阿尔茨海默病提供新思路和方法。
17β-羟基类固醇脱氢酶10,双抗夹心酶联免疫方法,多克隆抗体
17β-羟基类固醇脱氢酶(17β-hsd10)属于短链脱氢酶超家族(SDR)[1-3],由17β-hsd10基因编码,参与脂肪酸β氧化,糖皮质激素和孕酮分解代谢及胆汁酸同分异构化作用[4-5]。最初,17β-hsd10被认为是3-羟氨基辅酶A脱氢酶-Ⅱ(SCHAD,HADH2)或内质网Aβ相关蛋白(ERAB)[6-8],现已证实,人类的17β-hsd10与β-淀粉样蛋白(Amyloid-β,Aβ蛋白)具有中等亲和性[5],它通过一个氨基末端紧密的靶作用信号定位于线粒体[9-10]。从人类17β-hsd10同Aβ蛋白结合的结构测定推断出Aβ蛋白的结合是特异的[11]。He等研究发现,在阿尔茨海默病(AD)转基因小鼠的突触海马体中存在17β-hsd10的富集现象[12]。Yang等的研究也证实,17β-hsd10参与大脑认知活动,在阿尔茨海默病患者和AD小鼠模型的脑中都检测到17β-hsd10的大量表达[13]。这些研究均揭示出17β-hsd10与阿尔茨海默病的相关性。
阿尔茨海默病(A lzheimer's disease,AD)即所谓的老年痴呆症,是一种致死性神经退行性疾病,据中国阿尔茨海默病协会2011年公布的调查结果显示,全球有约3 650万人患有痴呆症,平均生存期只有5.9年,是威胁老人健康的“四大杀手”之一。有研究认为,开始出现明显症状之前的几年甚至是几十年,阿尔茨海默病便已发病[14-17]。但是,目前为止,在患上AD的最早期(也就是出现明显症状之前),还没有一种有效的方法能够将其发现。
目前,诊断AD的最佳生物标志物包括核磁共振成像(MRI)、正电子发射断层扫描(PET)和脑脊液蛋白检测[18-19]。但是,这些诊断方法要么价格昂贵,要么会对患者带来极大的痛苦,一种更加快速、简便的AD诊断方法仍然是该领域研究人员不断追求的目标。
本文从小鼠肝脏中克隆得到17β-hsd10基因,原核表达小鼠17β-hsd10,制备抗17β-hsd10多克隆抗体,建立17β-hsd10双抗夹心酶联免疫检测方法(ELISA)[20-21]。可检出含量约为0.1−0.05µg/m L的阳性血清,有望成为AD的快速诊断新方法。
1 材料与方法
1.1 主要材料
IPTG(Merck公司),弗氏完全和不完全佐剂、咪唑等(Sigma公司),His-Binding-resin纯化柱(上海悦克生物技术有限公司),BALB/c小鼠、新西兰白兔由吉林大学动物室提供,96孔酶标板(Costar),HRP标记的羊抗兔抗体购自北京中杉金桥生物技术有限公司,DNM-9602酶标分析仪购自北京普朗有限公司。3α-hsd、11β-hsd、17β-hsd4、6的标准品购置于Sigma公司,组氨酸标签蛋白蛋氨酸-γ裂解酶(MGL)、pET-15b质粒及E.coli BL21(DE3)为本实验室保存。
1.2 方法
1.2.1 引物设计
根据GenBank上已登记的小鼠17β-hsd10基因序列以及表达载体的多克隆位点设计特异性引物,分别引入NdeⅠ和Bam HⅠ酶切位点(斜体带下划线)。引物序列如表1,引物合成由上海生工生物工程有限公司完成。
1.2.2 17β-hsd10基因的克隆及表达
采用天根动物组织RNA提取试剂盒提取小鼠肝脏总RNA,随后采用RT-PCR试剂盒合成小鼠17β-hsd10基因cDNA第一链,以此为模板进行PCR扩增,反应条件:94℃,5 m in(94℃,2 m in;54℃,30 s,72℃,1 m in)循环30次;72℃,5 m in。1%琼脂糖凝胶电泳鉴定正确后回收,与pUCm-T连接后(pUCm-T-M 10)测序。

表1 小鼠17β-hsd10基因引物序列Tab le 1 Prim er sequence of 17β-hsd10 gene in m ouse

表2 17β-hsd10多克隆抗体免疫程序Tab le 2 Imm une Procedures of anti-17β-hsd10 polyclonal antibody
将pUCm-T-M 10与pET-15b分别用NdeⅠ和Bam HⅠ双酶切并回收,产物于22℃连接过夜后转化E.coli BL21(DE3),小量提取质粒进行双酶切和PCR鉴定,阳性质粒命名为pET-5b-M 10,由上海生工测序。获得重组工程菌株在37℃,培养液pH值为8.0,诱导剂IPTG的浓度为0.5 mmol/L的条件下,振荡培养48 h,12%SDS-PAGE鉴定,亲和层析(Ni)柱纯化17β-hsd10蛋白。
1.2.3 抗17β-hsd10多克隆抗体的制备及纯化
用纯化后的17β-hsd10蛋白分3次免疫新西兰大耳白兔和BALB/c小鼠,每次间隔2周,第二、三次免疫1周后取血清,免疫程序如表2。
用ELISA法测定效价,以免疫前的血清作为阴性对照,阳性判定标准:P/N>2.1记为阳性,抗体效价:阳性孔最大稀释倍数记为抗体效价。抗血清在13 000 r/m in,离心5 m in,收集上清。等体积生理盐水混匀滴加硫酸铵(体积分数50%),用浓氨水调至pH值8.0,充分沉淀抗体。室温平衡后,离心,弃上清。重复此沉淀步骤2–3次。最后一次离心后所得沉淀物即为粗提IgG抗体。将此沉淀物溶于4–5 m L生理盐水中,装入透析袋4℃透析过夜。于–20℃保存。
1.2.4 双抗夹心ELISA方法的建立
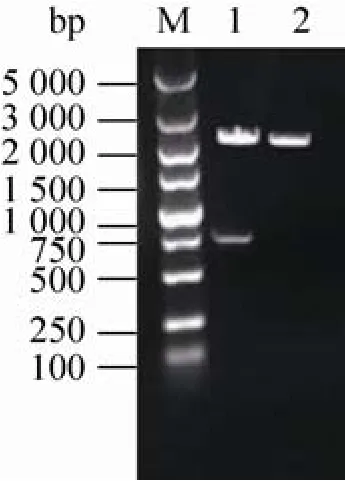
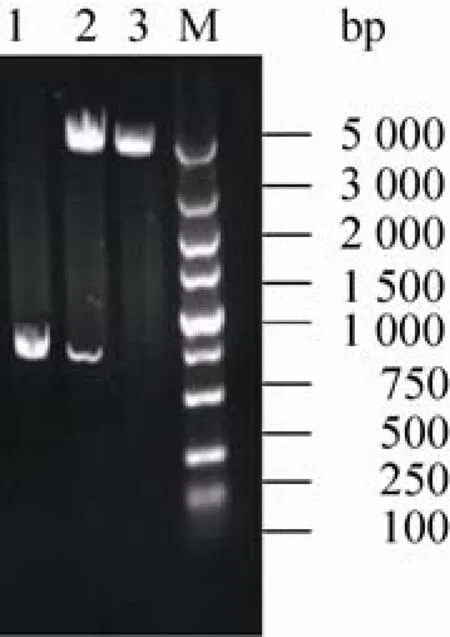
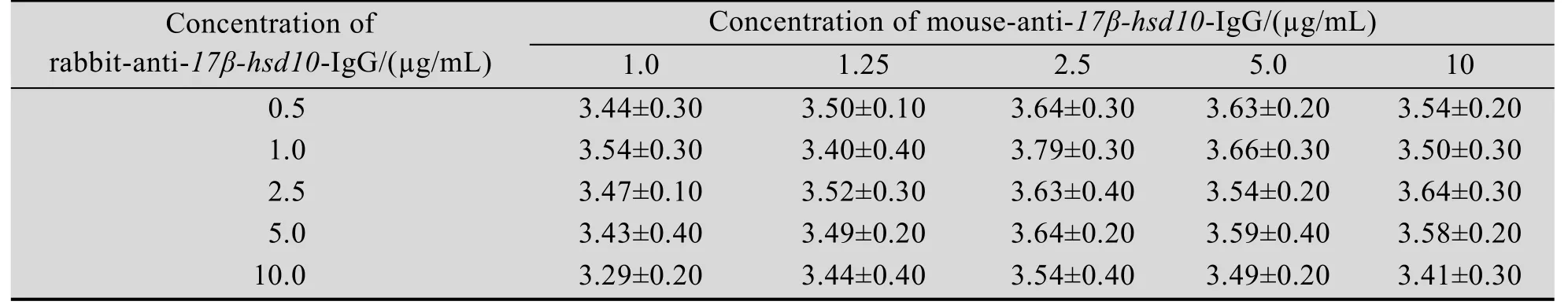
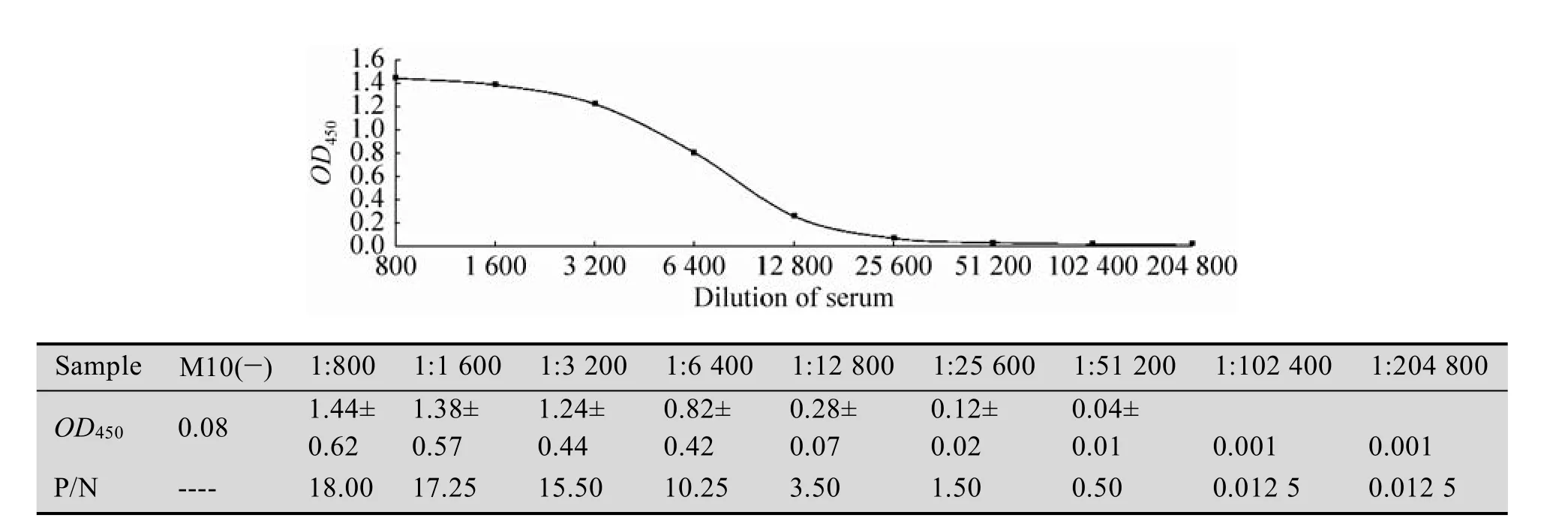
以pH9.6的碳酸盐缓冲液稀释鼠源抗17β-hsd10多抗,包被酶标板,100µL/孔,4℃过夜;用洗涤液(含0.05% 1.2.5 特异性实验 用建立的ELISA方法检测含有3α-hsd、11β-hsd、17β-hsd4、7的标准品,并用实验室表达的His-标签蛋白蛋氨酸-γ裂解酶(MGL)做标签鉴定。同时设阳性、阴性和空白对照,进行交叉反应实验,以评价该方法的特异性。 1.2.6 敏感性实验 将已确定浓度的17β-hsd10梯度稀释(1:800、1:1 600、1:3 200、1:6 400、1:12 800、1:25 600、1:51 200、1:102 400、1:204 800)后,取100µL进行ELISA检测,确定所建立方法的最低检出浓度。 2.1 17β-hsd10基因的克隆 应用设计的引物及RT-PCR技术扩增了小鼠17β-hsd10的全长cDNA,构建重组质粒pUCm-T-M 10,经NdeⅠ和Bam HⅠ双酶切,获得789 bp的条带,如图1,测序证实为目的基因。 2.2 17β-hsd10表达质粒的构建 构建的重组质粒双酶切及PCR鉴定结果分别如图2所示,质粒构建成功,对重组质粒pET-15b-M 10进行PCR鉴定得到1条带证实,大小正确。 图1 重组质粒pUCm-T-M 10双酶切鉴定电泳图谱Fig.1 Electrophoretogram is double enzyme digestion of pUCm-T-M 10.1:samples;2:pUCm-T;M:DL5 000 DNA marker. 图2 重组质粒pET-15b-M 10双酶切鉴定及PCR鉴定电泳图谱电泳图谱Fig.2 Electrophoretogram is double enzyme digestion and PCR of pET-15b-M 10.1:PCR of pET-15b-M 10;2: sample;3:pET-15b;M:DL5 000 DNA marker. 2.3 17β-hsd10的表达及纯化 重组工程菌株采用IPTG诱导,使其表达17β-hsd10蛋白,对诱导表达过程中的主要影响因素进行优化分析,纯化产物SDS-PAGE鉴定如图3,在约29.5 kDa处有一条明显表达带,与预期蛋白分子量相符。 2.4 双抗夹心ELISA方法的建立 本研究最终获得的兔源和鼠源抗17β-hsd10多克隆抗体效价分别为1.25×104和2.5×104。其中鼠源多克隆抗体的最佳包被浓度为2.5µg/m L,兔源多克隆抗体的最佳工作浓度为1.0µg/m L,酶标抗体的稀释倍数为1:5 000。方阵试验数据为对应反应条件下的S/N值(表3)。 17β-hsd10;3:E.coli BL21(pET-15b);4:E.coli BL21 (pET-15b-M 10). 图3 17β-hsd10蛋白诱导表达及纯化SDS-PAGE电泳图谱Fig.3 SDS-PAGE analysis of recombinant 17β-hsd10 protein expression and purified protein.M:marker;1,2: 2.5 特异性实验 用本研究建立的方法对3α-hsd、11β-hsd、17β-hsd4、7的标准品进行检测,蛋氨酸-γ裂解酶(MGL),M 10(+)为含有17β-hsd10和M 10(–)为不含有17β-hsd10。结果显示除重组蛋白显示阳性外,其他受试蛋白并未测出阳性,说明本方法的特异性较好(表4)。 2.6 敏感性实验 检测17β-hsd10(M 10+)阳性血清,OD450值随着稀释倍数的增加而减小(图4),当血清12 800倍稀释时,检测结果为阳性,当血清25 600倍稀释时,检测结果为阴性,即所能检测的最小范围在0.1−0.05 μg/m L,所建立的方法具有较好的敏感性。 表3 鼠源抗17β-hsd10多抗及兔源抗17β-hsd10多抗的最佳工作浓度确定Tab le 3 Determ ination of the op timal concentration of coating antibody and rabbit-anti-17β-hsd10-IgG 表4 交叉反应实验Tab le 4 The ELISA specific test 图4 ELISA检测M 10阳性血清的最大稀释倍数和P/N值Fig.4 The dilution ratio of the positive serum sample by ELISA.Carry 3 groups,two parallel samples of each group,the above OD450data are average for each group. 本文克隆了与AD相关的17β-hsd10的基因,与已登记的小鼠17β-hsd10比对,未发现碱基突变;经BLAST比对发现,与人类的17β-hsd10的基因同源性为99%。SDS-PAGE凝胶电泳结果显示,17β-hsd10在E.coli中获得了高纯度表达。采用该纯化蛋白作为抗原免疫动物,获得了高效价多克隆抗体,3α-hsd、11β-hsd、17β-hsd等其他类型的羟基类固醇脱氢酶呈阴性反应,说明该方法对于17β-hsd10具有良好的特异性;同时,实验结果显示,当血清中存在0.05µg/m L以上的17β-hsd10时,该方法仍然可以准确检出,说明本文建立的方法具有高度的敏感性。本文建立的17β-hsd10双抗夹心ELISA方法,通过进一步地改进提高与验证,为研制检测阿尔茨海黙病新方法奠定了基础。 REFERENCES [1]Lukacik P,Keller B,Bunkoczi G,et al.Structural and biochem ical characterization of human orphan DHRS10 reveals a novel cytosolic enzyme w ith steroid dehydrogenase activity.Biochem J,2007, 402(3):419–427. [2]M indnich R,Möller G,Adamski J,et al.The role of 17 beta-hydroxysteroid dehydrogenases.Mol Cell Endocrinol,2004,218(1/2):17–20. [3]Marchais-Oberw inkler S,Henn C,Möller G,et al. 17β-Hydroxysteroid dehydrogenases(17β-hsds)as therapeutic targets:protein structures,functions, and recent progress in inhibitor development.J Steroid Biochem Mol Biol,2011,125(1/2):66–82. [4]Hansis C,Jahner D,Spiess AN,et al.The gene for the Alzheimer-associated beta-amyloid-binding protein(ERAB)is differentially expressed in the testicular Leydig cells of the azoosperm ic by w/w(v)mouse.Eur J Biochem,1998,258:53–60. [5]He XY,Schulz H,Yu YS,et al.A human brain L-3-hydroxyacyl-coenzyme a dehydrogenase is identical to an amyloid β-peptide-binding protein involved in A lzheimer’s disease.J Biol Chem, 1998,273(17):41–46. [6]Shafqat N,Marschall HU,Filling C,et al.Expanded substrate screenings of human and Drosophila type 10 17beta-hydroxysteroid dehydrogenases(hsds) reveal multiple specificities in bile acid and steroid hormone metabolism:characterization of multifunctional 3alpha/7alpha/7beta/17beta/20beta/ 21-H.Biochem J,2003,376(Pt 1):49–60. [7]Liao YC,Lee WJ,Hwang JP,et al.ABCA7 gene and the risk of A lzheimer's disease in Han Chinesein Taiwan.Neurobiol Aging,2014,10(1) 1547–1558. [8]Rosenthal SL,Kamboh M I.Late-onset A lzheimer's disease genes and the potentially implicated pathways, Curr Genet Med Rep,2014,3(2):85–101. [9]He XY,Merz G,Yang YZ,et al.Characterization and localization of human type10 17betahydroxysteroid dehydrog-enase.Eur J Biochem, 2001,268(18):4899–4907. [10]Yan SD,Fu J,Soto C,et al.An intracellular protein that binds amyloid-beta peptide and mediates neurotoxicity in Alzheimer’s disease.Nature,1997, 389(6652):689–695. [11]Hort J,O’Brien JT,Gainotti G,et al.EFNS guidelines for the diagnosis and management of Alzheimer’s disease.Eur J Neurol,2010,17(10): 1236–1248. [12]He XY,Wen GY,Merz G,et al.Abundant type 10 17b-hydroxysteroid dehydrogenase in the hippocampus of mouse A lzheimer’s disease model. Brain Res Mol Brain Res,2002,99(1):46–53. [13]Yang SY,He XY,M iller D,et al.Hydroxysteroid (17β)dehydrogenase X in human health and disease.M ol Cell Endocrinol,2011,343(1/2):1–6. [14]Wu F,Cai ZY,Yan Y,et al.Advances in the pathogenesis of Alzheimer's disease metabolize sugars derived.Chongqing Medical,2008,37(17): 1999–2000(in Chinese).吴芳,蔡志友,晏勇,等.阿尔茨海默病糖代谢源性发病机制研究进展.重庆医学,2008,37(17): 1999–2000. [15]Niu FN,Sun ZZ,Xu Y,et al.Advances in molecular targets marked the early diagnosis of A lzheimer's disease.J Inter Neurol Neurosurg, 2009,1:86–90(in Chinese).牛丰南,孙宗正,徐运,等.阿尔茨海默病早期诊断的分子靶标研究进展.国际神经病学神经外科学杂志,2009,1:86–90. [16]Kong YY,Guan YH,Wu P,et al.Novel PET molecular probes for early diagnosis of A lzheimer‘s disease.Inter J Radiation Med Nuclear Med,2012,36(5):17–24(in Chinese).孔艳艳,管一晖,吴平,等.PET分子探针在阿尔茨海默病早期诊断中的研究进展.国际放射医学核医学杂志,2012,36(5):17–24. [17]Rusinek H,Santi,Frid D,et al.Regional brain atrophy rate predicts future cognitive decline:6-year longitudinal MR imaging study of normal aging. Radiology,2003,229(3):691–696. [18]Dimou E,Booij J,Rodrigues M,et al.Amyloid PET and MRI in A lzheimer's disease and m ild cognitive impairment.Curr A lzheimer Res,2009, 6(3):312–319. [19]Valotassiou V,Archimandritis S,Sifakis N,et al. A lzheimer's disease:spect and pet tracers for beta-amyloid imaging.Curr Alzheimer Res,2010, 7(6):477–486. [20]Clark CM,Schneider JA,Bedell BJ,et al.Use of florbetapir-PET for imaging beta-amyloid pathology.JAMA,2011,305(3):275–283. [21]Wong DF,Rosenberg PB,Zhou Y.In vivo imaging of amyloid deposition in A lzheimer Disease using the radioligand 18F-AV-45(flobetapir[corrdcted] F 18).J Nucl Med,2010,51(6):913–920. (本文责编 陈宏宇) M olecular cloning,prokaryotic expression and double-antibody sandw ich ELISA developm ent of 17β-hsd10 in mouse Chuanzhi Liu,Yingying Niu,Yuan’an Chen,Cheng W u,and Yuanhua Yu School of Life Science and Technology,Changchun University of Science&Technology,Changchun 130022,Jilin,China We expressed 17β-hydroxysteroid dehydrogenase10(17β-hsd10)recombinant protein,prepared anti-17βhsd10 polyclonal antibodies and established sandw ich enzyme linked immunosorbent assay(ELISA)test for detection of 17β-hsd10.RT-PCR was used to get the gene of 17β-hsd10 of mouse liver,and a prokaryotic protein expression system pET15b-17β-hsd10/Escherichia coli BL21(DE3)which induced w ith isopropyl-1-thio-β-galactopyranoside(IPTG)for recombinant protein expression was constructed subsequently.The target protein purified using His-Binding-resin column was used to immunize BALB/c m ice and rabbits,serum total IgGs from immunized animals were purified by ammonium sulfate precipitation method.We established a Double-antibody Sandw ich enzyme linked immunosorbent assay about 17β-hsd10 using the two antibodies we prepared.We got the concentration of 1.5 mg/m L of 17β-hsd10 protein w ith molecular weight of 29.5 kDa,and polyclonal antibodies from mouse and rabbit w ith the tite 1.25×104and 2.5×104respectively.The concentration of 0.1µg/m L of 17β-hsd10 can be detected by the Double-antibody Sandw ich ELISA we established,and the assay was sensitive and specific.It can be w idely used in clinical and experimental study. 17β-hydroxysteroid dehydrogenase10,double-antibody Sandw ich ELISA,polyclonal antibodies January 26,2014;Accep ted:July 25,2014 Yuanhua Yu.Tel/Fax:+86-431-85583099;E-mail:yuyuanhua8888@126.com 刘传志,牛莹莹,陈元安,等.小鼠17β-hsd10的克隆、表达及双抗夹心ELISA方法的建立.生物工程学报,2014,30(11): 1774–1780. Liu CZ,Niu YY,Chen YA,et al.Molecular cloning,prokaryotic expression and double-antibody sandw ich ELISA development of 17β-hsd10 in mouse.Chin J Biotech,2014,30(11):1774–1780. Suppo rted by:Key Project in the Science and Technology Development Program of Jilin(No.20120963). 吉林省科技发展计划重点项目(No.20120963)资助。2 结果


3 讨论
