秋季东海二甲基硫和二甲巯基丙酸内盐浓度分布及降解速率研究❋
2014-06-24杨桂朋张洪海
杨桂朋,刘 龙,张洪海
(中国海洋大学化学化工学院,山东青岛266100)
秋季东海二甲基硫和二甲巯基丙酸内盐浓度分布及降解速率研究❋
杨桂朋,刘 龙,张洪海
(中国海洋大学化学化工学院,山东青岛266100)
于2013年10~11月现场测定了东海中二甲基硫(DMS)及其前体物质二甲巯基丙酸内盐(DMSP,分为溶解态DMSPd和颗粒态DMSPp)的含量,研究其水平分布特征、DMSPp的粒径分布及DMSPd的降解速率,并对DMS的海-气交换通量进行了探讨。研究结果表明,表层海水中DMS、DMSPd和DMSPp的浓度平均值分别为(4.84±0.40)、(5.84± 0.93)和(13.01±0.52)nmol·L-1。海水中DMSPd的降解速率在2.59~16.36 nmol·L-1·d-1之间,平均值为(6.78± 0.84)nmol·L-1·d-1。调查海域范围内,小型浮游植物(>20μm)是DMSPp和叶绿素a(Chl a)重要贡献者。此外,秋季东海表层海水DMS的海-气交换通量为0.66~31.73μmol·m-2·d-1,平均值为(11.63±0.71)μmol·m-2·d-1。
二甲基硫(DMS);二甲巯基丙酸内盐(DMSP);分布;降解速率;粒径分布;海-气通量
二甲基硫(Dimethylsulfide,DMS)是大气硫化物最主要的天然来源之一,是海水中最重要的挥发性生源有机硫化物[1-5],其向大气中的排放量约占全球海洋硫释放量的2/3[6],是参与全球硫循环的重要物质。通过海-气交换进入大气中的DMS与·OH、·NO3、IO·等自由基反应生成的SO2和甲基磺酸盐(MSA)及之后生成的非海盐硫酸盐(nss-SO2-4),是酸雨的重要贡献者。此外,nss-SO2-4气溶胶能增加云凝结核(CCN)数量或使原有的结核颗粒数目增多,从而会影响云的形成和太阳辐射的漫散射系数,进而影响区域或全球气候变化[7-8]。
二甲巯基丙酸内盐(Dimethylsulfoniopropionate,DMSP)是DMS的主要前体物质,是藻类的一种硫代谢产物。DMSP的来源主要是海洋环境中的微型、大型藻类和盐生植物,但不同种群或物种细胞中DMSP的含量差异明显[9]。释放到海水中的DMSP部分会在细菌或某些藻类释放的DMSP裂解酶作用下裂解生成DMS和丙烯酸[10],因此DMSP的含量及转化过程会直接影响海洋中DMS的生产与分布。
作为世界上最具代表性的大陆架海区之一的东海,处于长江冲淡水、黑潮、台湾暖流、东海沿岸流的综合作用区[11-12]。受到复杂水文条件的影响,不同季节生源硫的浓度分布存在较大差异。国内,Yang[13-14]等研究了中国东海、黄海中DMS、DMSP的浓度分布,但研究却集中在春季和夏季,秋季的研究报道较少。国外的Andreae等[15]、Scarratt等[16]对DMSPp在浮游植物中的粒径分布已有研究报道,而国内有关这方面的研究甚少。因此,本文以东海为研究海域,研究了秋季东海表层海水中DMS和DMSP浓度分布和溶解态DMSP(DMSPd)的降解速率,重点探讨了不同粒径浮游生物对颗粒态DMSP(DMSPp)的贡献,并定量估算了秋季DMS海-气通量,对于更好地认识中国近海生源硫化物(DMS和DMSP)的生产、分布及迁移转化过程具有重要的科学意义。
1 样品采集与分析方法
1.1样品采集
海水样品 于2013年10月10日~11月20日,随中国科学院“科学三号”考察船对东海海域进行调查取样(见图1),共包括30个大面站位。海水样品由12 L Niskin采水器采集后,现场分析其中DMS的含量。对于DMSP样品,取4 mL海水样品用内置Whatman GF/F玻璃纤维滤膜(孔径0.7μm)的Gelman过滤器进行重力过滤,滤液装入4 mL聚丙烯离心管中,后加入20μL 50%H2SO4固定(用来除去海水样品中存在的DMS[17]),即为DMSPd样品;另外,取10 mL海水样品直接装入10 m L的离心管中,然后加入50μL 50%H2SO4固定,用于测定总DMSP(DMSPt)含量,其中DMSPp的含量由DMSPt减去DMSPd获得。所有DMSP样品均在4℃下避光保存,待返回实验室后尽快完成测定。
DMSP粒径分级样品 取250 mL表层海水依次用20、5、2和0.2μm的尼龙滤膜重力过滤,将所得滤膜对折用锡纸包裹后避光冷冻(-20℃)保存,待回到实验室后尽快测定其中叶绿素a(Chl a)的含量。另外,取40 mL表层海水依次用上述不同粒径的尼龙滤膜重力过滤,将所得滤膜分别装入盛有2 mL 10 mol·L-1KOH溶液的42 mL的玻璃样品瓶中,后加入40 mL高纯水至无顶空,拧盖密封,4℃下避光保存,返回实验室后尽快测定其中DMSPp的含量。

图1 2013年10~11月东海调查站位示意图Fig.1 Locations of sampling stations in the East China Sea during cruise in October-November,2013
1.2分析方法
1.2.1 DMS测定 样品采用气提-冷阱捕集法测定[18]。用2 mL玻璃注射器取2 mL水样注入到样品瓶中,通入40 mL·min-1的高纯氮气进行吹扫。吹扫出的DMS气体通过Nafion干燥器(一种水汽选透性膜)除去水分后,通过六通阀富集于浸在液氮中的1/16 Teflon捕集管中;吹扫3 min后进行加热解析,解析出的DMS随载气进入GC色谱柱进行分离,然后用火焰光度检测器(FPD)进行检测。DMS样品采用外标法定量[11],即用优级纯DMS配制成一系列已知浓度的DMS标准溶液,根据浓度和峰面积的对应关系做出标准曲线,从而求出样品中的DMS的浓度。
1.2.2 DMSP测定 样品首先在强碱(p H≥13)条件下完全降解为DMS,再通过测定DMS的浓度间接获得DMSP的含量。测定时,分别向DMSPd和DMSPt样品中加入200和500μL的10 mol·L-1KOH溶液,然后避光冷藏(4℃)放置24 h以上,保证DMSP能够完全碱解转化为DMS。
1.2.3 DMSPd降解速率测定 采集海水后,取2支200 mL玻璃注射器进行培养,一支吸入200 mL海水后作为空白试样,用于计算DMSPd的净生产速率;另一支吸入200 mL海水样品后加入一定量的甜菜碱(betaine,GBT,最终浓度为5μmol·L-1,抑制DMSPd的生物降解),用于计算DMSPd的总生产速率。2支注射器密封混匀后在现场海水温度下进行避光培养,分别在t=1、2、3、4和5 h时各取4 mL海水样品用内置Whatman GF/F玻璃纤维滤膜(孔径0.7μm)的Gelman过滤器进行重力过滤,用来测定其中DMSPd的浓度,浓度随时间t变化的斜率即为生产速率。两培养液中DMSPd浓度增加速率的差值即为此海水样品中DMSPd的微生物降解速率。
2 结果与讨论
2.1表层海水中Chl a、DMS和DMSP的水平分布
秋季东海表层海水Chl a、DMS、DMSPd、DMSPp、溶解无机氮(DIN)和溶解无机磷(DIP)的水平分布如图2所示。研究结果表明,Chl a的浓度变化范围介于0.10~1.19μg·L-1之间,平均值为0.54μg·L-1。浓度最高值出现在杭州湾以南的浙江中南部近岸海域。这主要是由于近岸受人为活动的影响严重,导致营养盐含量较高,例如DH5-1站位DIN浓度高达17.13μmol·L-1,是远海DH7-7站位的10倍左右,从而使海区生物量比较高。
研究海域内DMS浓度变化范围比较大,在1.91~8.59 nmol·L-1之间,平均值为(4.84±0.40)nmol· L-1。此平均值低于东海夏季5.64 nmol·L-1[19],却明显高于冬季1.79 nmol·L-1[19]的调查结果。在水平分布上,DMS浓度存在着近岸高,外海低的分布规律。DMS浓度最高值出现在近岸的DH1-1站位,且浓度较大的站位大都集中在杭州湾及浙江中南部等海域,与Chl a分布规律相近,说明了较高浓度营养盐的存在,促进了浮游生物的大量繁殖[20],从而能产生更多的DMS释放到了海水中。
表层海水中DMSPd和DMSPp的浓度范围分别在1.29~22.36和2.92~26.51 nmol·L-1之间,平均值分别为(5.84±0.93)和(13.01±0.52)nmol·L-1。如图2所示,DMSPd和DMSPp浓度分布并不完全一致,但也大体呈现出由近岸向远海逐渐递减的趋势,高值区依然出现在浙江中南部近岸海域,这与Chl a高值区相吻合,表明该海区较大丰度的浮游植物量贡献了较高浓度的DMSP。DMSPd和DMSPp最高值同时出现在DH2-4站位,从同一航次的营养盐数据来看,DH2-4站位DIP浓度也相对较大0.038μmol·L-1,促进了浮游植物的生长,从而释放了较多的DMSP。
2.2 DMSPp的粒径贡献
海洋中的DMSP来源于浮游植物,其含量与海区初级生产力水平有重要关系。Chl a常被用作表明海区浮游生物量的指标,其时空变化和浮游植物的光合作用速率及初级生产力相似。海水中的浮游植物按照粒径大小可大体分为小型浮游植物(>20μm)、微型浮游植物(2~20μm)和超微型浮游植物(<2μm),本文中又将微型浮游植物分为2~5和5~20μm两种粒径。本航次调查期间,共选取了10个站位研究了不同粒径对DMSPp和Chl a的贡献,如图3所示。
研究结果表明,小型浮游植物(>20μm)对秋季东海海水中DMSPp和Chl a的贡献率较高,平均值分别为54.71%和90.44%。本研究结果与宋以柱等[21]对冬季东海、南黄海的调查结果(微型浮游植物的贡献占主导)不相一致。这主要在于不同季节浮游植物优势种群存在明显差异,冬季的优势种为中肋骨条藻和铁氏束毛藻等[21],而秋季东海主要优势种为粒级>20μm的菱形海线藻、丹麦细柱藻[22-23]等。优势种群各异且粒径不同,从而导致DMSPp的粒径分布具有一定的季节差异。由图3还可看出,不同粒径浮游植物对DMSPp和Chl a的贡献比例也有所差异,小型浮游植物几乎贡献了全部的Chl a,而较小的微型浮游植物对DMSPp也有一定的贡献率。从贡献率来看,小型浮游植物对DMSPp的贡献小于对Chl a的贡献,这从另一个侧面也反映出调查站位的优势藻种并不是DMSP的高产藻种。
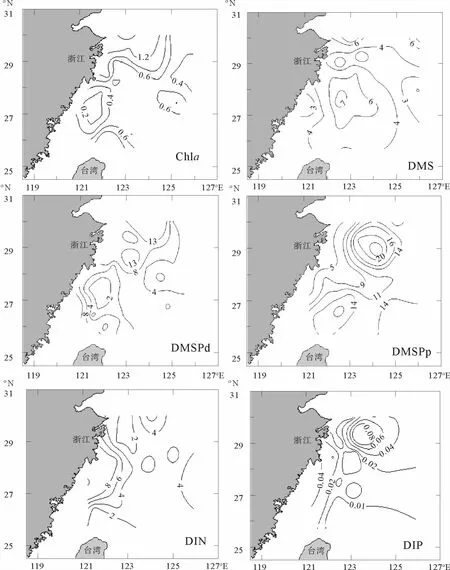
图2 秋季东海表层海水Chl a(μg·L-1)、DMS、DMSPd、DMSPp(nmol·L-1)、DIN和DIP(μmol·L-1)的水平分布图Fig.2 Horizontal distributions of Chl a(μg·L-1),DMS,DMSPd,DMSPp(nmol·L-1),DIN and DIP(μmol·L-1)in the surface water of the East China Sea during autumn
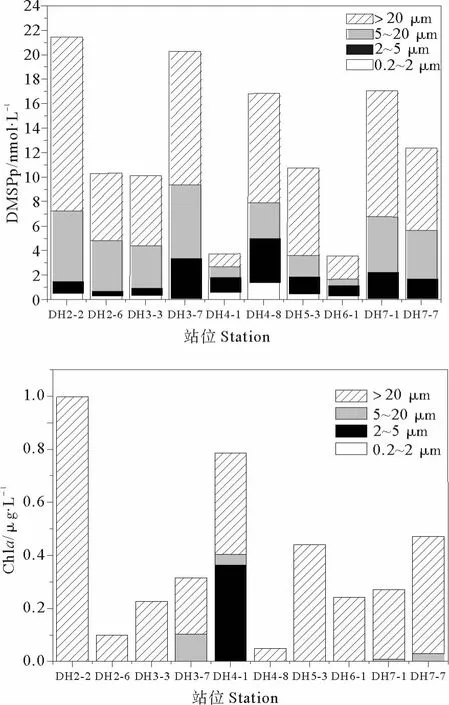
图3 秋季表层海水中DMSPp和Chl a的粒径分布Fig.3 The size distributions of DMSPp and Chl a in the surface water during autumn
2.3培养实验中DMSPd的降解速率
本研究采用Kiene和Gerard[24]的方法,添加GBT到海水样品中,以抑制内源性DMSPd的生物降解来测定DMSPd的微生物降解速率。GBT是一种DMSP结构类似物,其抑制作用主要基于DMSP与其高浓度结构类似物GBT在跨膜运输过程中的竞争机制[24-25]。考虑到所添加的mmol级别的GBT的抑制效果在加入后6~10 h内会逐步减弱[30],因此培养实验在确保GBT抑制有效的前6 h完成。
调查结果表明,海水样品中DMSPd微生物降解速率变化范围为2.59~16.4 nmol·L-1·d-1,平均值为6.79 nmol·L-1·d-1。此研究结果与厉丞烜等[26]对Mexuco海湾沿岸区域研究中采用此抑制剂方法测定的DMSPd降解速率(0.34~21.6 nmol·L-1·d-1)相接近。由表1可看出,DMSPd降解速率与DMSPd浓度并没有直接的变化关系,这说明DMSPd降解过程还受其它因素的影响,如温度、盐度、藻类种群等。此外,Belviso[27]等人发现微小的浮游动物对浮游植物的摄食对DMSP的降解起着重大作用。这一方面是浮游动物的摄食加快了DMSP的酶促分解过程,另一方面是DMSP在进入浮游动物消化系统后大大增加了DMSP的分解速率[28]。另外,多项研究表明虽然海水中只有5%~10%的DMSPd会降解为DMS[29-30],但由于DMSPd的降解速率较大,其仍然是影响气候变化的活性气体DMS的主要来源[31],这也体现了较大的DMSPd周转通量对硫循环具有不可忽视的作用。

表1 培养试验中海水样品的采样站点、环境参数、初始DMSPd浓度及GBT抑制法所估算的DMSPd降解速率Table 1 Sampling stations,environmental characters and initial DMSPd concentrations in seawater samples collected for incubation experiments and the consumption rates of DMSPd in the presence of GBT
2.4 DMS的海-气通量
DMS海-气通量的计算一般采用Liss等[32]建立的滞膜模型:

其中:F为海-气通量;K为海-气传输速率;Cl、Cg分别为DMS在水体和大气中的浓度;H为亨利定律常数。因为Cl总是远远大于Cg/H,这样DMS的海-气通量可以简化为:
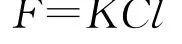
海-气传输速率K值由现场的风速和海水的温度决定,它有多种计算方法,现在常采用N2000公式[33]来估算K值:

海水中DMS的Sc根据Saltzman等[34]建立的与海水温度有关的方程式得到:

t为海水温度(℃)。
秋季东海DMS海-气通量变化范围为0.66~31.73μmol·m-2·d-1,平均值为(11.63±0.71)μmol· m-2·d-1。图4给出了各站位DMS海-气通量随DMS浓度和现场风速的变化趋势。由此可得出,DMS海-气通量在风速变化较小的情况下,与水体中DMS的浓度变化基本一致;当风速变化较大时,K值发生急剧变化,成为DMS海-气通量的主控因素,导致了DMS海-气通量的大幅度变化。其中通量最大值(31.73 μmol·m-2·d-1)出现在DMS浓度较高(7.40 nmol· L-1)和具有较大风速(8.6 m·s-1)的站位DH5-3,而通量最小值(0.66μmol·m-2·d-1)出现在DMS浓度(1.91 nmol·L-1)和现场风速(2.0 m·s-1)都最小的DH2-8站位。本文结论与Yang等[13]在黄海、东海海域春季(13.7μmol·m-2·d-1)的调查结果相接近,而明显大于夏季结果(7.45μmol·m-2·d-1)。虽然秋季不同于夏季(光照充足、海水温度适宜,浮游植物生长旺盛),DMS浓度较低,但由于秋季风速较大,平均风速达到6.1 m·s-1,导致DMS海-气通量仍然较大。这些调查结果也表明,陆架海区虽然只占全球海洋很小的一部分,但由于其较大的海气通量,使其也是全球大气DMS的重要来源。

图4 DMS海-气通量(μmol·m-2·d-1)随DMS浓度(nmol·L-1)和风速(m·s-1)的变化Fig.4 Variation of DMSsea-to-air fluxes(μmol·m-2·d-1)along with DMSconcentrations(nmol·L-1)and wind speeds(m·s-1)
3 结论
(1)秋季东海表层海水DMS与DMSP浓度总体上呈现出由近岸向远海降低的分布趋势,高值区出现在营养盐浓度较高、Chl a浓度较高的浙江中南部等近岸海域。(2)秋季东海小型浮游生物(>20μm)是海水中DMSP和Chl a的重要贡献者,决定了海水中DMSP的含量。此外,DMSPd的降解过程是海水中DMS的主要来源。(3)秋季东海较大的DMS海-气通量是由较大风速引起的,这进一步表明陆架海区是全球大气DMS的重要来源。
[1] Lovelock J E,Maggs R J,Rasmussrn R A.Atmospheric dimethyl sulphide and the natural sulphur cycle[J].Nature,1972,237:452-453.
[2] Yang G P.Dimethylsulfide enrichment in the surface microlayer of the South China Sea[J].Marine Chemistry,1999,66(3-4):215-224.
[3] Yang G P.Spatial distributions of dimethylsulfide in the South China Sea[J].Deep-Sea Research I:Oceanographic Research Papers,2000,47:177-192.
[4] Yang G P,Zhang Z B,Liu L S,et al.Study on the analysis and distribution of dimethyl sulfide in the East China Sea[J].Chinese Journal of Oceanology and Limnology,1996,14(2):141-147.
[5] Andreae M O,Barnard W R.The marine chemistry of dimethylsulfide[J].Marine Chemistry,1984,14(3):267-279.
[6] Andreae M O.Ocean-atmosphere interactions in the global biogeochemical sulfur cycle[J].Marine Chemistry,1990,30:1-29.
[7] Charlson R J,Lovelock J E,Andreae M O,et al.Oceanic phytoplankton,atmospheric sululfur,cloud albedo and climate[J].Nature,1987,326:655-661.
[8] Nguyen B C,Mihalopoulos N,Putaud J P,et al.Covariations in oceanic dimethylsulfide,its oxidation products and rain acidity at Amsterdam Island in the southern Indian Ocean[J].Journal of Atmospheric Chemistry,1992,15:39-53.
[9] 李和阳,王大志,林益明,等.海洋二甲基硫的研究进展[J].厦门大学学报:自然科学版,2001,40(3):715-725.
[10] Visscher P T,Taylor B F.Demethylafion of dimethylsulfoniopropionate to 3-mecaptopropionate by an aerobic marine bacterium[J].Applied and Environmental Microbiology,1994,60(12):4617-4619.
[11] Su J L.Circulation dynamics of the China seas north of 18 N[J]. In:Robinson A R,Brink K H.The Sea.New York:John Wiley &Sons Inc,1998,11:483-505.
[12] Lee H J,Jung K T,Foreman,M G G,et al.A three-dimensional mixed finite-difference Galerkin function model for the oceanic circulation in the Yellow Sea and the East China Sea[J].Continental Shelf Research,2000,20(8):863-895.
[13] Yang G P,Zhuang G C,Zhang H H,et al.Distribution of dimethylsulfide and dimethylsulfoniopropionate in the Yellow Sea and the East China Sea during spring:Spatio-temporal variability and controlling factors[J].Marine Chemistry,2012,138:21-31.
[14] 杨桂朋,张正斌,刘莲生.1994年秋季南沙海域二甲基硫的时空分布及其影响因素[M].南沙群岛海区化学过程研究.北京:科学出版社,1996:87-96.
[15] Andreae M O,Andreae T W,Meyerdierks D,et al.Marine sulfer cycling and the atmospheric aerosol over the spring North Atlantic[J].Chemosphere,2003,52:1321-1343.
[16] Michael G S,Maurice L,Sonia M,et al.DMSPand DMSin the Northwest Atlantic:Late-summer distributions,production rates and sea-air fluxes[J].Aquatic Sciences,2007,69:292-304.
[17] Bates T S,Cline J D,Gammon R H,et al.Regional and seasonal variations in the flux of oceanic dimethylsulfide to the atmosphere[J].Journal of Geophysical Research,1987,92:2930-2938.
[18] 杨桂朋,康志强,景伟文,等.海水中痕量DMS和DMSP分析方法的研究[J].海洋与湖沼,2007,38(4):322-328.
[19] Yang G P,Zhang H H,Zhou L M,et al.Temporal and spatial variations of dimethylsulfide(DMS)and dimethylsulfoniopropionate(DMSP)in the East China Sea and the Yellow Sea[J]. Continental Shelf Research,2011,31:1325-1335.
[20] 鲁北纬,王荣,王文琪.春季东海不同海域叶绿素a的分布特征[J].海洋科学,1997,5:53-55.
[21] 宋以柱,张洪海,杨桂朋.冬季东海、南黄海中DMS和DMSP浓度分布及影响因素研究[J].环境科学,2014,35(6).
[22] 郭术津.东海浮游植物群集研究[D].青岛:中国海洋大学,2012:35-44.
[23] 王丹,孙军,安佰正,等.2006年秋季东海陆架浮游植物群集[J].应用生态学报,2008,11:2435-2442.
[24] Kiene R P,Gerard G.Evaluation of glycine betaine as an inhibitor of dissolved dimethylsulphoniopropionate degradation in marine waters[J].Marine Ecology-Progress Series,1995,128:121-131.
[25] White R H.Analysis of dimethyl sulfonium compounds in marine algae[J].Journal of Marine Research,1982,40:539-535.
[26] 厉丞烜.海水中DMS和DMSP的生物生产与消费研究[D].青岛:中国海洋大学,2010:129.
[27] Belviso S,Kim S K,Rassoulzadegan F,et al.Production of dimethylsulfoniopropionate(DMSP)and dimethylsulfide(DMS)by a microbial food web[J].Limnol Oceanogr,1990,35:1810-1821.
[28] 杨桂朋,景伟文,陆小兰.海洋中DMSP的研究进展[J].中国海洋大学学报,2004,34(5):854-860.
[29] Ledyard K M,Dacey J W H.Microbial cycling of DMSP and DMSin coastal and oligotrophic seawater[J].Limnology and O-ceanography,1996,41:33-40.
[30] Kiene R P,Linn L J.Distribution and turnover of dissolved DMSP and its relationship with bacterial production and dimethylsulfide in the Gulf of Mexico[J].Limnology and Oceanography,2000,45:849-861.
[31] Matrai P A,Keller M D.Dimethylsulphide in a large scale coccolithophore bloom in the Gulf of Marine[J].Continental Shelf Research,1993,13:831-843.
[32] Liss P S,Merlivat L.Air-sea gas exchange rates:introduction and synthesis[C]∥.Buat-Menard P.The Role of Air-sea Exchange in Geochemical Cycling.Reidel,Dordrecht:Academic Press,1986:113-127.
[33] Nightingale P D,Malin G,Law C S,et al.In situ evaluation of air-sea gas exchange parameterizations using novel conservative and volatile tracers[J].Global Biogeochemical Cycles,2000,14:373-387.
[34] Saltzman E S,King D B,Holmen K,et al.Experimental determination of the diffusion coefficient of dimethylsulfide in water[J].Journal of Geophysical Research,1993,98(C9):16481-16486.
Distributions of Dimethylsulfide(DMS),Dimethylsulfoniopropionate(DMSP)and Degradation Rate of DMSPin the East China Sea During Autumn
YANG Gui-Peng,LIU Long,ZHANG Hong-Hai
(College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,China)
The concentrations of dimethylsulfide(DMS)and dimethylsulfoniopropionate(DMSP)in the East China Sea were measured during October-November 2013 to study their horizontal distributions,size distribution of particle DMSP(DMSPp)and degradation rate of dissolved DMSP(DMSPd).The sea-to-air flux of DMS were also estimated.The concentrations of DMS,DMSPd and DMSPp varied from 1.91 to 8.59,from 1.29 to 22.36 and from 2.92 to 26.51 nmol·L-1,respectively,with average values of(4.84± 0.40),(5.84±0.93)and(13.01±0.52)nmol·L-1.The degradation rate of DMSPd ranged from 2.59 to 16.36 nmol·d-1,with an average of(6.78±0.84)nmol·d-1.In addition,small nanophytoplankton(>20μm)contributed to the majority of DMSPp and chlorophyll a in the study area.The sea-toair fluxs of DMS in the study period ranged from 0.66 to 31.73μmol·m-2·d-1,with an average of(11.63±0.71)μmol·m-2·d-1.
dimethylsulfide;dimethylsulfoniopropionate;distribution;degradation rate;size distribution;sea-to-air flux
P734.4+3
A
1672-5174(2014)10-086-06
责任编辑 徐 环
国家自然科学基金项目(41030858;41306069;41320104008);教育部“长江学者”奖励计划项目;山东省“泰山学者”建设工程专项资助
2014-09-08;
2014-09-25
杨桂朋(1963-),男,教授,博导。E-mail:gpyang@ouc.edu.cn
