鹅坦布苏病毒E蛋白质结构域Ⅰ和ⅠⅠ在大肠杆菌中的表达及鉴定
2014-06-23赵冬敏黄欣梅刘宇卓韩凯凯谢星星刘晓燕
赵冬敏, 黄欣梅, 刘宇卓, 韩凯凯, 谢星星, 刘晓燕, 李 银
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,江苏南京 210014)
鹅坦布苏病毒(Goose tembusu virus,GTV)属于黄病毒科黄病毒属,该病毒引起坦布苏病毒病,又称产蛋下降综合症、传染性卵巢炎,是以产蛋率、采食量显著下降,出现脑炎样神经症状为特征的新型传染病。2010年4月至11月首次在中国暴发并迅速传播到国内主要鸭鹅养殖地区,包括浙江、福建、广东、广西、安徽、江苏、江西、河南、山东、河北和北京等省市,给中国鸭鹅养殖业造成严重经济损失。经过病原分离和系统的实验室诊断,证实该病病原为一种新型的坦布苏病毒病,该病的发病率高达100%,死亡率为5% ~10%。2011年和2012年夏秋季,鹅坦布苏病再次在江苏等省大面积暴发,是2010年以来危害养鸭、鹅业最严重的疾病之一[1-3]。
鹅坦布苏病毒是不分节段的单股正链RNA病毒,属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus)。鹅坦布苏病毒基因组大约11000 bp,编码3个结构蛋白质:核衣壳蛋白质(C)、外膜蛋白质(PrM and M)和囊膜蛋白质(E)及7个非结构蛋白质(NS1、NS2A、NS2B、NS3、NS4A、NS4B 和 NS5)[4]。囊膜蛋白质(E蛋白质)全长为500个氨基酸左右,相对分子质量约为54000,位于成熟病毒颗粒表面,构成病毒颗粒的突起。E蛋白质是黄病毒主要的结构蛋白质,在病毒吸附、与宿主细胞膜融合以及病毒组装过程中具有重要作用。同时,E蛋白质也是黄病毒主要的抗原成分,含有多种抗原表位,可通过诱发中和抗体产生保护性免疫应答[5]。
研究结果表明黄病毒E蛋白质二级结构主要由β-折叠组成,在空间上形成3个不同的结构域(Ⅰ、Ⅱ和Ⅲ区)[6-7]。结构域Ⅰ位于E蛋白质单聚体中央,由120个左右氨基酸组成的3个不连续片段构成一个β桶状中心结构,起到稳定E蛋白质二聚体的作用。结构域Ⅱ由2个不连续片段组成,折叠成指样结构。该区域cd环富含甘氨酸且完全疏水,在几乎所有的黄病毒属病毒中均是保守的,在E蛋白质由二聚体向三聚体转变的过程中插入胞膜,参与病毒与宿主细胞膜融合,被认为是病毒融合肽[8-9]。由此推测,坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ在病毒感染和致病过程中具有重要作用。
本研究试图克隆并表达鹅坦布苏病毒JS804株E蛋白质结构域Ⅰ和Ⅱ,并利用大肠杆菌表达系统获得重组E蛋白质结构域Ⅰ和Ⅱ的大量表达,并通过Western-blot进行验证,为进一步研究鹅坦布苏病毒的生物学特性、免疫学功能和血清学检测奠定基础。
1 材料与方法
1.1 质粒、菌株
含有鹅坦布苏病毒JS804株全基因的质粒、pET28a原核表达载体,宿主菌DH5α、BL21(DE3),E蛋白质阳性血清,均由江苏省农业科学院兽医研究所家禽重大疫病防控项目组保存。
1.2 主要试剂
琼脂糖凝胶回收试剂盒、小量提取质粒试剂盒等购自Axygen公司;pMD18-T载体、T4DNA连接酶、Ex Taq酶、限制性内切酶、DNA marker等购自大连宝生物有限公司;FLAG抗体、碱性磷酸酯酶标记山羊抗小鼠ⅠgG、BCⅠP/NBT碱性磷酸酯酶显色试剂盒购自碧云天生物技术研究所;其他试剂均为进口分装或国产分析纯。
1.3 E 蛋白质结构域Ⅰ和Ⅱ(E-Ⅰ/Ⅱ)基因的克隆
1.3.1 引物设计 根据GenBank中登录的鹅坦布苏病毒JS804株(登录号:JF 895923)E基因序列,设计PCR扩增引物,其中上游引物为E-Ⅰ/Ⅱ-F:5'-GAATTCATGGACTACAAAGACGACGACGACAAATTCAGCTGTCTGGGGATGC-3',划线部分为引入的 EcoRⅠ酶切位点,斜体部分为引入的FLAG标签序列。下 游 引 物 为 E-Ⅰ/Ⅱ-R:5'-GTCGACTCATTTGTCGTCGTCGTCTTTGTAGTCTTTCAGCTTCAAACCC TGC-3',划线部分为引入的SalⅠ酶切位点,斜体部分为引入的FLAG标签序列。以上引物由南京金斯瑞生物有限公司合成,预期扩增片段大小为893 bp。
1.3.2 E蛋白质结构域Ⅰ和Ⅱ基因的PCR扩增以含有鹅坦布苏病毒JS804株全基因的质粒为模板进行PCR扩增。PCR 反应体系为25.0 μl,其中双蒸水 15.5 μl,10 × PCR buffer 2.5 μl,25.0 mmol/L MgCl21.5 μl,dNTP(2.5 mmol/L)2.0 μl,上、下游引物(25 pmol/μl)各 1.0 μl,模板 DNA 1.0 μl,Ex Taq(5 U/μl)0.5 μl。PCR 反应程序:94 ℃ 预变性 5 min;94 ℃变性30 s,52 ℃ 退火30 s,72 ℃延伸1.5 min,30个循环;72℃延伸10 min。循环反应结束后,将扩增产物进行1.5%琼脂糖凝胶电泳检测,并对PCR产物进行胶回收。纯化的PCR产物片段与pMD18-T克隆载体连接成重组质粒,转化E.coli DH5α感受态细菌。经酶切鉴定后,挑选阳性克隆质粒送南京金斯瑞生物有限公司进行基因序列测定。测序结果在NCBⅠ进行在线比对分析。
1.4 重组表达质粒的构建与鉴定
将 pMD18-T-E-Ⅰ/ⅠⅠ和 pET28a 质粒分别用 EcoRⅠ和SalⅠ双酶切。用T4DNA连接酶将酶切后的E-Ⅰ/ⅠⅠ基因分别与 pET28a 载体连接,转化 BL21(DE3)感受态细胞,构建重组表达载体。经酶切鉴定后,挑选阳性克隆质粒送南京金斯瑞生物有限公司进行基因序列测定与分析。
1.5 E蛋白质结构域Ⅰ和Ⅱ蛋白质的诱导表达与SDS-PAGE分析
分别取含pET28a-E-Ⅰ/ⅠⅠ重组质粒的阳性BL21(DE3)菌液,接种于 5 ml含有卡那霉素(100 μg/mL)的LB液体培养基中,37℃培养过夜。次日取 100 μl接种于 10 ml含有卡那霉素(100 μg/ml)的LB液体培养基中,37℃振荡培养至OD600值达0.3 ~0.4,以终浓度1 mmol/L ⅠPTG 诱导表达,分别于诱导后4 h、6 h 取500 μl菌液,12000 r/min离心5 min,弃上清液,沉淀用生理盐水重悬后与4×蛋白质电泳上样缓冲液混匀,沸水浴5 min,以pET28a空载体进行同样的操作作为对照,进行SDS-PAGE蛋白质电泳观察结果。
1.6 重组E蛋白质结构域Ⅰ和Ⅱ蛋白质在菌体中的分布
取5 ml 1 mmol/LⅠPTG诱导4 h的菌液,12000 r/min离心5 min,弃上清液,沉淀用3 ml菌体裂解液重悬,超声波破碎15 min,12000 r/min离心5 min,分别取上清液和沉淀与4×蛋白质电泳上样缓冲液混匀,沸水浴5 min,进行SDS-PAGE蛋白质电泳观察结果,以确定表达蛋白质存在的位置。
1.7 重组蛋白质的Western-blot鉴定
重组蛋白质经12%SDS-PAGE分离后,采用湿法将蛋白质转印至硝酸纤维膜(NC)膜上,采用70 V电压,作用 1 h。5%BSA、37℃封闭 2 h,TBST(0.05%Tween-20)洗涤后分别加入FLAG标签单抗和E蛋白质阳性血清并于4℃过夜。TBST(0.05%Tween-20)洗涤后加入碱性磷酸酶(AP)标记的羊抗鼠 ⅠgG于37℃孵育1 h。TBST(0.05%Tween-20)洗涤后按照BCⅠP/NBT碱性磷酸酶显色试剂盒说明书显色。
2 结果
2.1 鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ(E-Ⅰ/Ⅱ)基因的扩增
以含有鹅坦布苏病毒JS804株全基因的质粒为模板,用所设计的特异性引物扩增E基因结构域Ⅰ和Ⅱ片段,结果扩增的片段大小约为900 bp左右,与预期大小相符(图1)。
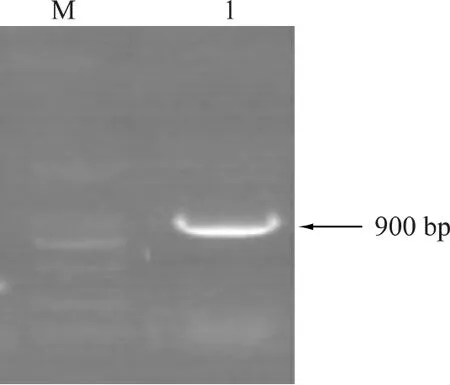
图1 鹅坦布苏病毒E基因结构域Ⅰ和Ⅱ片段PCR扩增结果Fig.1 PCR amplification of domainsⅠ and Ⅱ of goose tembusu virus E gene
2.2 鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ(E-Ⅰ/Ⅱ)重组表达质粒的构建
提取重组质粒 pET28a-E-Ⅰ/ⅠⅠ,经限制性内切酶EcoRⅠ和SalⅠ酶切后,经琼脂糖凝胶电泳检测,分别得到2个片段,大小与预期相符(图2),测序结果表明E-Ⅰ/ⅠⅠ片段以正确方式分别插入pET28a载体中且序列正确。
2.3 鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ蛋白质的诱导表达与SDS-PAGE分析
将鉴定为阳性的细菌进行ⅠPTG诱导表达,经SDS-PAGE检测后发现,以1 mmol/LⅠPTG诱导时,pET28a-E-Ⅰ/ⅠⅠ在诱导后4 h出现目的条带,大小约为37000的融合蛋白质,与预期蛋白质大小一致,在诱导6 h时表达量最高(图3)。
2.4 重组鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ蛋白质在菌体中的分布

图2 重组质粒pET28a-E-Ⅰ/ⅠⅠ的酶切鉴定Fig.2 Ⅰdentification of recombinant plasmid pET28a-E-Ⅰ/ⅠⅠby enzyme digestion
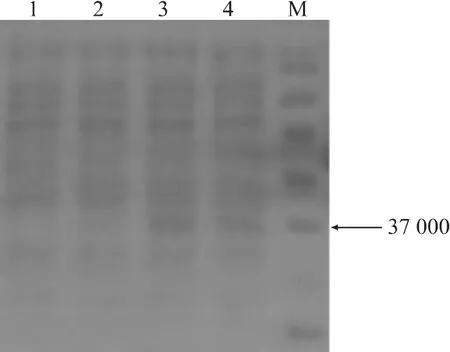
图3 pET28a-E-Ⅰ/ⅠⅠ重组蛋白质的 SDS-PAGE 检测Fig.3 Analysis of pET28a-E-Ⅰ/ⅠⅠfusion protein by SDS-PAGE
将诱导表达6 h的细菌进行超声波裂解,经SDS-PAGE电泳分析,结果发现 pET28a-E-Ⅰ/Ⅱ融合蛋白质以包涵体形式存在(图4)。
2.5 重组鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ蛋白质的Western-blot鉴定
Western-blot结果显示,诱导后的全菌蛋白质在相对分子量约为37000的位置有与FLAG标签单抗反应的特异条带(图5),说明E-Ⅰ/Ⅱ成功与FLAG标签进行了融合表达。
以鹅坦布苏病毒E蛋白质阳性血清为一抗,用Western-blot对表达的重组蛋白质进行分析,结果显示,在37000处有特异性条带(图6),表明该重组蛋白质得到正确表达且具有良好的反应原性。

图4 pET28a-E-Ⅰ/ⅠⅠ重组蛋白质在菌体中的分布Fig.4 Distribution of pET28a-E-Ⅰ/ⅠⅠfusion protein in recombinant E.coli

图5 FLAG单克隆抗体鉴定pET28a-E-Ⅰ/ⅠⅠ融合蛋白质Fig.5 Western-blot identification of pET28a-E-Ⅰ/ⅠⅠfusion protein against FLAG McAb

图6 E蛋白质阳性血清鉴定pET28a-E-Ⅰ/Ⅱ融合蛋白质Fig.6 Western-blot identification of pET28a-E-Ⅰ/Ⅱ fusion protein against positive serum for E protein
3 讨论
由鹅坦布苏病毒引起的疫病在中国属于新发传染病,可引起蛋鸭、种鹅死亡和产蛋下降,几乎所有鸭、鹅场均遭受了巨大经济损失,虽然该病已在中国南方大部分地区广泛流行,但对病原的生物学特性、致病机理、流行规律尚未进行深入研究,这给本病的防控带来一定困难。
黄病毒属病毒通过E蛋白质与宿主细胞表面受体结合而吸附和感染宿主细胞。因此,E蛋白质与宿主细胞表面受体的相互作用是病毒对宿主细胞嗜性和病毒毒力的主要决定因素。硫酸乙酰肝素(HS)是广泛存在于细胞表面的一类由二糖重复单位组成的多糖,表面具有大量负电荷具有包括介导病原体吸附等在内的多种生物学功能。研究结果表明黄病毒E蛋白质结构域Ⅰ和Ⅱ中带有大量的正电荷Arg和Lys,可能有助于病毒与HS结合[10]。
本试验选用pET-28a原核表达载体成功表达鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ。表达的目的蛋白质虽以包涵体形式存在,但是通过简单的包涵体变性和复性等纯化步骤后即可获得高表达量、单一的目的蛋白质,同时由于携带有FLAG标签,其特异性较好,使用广泛,使得Western-blot检测更加简便、可信,并利于后续试验中的特异性检测。
综上所述,本研究实现了重组鹅坦布苏病毒E蛋白质结构域Ⅰ和Ⅱ的原核表达,为研究囊膜蛋白质在鹅坦布苏病毒细胞感染中的生物学功能奠定基础。
[1] HUANG X,HAN K,ZHAO D,et al.Ⅰdentification and molecular characterization of a novel flavivirus isolated from geese in China[J].Res Vet Sci,2013,94(3):774-780.
[2] 黄欣梅,李 银,赵冬敏,等.新型鹅黄病毒JS804毒株的分离与鉴定[J].江苏农业学报,2011,27(2):354-360.
[3] LⅠU M,CHEN S,CHEN Y,et al.Adapted Tembusu-like virus in chickens and geese in China [J].J Clin Microbiol,2012,50(8):2807-2809.
[4] 姬希文,李雪松,李国新,等.鸭坦布苏病毒E蛋白中和性单克隆抗体的制备[J].中国家禽,2012,34(4):25-32.
[5] HURRELBRⅠNK RJ,MCMⅠNN PC.Molecular determinants of virulence:the structural and functional basis for flavivirus attenuation[J].Adv Virus Res,2003,60(1):1-42.
[6] MODⅠS Y,OGATA S,CLEMENTS D,et al.Structure of the dengue virus envelope protein after membrane fusion [J].Nature,2004,427(6972):313-319.
[7] ZHANG W,CHⅠPMAN PR,CORVER J,et al.Visualization of membrane protein domains by cryo-electron microscopy of dengue virus[J].Nat Struct Biol,2003,10(11):907-912.
[8] ZHENG A,UMASHANKAR M,KⅠELⅠAN M.Ⅰn vitro and in vivo studies identify important features of dengue virus pr-E protein interactions[J].PLoS Pathog,2010,6(10):e 1001157.
[9] LⅠN S R,ZOU G,HSⅠEH S C,et al.The helical domains of the stem region of dengue virus envelope protein are involved in both virus assembly and entry [J].J Virol,2011,85(10):5159-5171.
[10]付宇姣,郑学礼.登革Ⅱ型病毒E蛋白Ⅰ、Ⅱ结构域在大肠杆菌中的表达及免疫反应性鉴定[J].中国人兽共患病学报,2012,28(5):425-428.
