血液总RNA提取方法的比较
2014-06-21刘瑞兰高庆华
孟 浩 彭 贞 王 闯 刘瑞兰 高庆华
RNA分子的提取是分子生物学研究中一项的基本内容,是进行基因表达分析的基础[1]。随着分子生物学技术的迅猛发展及在医学领域中的普及,以RNA为研究对象的分子生物学实验与日俱增。外周血作为常用的理想实验材料,由于取材方便,且不需组织匀浆等客观因素的影响,可用作分子印迹和病毒学研究的对象[2],而被广泛应用。血液总RNA提取所采用的Trizol法常作为RNA提取的方法之一,这与Trizol试剂本身能有效的从细胞或组织中直接提取RNA,并且在实验中降低血液中含有的RNA酶污染,防止RNA酶对RNA的降解有关。这也正是保证所得RNA片段完整的关键。
大量的研究实验证明:虽然提取RNA的方法很多,但是其基本都是把细胞破碎以后,以除去材料中糖、蛋白质、DNA等杂质为目标。而且材料自身物理化学性质的不同,不同的材料需要不同的提取方法[3~5]。但在分离血液总RNA所采用的不同抗凝血液在实际运用的效果甚少。本文正是利用在不同抗凝血液和红细胞裂解前后的对比。从而,获得最佳质量总RNA和实用的提取方法。
1 材料与方法
1.1 材料
羊外周静脉血,采自塔里木大学动物科学学院动物实验站,分别用ACD和肝素钠作为血液抗凝试剂。
1.2 试剂
DEPC水:1:1 000比例DEPC加入超纯水。常温下,磁力搅拌3~4 h,10~11 h静置孵育,121℃、30 min灭活。
ACD:柠檬酸 4.8 g、柠檬酸钠13.2 g、葡萄糖14.7 g定容于1 L的无酶水红细胞裂解液:氯化铵8.29 g、碳酸氢钾 1 g、EDTA 0.037 g定容于1 L 的无酶水Trizol试剂、氯仿、异丙醇、无水乙醇、75%乙醇无酶水配置。
1.3 方法
1.3.1 经典Trizol法直接提取血液总RNA
取不同抗凝后的血样0.5 mL放置于无RNA酶离心管中,加3倍体积Trizol,震荡混匀,室温静置5 min;4℃,12 000 g/min,离心15 min。用移液器吸取上清,到另一无酶离心管,按照1 000μL Trizol体积加入200μL氯仿,涡旋15 s,静置3 min;4℃,12 000 g/min,离心15 min。取上清450μL至干净无酶1.5 mL离心管,按1000μL Trizol体积加入预冷的500μL异丙醇。混匀、室温静置10 min,4℃,12 000 g/min,离心15 min。小心吸弃上清,留管底沉淀,加入1 mL由DEPC水配置的75%乙醇,吹打混匀,4℃,8 000 g/min,离心5 min。弃上清,倒置于干净的滤纸片刻,开盖,挥发乙醇2~3 min,加入15μL DEPC水,吹打混匀,55℃ ~60℃水浴10 min,-70℃保存。
1.3.2 裂解法提取血液总RNA
1.3.2.1 裂解红细胞
取0.5 mL抗凝血液,按1:3体积加入预冷红细胞裂解液,混匀,室温静置10 min,4℃,10 000 r/min,离心1 min。小心弃去上清,保留管底细胞沉淀。
1.3.2.2 Trizol提取细胞总 RNA
向细胞沉淀的离心管中加入1.5 mL Trizol试剂,震荡混匀,静置5 min,再按照1 000μL Trizol体积加入200μL氯仿,其余处理方法与经典Trizol法处理相同。
1.3.3 总RNA完整性和浓度检测
取4μL总RNA与2μL 6×Loading Buffer混合后,点样于1%(含有0.05μg/mL EB)琼脂糖凝胶,150 V恒压电泳进行检测,15 min后在凝胶成像系统(美国,Bio-Rad公司)进行拍照检测。
使用Thermo公司的NanoDrop2000c进行260 nm和280 nm偏振光检测,估测RNA浓度和纯度比值。根据RNA浓度=40μg·mL-1×稀释倍数×Abs260nm计算出 RNA浓度。
2 结果与分析
2.1 总RNA样品的1%琼脂糖凝胶电泳
经过凝胶成像系统拍照检测。所得结果如下图:
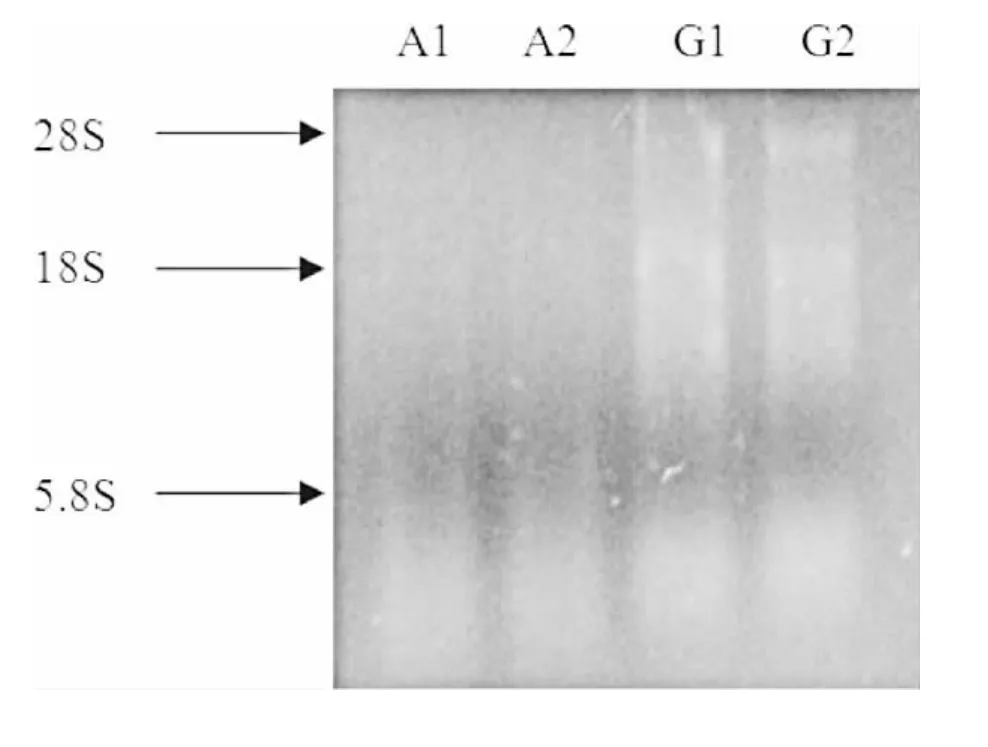
图1 全血中直接提取RNA
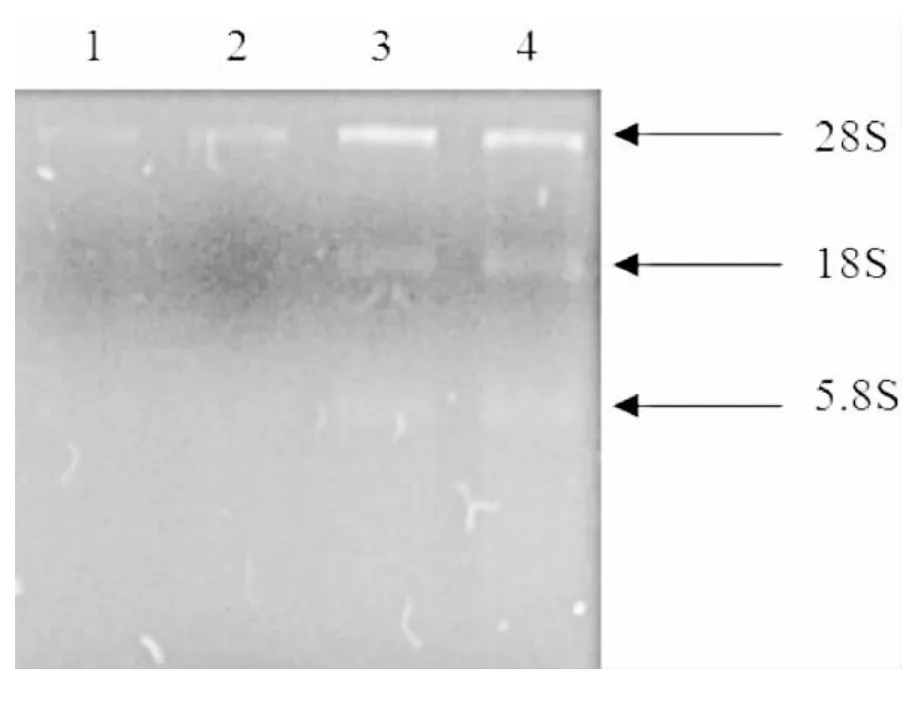
图2 裂解红细胞后提取RNA
电泳结果显示,在肝素钠抗凝血液中,红细胞裂解处理前后提取的总RNA,均有三条明显亮带,说明提取过程中,未发生RNA的降解,完整性好。而在采用ACD抗凝处理后的血液总RNA未能出现预期的三条带型。
在肝素钠抗凝的血液经过裂解液处理后,总RNA带型清晰、明确。28S的亮度大于18S。全血直接提取总RNA结果,在凝胶检测时产生抹带、拖尾现象。
在ACD抗凝血液采用两种不同方法提取总RNA,经电泳检测之后,均出现条带不完整,且带型模糊现象。
2.2 总RNA浓度检测
使用Thermo公司的NanoDrop2000c进行260 nm和280 nm偏振光检测,计算机自行算出总RNA浓度和A260/A280比值,得到表1、表2结果:
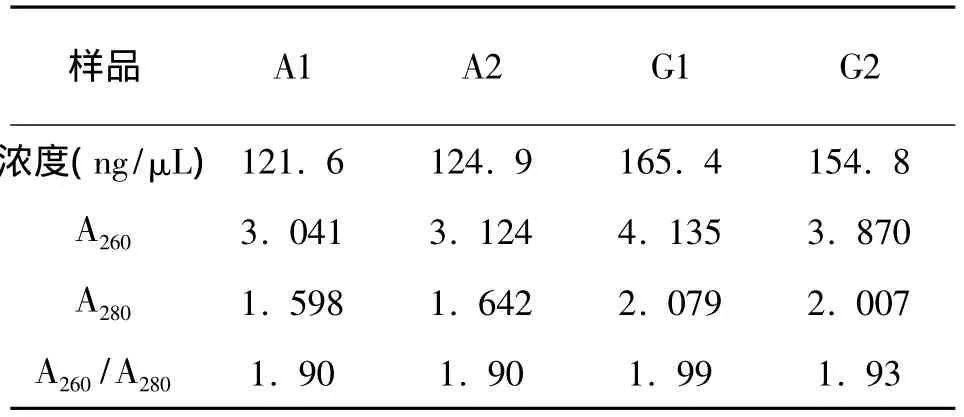
表1 未经红细胞裂解处理总RNA浓度和纯度

表2 红细胞裂解处理后总RNA浓度和纯度
3 讨论
在RNA的提取过程中,由于RNA核糖残基带有羟基,导致RNA比DNA化学性质更活跃,易被RNA酶降解,这就要求提取RNA的步骤尽可能减小RNA酶污染[6]。在本实验中,RNA提取所用的仪器和枪头都采取灭酶处理,实验中勤换手套,杜绝由人为操作带入外源RNA酶的污染,最终得到本实验结果。在比较图中处理前与处理后之间的差异可以看出:在经过两种方法分别提取总RNA的时候,直接提取的效果不如裂解红细胞之后的效果。直接提取的总RNA出现相应程度抹带和带型不完整现象,这与淳俊等人[7]在用Trizol提取总RNA进行电泳检测出现的带型不完整现象相似。同时,28S的亮度也未出现大于18S亮度两倍的情况,这可能与过多的细胞含有的内源性RNA酶对RNA的降解产生有关[8]。利用分光光度计对总RNA进行浓度和A260/A280值检测中,发现两种提取结果A260/A280的比值都在1.8~2.0之间。证明两种方法提取总RNA纯度较好,提取结果里未出现有蛋白的污染[9],但总RNA的浓度差别较大,直接提取总RNA的浓度明显小于通过裂解红细胞后的总RNA浓度。由此推断,血液中内源RNA酶是影响RNA提取产量至关重要的因素[10-11]。
另外,在对不同抗凝剂对总RNA提取的影响,我们也做了相关的研究。其中,在控制了电泳时间、凝胶孔径大小等因素后,对采用不同抗凝剂后的血样抽提RNA,在结果中我们发现:经过琼脂糖凝胶电泳,肝素钠抗凝的血液中,条带的亮度明显比ACD抗凝血液得到的条带要亮,并且带型清晰、完整。但经过分光光度计检测,浓度并无较大差别,这可能与谢胜松等[12]人所提出的利用琼脂糖检测RNA质量,其中稀释与否和上样量对RNA检测有关。同时我们在对抗凝剂可能对RNA提取质量影响的研究中发现,在利用不同的抗凝剂对RNA的溶解也可产生一定的影响。例如Sung Jae kim等人研究了在不同抗凝剂贮存血液方式下,对提取RNA的质量有明显的影响,在该研究中发现用柠檬酸钠抗凝的血液,经Trizol法提取后的RNA,在后期实验中可用来做cDNA的合成,而ACD含有的成分主要是柠檬酸钠;在肝素抗凝后的血液,在相同方法提取的RNA,可作为基因芯片的研究[13]。由此解释了在采用不同抗凝剂处理后的血液,对RNA的提取质量有明显的影响,尤其是对分子克隆、基因芯片等较高标准分子生物学研究中所提出的RNA完整性、纯度、浓度等要求。
4 结论
在以绵羊血液为试材,利用经典Trizol法对比两种不同抗凝剂和红细胞裂解前后处理外周血得到的总RNA效果,得出经肝素钠抗凝且红细胞裂解液处理后外周血液的总RNA质量和纯度最好,可作为分子生物学实验后期较高标准的研究基础。
[1] Sambrook,Joseph,Edward F Fritsch,Thomas Maniatis.Molecular Cloning.Cold spring harbor laboratory press New York,1989,2.
[2] Culler U,Zajac P,Schnider A,et a1.Disseminated single tumor cell as detected by real-time quantitative polymerase chain reaction represent a prognostic factor in patients undergoing Surgery for colorectal cancer[J].Ann Surg,2002,236(6):768 -775.
[3] 王惠娥,孙献莹,高庆华,等.奶牛精子RNA提取[J].中国畜牧兽医,2011,38(3):80 -84.
[4] 李燕,王恩秀,陈溥言.几种提取RNA的方法[J].生物技术,2002,12(4):20 -21.
[5] Lan M.Brid.Extraction of RNA form cells and tissue[J].Methods in Molecular Medicine,2005,108:139-148.
[6] 宫磊,李铁,孔丽娜.全血中直接抽提RNA方法的探讨[J].皖南医学院学报,2006,25(2):84 -86.
[7] 淳俊,郑彦峰,王胜华,等.一种广泛适用的RNA提取方法[J].生物化学与生物物理进展,2008,35(5):591-597.
[8] 陈志,罗卫星,刘若余,等.血液提取总RNA的初步研究[J].中国农学通报,2012,28(05):28-31
[9] 于寒松,彭帅,谢远红,等.一种 RNA提取试剂盒—TRIZOL的使用方法初探[J].食品科学,2005,26(11):39-42.
[10] 吕娜,张玲,刘宁.提取血液总RNA两种方法的比较和分析[J].东北农业大学学报,39(8):110-112.
[11] 李杰之,常晓彤,林坚,等.从动物组织提取高纯度总RNA方法的改进及应用[J].生物技术通讯,2002,13(5):346-348.
[12] 谢胜松,李新云,苏立志,等.一种简单快速鉴定动物组织总RNA质量的方法[J].农业生物技术学报,2009,17(2):282 -287.
[13] Kim SJ,Dix D J,Thompson K E,et al.Rockett Effects of Storage,RNA Extraction,Genechip Type,and Donor Sex on Gene Expression Profiling of Human Whole Blood[J].Clinical Chemitry,2007,53(6):1038 -1045.
