丁苯橡胶废水的水质特性及其生物急性毒性分析
2014-06-15刘光全王晓平张华吴百春张晓飞
刘光全 王晓平 张华 吴百春 张晓飞
(1.中国石油安全环保技术研究院;2.中国石油吉林油田公司勘探开发研究院)
丁苯橡胶废水的水质特性及其生物急性毒性分析
刘光全1王晓平2张华1吴百春1张晓飞1
(1.中国石油安全环保技术研究院;2.中国石油吉林油田公司勘探开发研究院)
对典型丁苯橡胶废水进行了水质综合分析,并利用凝胶排阻色谱、傅里叶红外光谱和荧光光谱对废水中的溶解性有机物(DOM)进行了有机物特性分析。为了进一步分析DOM的组成与可生化性的关系,利用树脂将其分离为疏水酸性有机物(Ho A)、疏水碱性有机物(HoB)、疏水中性有机物(Ho N)以及弱憎水酸性有机物(WHo A)和亲水性有机物(HiM)五种组分,分别考察了DOM中各组分的比例分布及其生物急性毒性。结果表明:DOM是单体物质和聚合物的混合体,重均分子量约2 583 Da,主要含有微生物代谢产物和可见区类富里酸荧光物质。DOM中疏水性有机物和亲水性有机物所占比例分别为40.23%和59.77%,其中Ho N和Ho A具有相对较高的芳香度和分子量。生物急性毒性结果表明:疏水性有机物的急性毒性显著高于亲水性物质,其中含量较低的WHo A和HoB的急性毒性最强。
丁苯橡胶废水;水质特性;溶解性有机物;生物急性毒性
0 引 言
橡胶废水主要来自合成橡胶生产中的凝聚、洗涤及挤压工序,包括生产过程中凝固和稀释胶乳、洗涤凝块和制胶机械用水等[1]。合成橡胶在生产过程中需要添加约几十种助剂,因此所排放的废水成分复杂,有机物浓度高,可生化性差。一般来说,橡胶生产过程中排放废水中BOD约100~400 mg/L,COD约700~8 000 mg/L,SS约200~300 mg/L[2-3]。废水中有机污染物多数是未经凝聚的低分子聚合物,部分具有环状结构、难以生物降解的有机物,如苯乙烯、丙烯晴、丁二烯、二氯乙烯、乙炔基乙炔及低聚物等有机物;同时含有大量悬浮胶粒、橡胶乳清等污染物[4-5]。这些物质对微生物的新陈代谢均有抑制或毒害作用,难以被微生物降解和利用[4]。某石化企业的丁苯橡胶废水直接排入污水处理场后,导致生化池污泥活性变差、产生大量泡沫,对污水处理场的稳定运行造成较大困难。
针对丁苯橡胶废水排入污水场后造成的冲击问题,以该企业的丁苯橡胶生产废水为研究对象,利用多种分析手段考察其物质组成及其生物急性毒性,探究导致生化效率低下的原因,为丁苯橡胶废水的高效处理提供理论依据。
1 实验材料与方法
1.1 实验材料
水样取自某石化企业乙烯厂丁苯橡胶装置生产废水。实验中的化学试剂均为分析纯,溶液均以纯水配置。
1.2 表征方法与仪器
1.2.1 溶解性有机碳(DOC)分析
水样经0.45μm玻璃纤维滤膜过滤后,利用TOC测定仪(TOC-VE,日本岛津公司)测定DOC。
1.2.2 紫外-可见光谱分析
紫外-可见光谱扫描范围200~600 nm。主要仪器:U-3010紫外分光光度计(日本日立公司)。250 nm处的紫外吸收值与365 nm处吸收值的比值(E250/E365)被用来反映有机物的芳香度和分子量。
1.2.3 分子量分布表征
水样的表观分子量通过凝胶液相色谱系统进行测定,以聚苯乙烯磺酸钠(PSS)(15 650,6 400,4 600和1 370 Da)和丙酮(58 Da)为分子量标准品。
1.2.4 傅立叶红外光谱(FTIR)分析
水样经0.45μm玻璃纤维滤膜过滤后,烘干至恒重,采用KBr压片法,测定FTIR光谱。主要仪器:Thermo Nicolet iS10 FTIR光谱仪(美国赛默飞世尔科技公司)。
1.2.5 荧光光谱(EEM)分析
三维荧光光谱(3D-EEM)和同步荧光光谱采用F-4600荧光分光光度计(日本日立公司)测定,使用150 W氙弧灯为激发光源,PMT电压为700 V;设定激发和发射狭缝宽度均为5 nm。
1.2.6 发光细菌急性毒性测试
主要实验材料有:Microtox生物毒性测试仪;明亮发光杆菌(Photobacterium phosphoreum T3)冻干粉,南京土壤所提供。
通过以DOC浓度表示发光细菌的半抑制率EC50,分析废水中DOM及其各组分的生物急性毒性。
1.3 树脂分离方法
利用Suplite XAD-8和Amberlite XAD-4树脂将丁苯橡胶废水的DOM分离为疏水酸性有机物(Ho A)、疏水碱性有机物(HoB)、疏水中性有机物(HoN)以及弱憎水酸性有机物(WHo A)和亲水性有机物(HiM)五种组分。DOM树脂分离流程见图1。

图1 DOM树脂分离流程
2 结果与讨论
2.1 丁苯橡胶废水的综合特性分析
表1为某炼化企业典型丁苯橡胶废水的水质综合指标,该废水p H值为7.11,呈现中性,含有一定浓度的悬浮物,其盐含量约2 700 mg/L,且主要为硫酸盐。其ORP和Zeta电位结果表明该废水呈现电负性,具有一定的还原性。

表1 丁苯橡胶废水的水质综合指标
表2为丁苯橡胶废水的有机物浓度分析结果,可以看出,其COD为650 mg/L左右,且溶解性COD占总COD的97.6%,表明溶解性有机物是COD的主要来源。B/C值为0.071,可生化性差。

表2 丁苯橡胶废水的COD,BOD和TOC
表3为丁苯橡胶废水的N和P形态与浓度分析结果,可以看出,该废水的TN浓度较高,约82.46 mg/L,其中NH3-N为9.53 mg/L,NO2-N和NO3-N低于检测限,表明丁苯橡胶废水中TN基本为有机氮。此外,该废水中的TP浓度约118.57 mg/L,且基本为正磷酸盐。
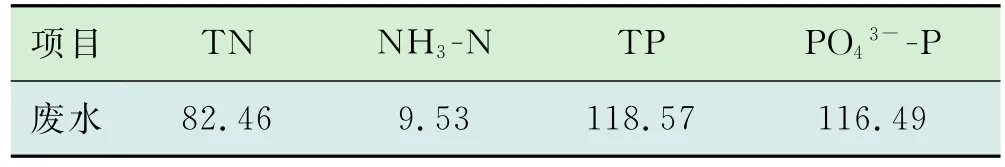
表3 丁苯橡胶废水的N和P形态与浓度分析mg/L
2.2 色谱与光谱分析
2.2.1 分子量分布
利用高效液相色谱测定DOM的分子量,其凝胶排阻色谱如图2所示。可见,DOM在停留时间12.86 min处有一明显的吸收峰。根据分子量标准曲线计算出DOM的重均分子量为2 583 Da,数均分子量约747 Da;其谱图中还含有其他一系列的吸收峰,有机物其聚分散度为3.46,表明DOM中不同物质的分子量的差别超过3个数量级,即DOM中不仅具有较低分子量的单体物质,还含有相对较高分子量的聚合物[6]。
2.2.2 荧光光谱分析
DOM具有荧光特性,且该荧光特性与其自身的结构、官能团、构型、非均质型、分子内与分子间的动力学特征相关[7]。天然环境和污水中各种溶解性有机物的Ex/Em荧光峰所代表的特征物质类型为[8-10]:类腐殖酸类荧光峰Class I(Ex约为350~440 nm,Em约为430~510 nm);可见区类富里酸荧光峰ClassⅡ(Ex约为310~360 nm,Em约为370~450 nm);紫外区类富里酸荧光峰ClassⅢ(Ex约为200~250 nm,Em约为380~540 nm);溶解性微生物代谢产物ClassⅣ(Ex约为250~320 nm,Em约为280~380 nm);类蛋白荧光峰Class V(Ex约为240~270 nm,Em约为370~440 nm)。
对丁苯橡胶废水DOM进行荧光光谱分析,图3(a)为三维荧光光谱图。按照激发/发射波长对荧光峰进行分类,结果如表4所示。可看出,DOM的主要荧光峰为溶解性微生物代谢产物ClassⅣ和可见区类富里酸荧光峰ClassⅡ,特别是溶解性微生物代谢产物荧光峰强约为可见区类富里酸荧光峰的2倍。一般来说,溶解性微生物代谢产物含有较多的C—O结构,如醇羟基、醚等。此外,可见区类富里酸荧光峰ClassⅡ与有机物结构中的羰基和羧基有关,表明丁苯橡胶废水中含有一定的羰基和羧基不饱和官能团。有更高含量的羧基官能团而非酚羟基。
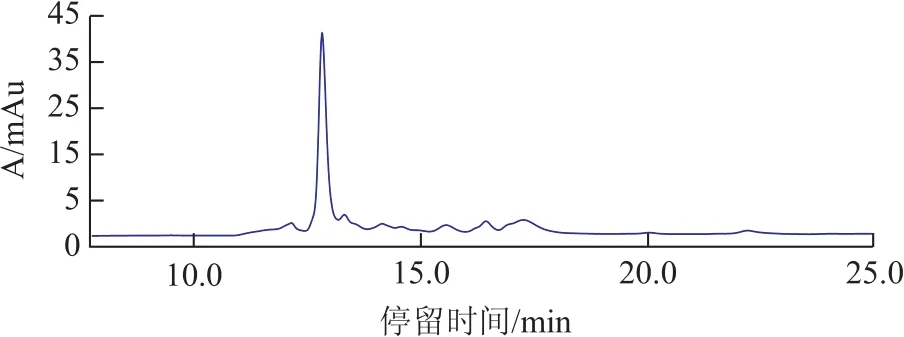
图2 丁苯橡胶废水DOM的凝胶排阻色谱图

表4 丁苯橡胶废水的荧光峰

图3 丁苯橡胶废水DOM的三维荧光光谱图和同步荧光光谱图
2.2.3 傅里叶红外光谱分析
丁苯橡胶废水DOM的FTIR谱图如图4所示。可看出,DOM的主要特征吸收峰包括1 636 cm-1(芳烃骨架振动C=C或者醛酮的C=O振动),表明DOM中含有羧基、酮等不饱和结构;1 122 cm-1为羧羟基、脂肪族的C—OH或者烷氧基的伸缩振动,且含量较高,这与同步荧光光谱表明的羧基官能团相一致,该类结构也代表了较高含量的微生物代谢产物等可生化强的物质[7,12-13]。
在扫描过程中使激发波长和发射波长彼此间保持固定的波长间隔(Δλ=10 nm),分析其同步扫描谱图,如图3(b)所示。可看出,发射波长在274~300 nm和300~340 nm范围内出现2个荧光峰,这说明DOM中主要含有两大类荧光物质,这与三维荧光谱图分析结果一致。特别是300~340内的荧光峰具有较高的荧光强度,即其激发波长为290~330 nm。傅平青[11]指出,荧光光团在激发波长在300~350 nm范围之间,说明有机物结构中具有高含量的羧基结构,而波长在350~400 nm之间则被认为是存在较多的酚羟基结构。可以推断,丁苯橡胶废水DOM中含

图4 丁苯橡胶废水DOM的FTIR谱图
但由表2可知,丁苯橡胶废水的B/C只有0.071,可生化性差。这表明虽然丁苯橡胶废水中具有较多可被生物降解的结构,但实际反应过程中可能因为某些毒性物质的存在导致生物活性较低。
2.3 丁苯橡胶废水的组成与生物毒性
为了进一步分析丁苯橡胶废水的DOM组成与生物毒性的关系,利用树脂将DOM分离为Ho A,HoB,HoN,WHo A和HiM五种组分,分别调节至原水体积与p H值,并考察其在DOM中的比例分布及其生物急性毒性。
2.3.1 DOM组分的比例分布
各部分有机物在DOM中所占的DOC比例与E250/E365如图5所示。可看出,疏水性有机物(HoB+Ho A+HoN+WHo A)和亲水性有机物(HiM)所占比例分别为40.23%和59.77%,呈现出较为明显的亲水性。其中在疏水性有机物中,Ho N含量最高,其DOC比例为21.05%;其次是Ho A,约占DOM的13.46%。

图5 DOM中各组分的DOC比例与E250/E365
研究者认为,低的E250/E365值表示高芳香度和高分子量[14]。如图5所示,DOM组分中HoN和Ho A具有最低的E250/E365,表明这两种疏水性组分的芳香度和分子量最高,特别是HoN。而在DOM中占有最高DOC比例的HiM的E250/E365值较高,仅次于HoB。
综合DOM的有机物特性分析,可以推断,DOM中亲水性有机物含量较高,导致DOM具有较多的C—O官能团,表现为具有较高含量的微生物代谢产物。此外,Ho N和Ho A的高芳香度和高分子量使得DOM含有一定的羧基、酮等不饱和结构,表现为类富里酸类荧光物质的性质。
2.3.2 DOM及其各组分的生物急性毒性
丁苯橡胶废水的DOM 5 min时的EC50为87.65 mg/L有机碳,为其DOC总浓度的50.25%。为了探究生物毒性的来源,考察了不同组分的发光细菌急性毒性,如图6所示。可以看出,疏水性有机物的急性毒性显著高于亲水性物质,而在疏水性有机物组分中,含量较低的WHo A和HoB的急性毒性最强,其次是Ho N和Ho A。因此可以推断,影响生化反应的毒性物质主要是疏水性有机物特别是弱疏水酸性和疏水碱性有机物,但由于DOM中占较大比例的为毒性较小的HiM,这导致丁苯橡胶废水的EC50约为TOC总浓度的50.25%[15-16]。
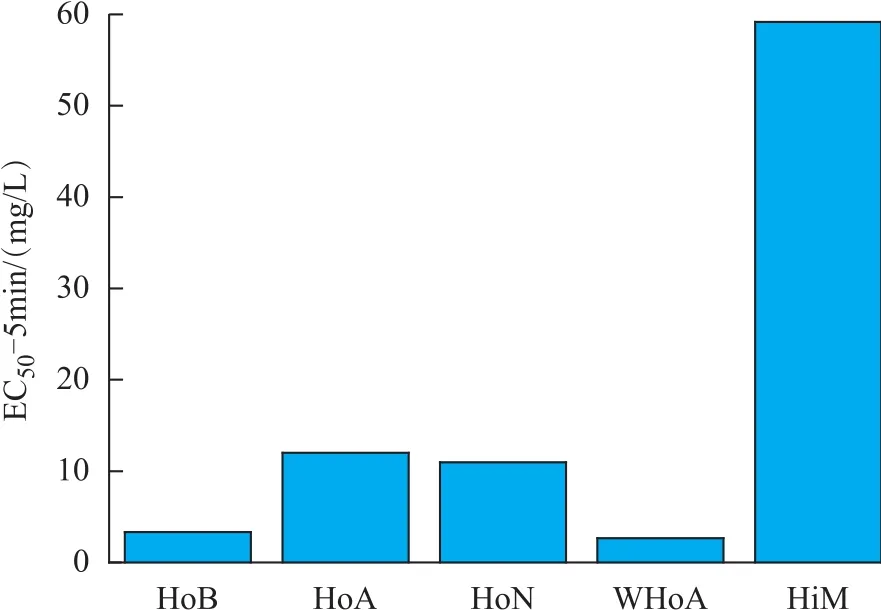
图6 DOM中各组分的发光细菌急性毒性
3 结 论
丁苯橡胶废水呈现电负性和还原性特点,盐含量较高,具有较高浓度的TN和TP。其中,DOM是COD的主要来源,可生化性差,含有微生物代谢产物和可见区类富里酸荧光物质。
利用树脂可将DOM分离为Ho A,HoB,HoN,WHoA和HiM五种组分。DOM中亲水性有机物含量较高,导致DOM具有较多的C—O官能团,表现为具有较高含量的微生物代谢产物。此外,HoN和HoA的高芳香度和高分子量使得DOM含有一定的羧基、酮等不饱和结构,表现为类富里酸类荧光物质的性质。
通过生物急性毒性分析,发现疏水性有机物的生物急性毒性显著高于亲水性物质,特别是弱疏水酸性和疏水碱性有机物,但由于这两种组分含量较低,因此在控制丁苯橡胶废水生物毒性方面重点需要控制Ho N和Ho A对生化池中微生物的影响。
[1] 文善雄,荣树茂,王生伟,等.合成橡胶废水处理技术及应用[J].甘肃科技,2010,26(24):46-48.
[2] 崔晓芳,周静搏,范云双,等.膜生物反应器处理石化橡胶废水的试验研究[J].天津工业大学学报,2008,27(3):93-95.
[3] 鲁风芹,于江波,孙文.铁碳微电解深度处理橡胶工业废水的试验研究[J].工业用水与废水,2011,42(2):33-35.
[4] 裘碧英,韩勇涛,谭溯睿.水力循环澄清池+MBR工艺处理橡胶废水的中试研究[J].工业水处理,2010,30(4):52-55.
[5] 杨晓奕,蒋展鹏,万志强.橡胶废水工业试验研究[J].给水排水,2004,30(8):65-67.
[6] O'Loughlin E,Chin Y P.Effect of Detector Wavelength on the Determination of the Molecular Weight of Humic Substances by High-pressure Size Exclusion Chromatography[J].Water Res,2001,35(1):333-338.
[7] 傅平青,刘丛强,吴丰昌,等.洱海沉积物孔隙水中溶解有机质的三维荧光光谱特征[J].第四纪研究,2004,6(24):695-700.
[8] Traina S J,Novak J,Smeck N E.An Ultraviolet Absorbance Method of Estimating the Percent Aromatic Carbon Content of Humic Acids[J].J Environ Qual,1990,19(1):151-153.
[9] Chin Y P,Aiken G,O'Loughlin E.Molecular Weight,Polydispersity,and Spectroscopic Properties of Aquatic Humic Substances[J].Environ Sci Technol,1994,28(1):1853-1858.
[10]Chen W,Westerhoff P,Leenheer J A,et al.Fluorescence Excitation-emission Matrix Regional Integration to Quantify Spectra for Dissolved Organic Matter[J].Environ Sci Technol,2003,37(24):5701-5710.
[11]傅平青.水环境中的溶解有机质及其金属离子的相互作用——荧光光谱学研究[D].北京:中国科学院,2004.
[12]Silverstein R M,Webster F X.Spectrometric Identification of Organic Compounds[M].New York:John Wiley,1998.
[13]Stevenson F J.Humus Chemistry:Genesis,Composition,Reactions[M].New York:John Wiley&Sons,1994.
[14]Aiken G R,Mc Knight D M,Wershaw R L.Humic Substances in Soils,Sediments and Water[M].New York:John Wiley&Sons,1985.
[15]GB/T 15441—1995水质急性毒性的测定发光细菌法[S].
[16]王丽莎,魏东斌,胡洪营.发光细菌毒性测试条件的优化与毒性参照物的应用[J].环境科学研究,2004,17(4):61-62.
1005-3158(2014)05-0009-05
2014-06-03)
(编辑 石津铭)
10.3969/j.issn.1005-3158.2014.05.004
刘光全,1986年毕业于西南石油学院应用化学专业,副教授,现在中国石油安全环保技术研究院从事环保技术研究与应用工作。通信地址:北京市昌平区沙河镇西沙屯桥西中国石油创新基地A座,102206
