家蚕墨蝶呤还原酶基因的体外表达及酶活性研究*
2014-06-14李闻天龚美霞戴伟宏王文静刘朝良
李闻天,龚美霞,戴伟宏,张 蕾,王文静,刘朝良,孟 艳
(安徽农业大学生命科学学院,安徽 合肥 230036)
家蚕(Bombyx mori)基因组框架图、精细图以及各种数据库的相继建立和不断完善,为发掘和鉴定家蚕基因、研究基因的生物学功能及应用前景奠定了良好的信息平台基础[1-3]。lemon(lem)是一种典型的黄体色家蚕突变体,其幼虫体表富含墨蝶呤(sepiapterin,SP)[4]。SP属于喋啶类化合物,是 GTP 分解代谢途径的中间产物。在高等动物中,SP是补救途径合成四氢生物蝶呤(tetrahydrobiopterin,BH4)的前体,经墨蝶呤还原酶(sepiapterin reductase,SPR)和二氢叶酸还原酶(dihydrobiopterin reductase,DHFR)催化完成(图 1)[5,6]。
SPR是以NADPH为辅酶催化蝶啶衍生物代谢的醛酮还原酶[7],由GTP分解到BH4生成的从头合成途径中,SPR是催化最后一步反应的必需酶[7],对于生物体合成BH4具有非常重要的生理功能。BH4是芳香族氨基酸羟化酶的必需辅酶,也是一氧化氮合酶的重要辅助因子。BH4的合成不足会导致神经递质的缺乏以及细胞内皮功能障碍,引发多种神经性生理代谢疾病[8-10]。
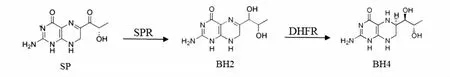
图1 四氢生物蝶呤的补救合成途径Fig.1 Salvage pathway of tetrahydrobiopteri synthesis.BH2,dihydrobiopterin,DHFR,dihyrofolate reductase
我们的前期研究表明,家蚕SPR(BmSPR,Gen-Bank登录号:AB465548)基因(BmSpr)的全长ORF为801 bp。与哺乳动物 SPR类似,BmSPR是家蚕体内合成BH4的重要酶之一,其活性的严重缺乏会导致幼虫因BH4的合成不足而死亡[11]。家蚕lem突变体是提取和纯化获得天然 SP的重要遗传资源。为了将从lem中大量提纯的SP应用于BH4的体外生物合成研究,本文对重组质粒pET-24b-BmSpr的原核表达系统进行了优化,得到了稳定表达BmSPR融合蛋白的实验条件,并对纯化获得的重组蛋白进行了酶学鉴定及活性分析。
1 材料与方法
1.1 材料及主要试剂
重组质粒6×His pET-24b-BmSpr由本实验室前期构建;E.coli感受态细胞 Rosetta(DE3)和BL21(DE3)购自北京全式金公司;PCR扩增相关试剂购自TaKaRa公司;Anti-His Antibody、羊抗鼠 IgG-HRP、HRP-DAB底物显色试剂盒为 Tiangen公司产品;蛋白纯化、蛋白定量试剂盒分别为 QIAGEN公司和上海生工生物工程有限公司产品;PD-10蛋白脱盐柱购自GE公司;Immobilon-P PVDF膜为Millipore公司产品;SP标准品及 NADPH购自 Sigma公司,其他试剂均为国产分析纯。
1.2 菌落 PCR
1.2.1 检测阳性克隆的引物序列
正向引物:M13F,5'-GTTTTCCCAGTCACGAC-3';
反向引物:M13R,5'-CAGGAAACAGCTATGAC-3'。
1.2.2 PCR反应体系 25 μL反应体系中含10×扩增缓冲液 2.5 μL,0.3 U Tag 酶和 0.2 ~0.5 μg 模板 DNA,dNTP Mix、正反向引物的终浓度分别为0.8 mmol/L、0.4 μmol/L 和 0.4 μmol/L,最后用 ddH2O补齐。
1.2.3 PCR反应参数的设定 95℃预变性10 min,反应25个循环,每个循环包括94℃变性55 s,54℃退火58 s,72℃延伸1 min。循环结束后72℃延伸10 min,反应产物用1%琼脂糖凝胶电泳检测确认。
1.3 优化重组蛋白表达条件
运用热击法将pET-24b-BmSpr重组质粒分别转化到BL21(DE3)及Rosetta(DE3)菌株感受态细胞,37℃,150 r/min活化一个小时后,将100 μL菌液均匀涂布于 LB 平板(含15 μg/mL Kanamycin),37℃培养过夜。挑取经菌落PCR鉴定的阳性克隆,接种到含Kanamycin的LB液体培养基中,37℃,180 r/min震荡培养至 OD600≈0.5时,加入 1.0 mmol/L 的IPTG诱导重组蛋白的表达,对照组不加 IPTG。诱导4 h后,收集菌体,超声波破碎,离心,分别收集上清和细胞沉淀,进行SDS-PAGE检测[12],分析不同菌株中重组BmSPR蛋白的表达情况。
以1.0 mmol/L的 IPTG诱导浓度,对照组不加IPTG,分别使用4℃、16℃、28℃和37℃诱导培养4 h后,收集菌体总蛋白进行SDS-PAGE检测,分析不同诱导温度下重组BmSPR蛋白在Rosetta(DE3)宿主菌中的表达情况。使用不同浓度梯度的 IPTG(0.2、0.4 、0.6 、0.8 、1.0 、1.2 、1.5 和 2.0 mmol/L)和不同诱导培养时间(0、1、2、3、4、5 和 6 h),于37℃诱导重组蛋白在Rosetta(DE3)中的表达。收集菌体总蛋白进行 SDS-PAGE检测,分析重组蛋白在不同诱导条件下的表达情况。
1.4 大量诱导表达融合蛋白
在37℃培养条件下,用250 mL的LB液体培养基培养含重组质粒pET-24b-BmSpr的E.coli Rosetta(DE3)的阳性菌株,用 0.4 mmol/L的IPTG诱导重组蛋白的表达,最后破碎细胞收集上清液,进行 SDSPAGE检测。
1.5 蛋白纯化及免疫印迹检测
扩大培养后,4℃ 8000 r/min离心10 min收集E.coli细胞,超声破碎,并收集细胞破碎上清液。参照说明书,用Ni-NTA亲和层析柱(QIAGEN)对重组蛋白进行纯化。经10%SDS-PAGE电泳检测确认后,将凝胶上的蛋白转至PVDF膜上,以His-Tag单克隆抗体(Tiangen)为一抗,羊抗鼠IgG-HRP抗体(Tiangen)为二抗,进行Western blot分析,然后参照HRP-DAB显色试剂盒 (Tiangen)说明书进行显色反应[13]
1.6 酶活特性分析
使用BCA法试剂盒(上海生工)对纯化后的蛋白进行定量,并参照Katoh[14]的方法,进行SPR酶活性分析。反应体系为0.1 mL(含100 mmol/L磷酸钾缓冲液 pH 6.4,SP 50 μmol/L,NADPH 100 μmol/L),加入0.2 μg重组酶蛋白,37℃反应 10 min后,在420 nm处测定底物SP的OD值变化。对照组则不加重组蛋白。根据反应前后SP吸光值的变化和标准曲线计算酶活单位。酶活力单位定义为:每分钟还原1 nmol SP所需的酶量 (nmol/min·μg-1)。设定不同梯度的温度(20-90℃)和反应液 pH(20 mmol/L Britton-Robinson buffer,pH 2.0-12.0),检测不同温度及pH对酶活性的影响,探究重组蛋白的最适反应条件。
2 结果与分析
2.1 BmSPR体外表达条件的优化
筛选转化成功的重组质粒阳性克隆,经菌落PCR排除假阳性,并经测序(上海生工)确认序列准确无误,用IPTG(1.0 mmol/L)诱导重组子在不同宿主细胞的表达。菌落PCR结果如图2所示,PCR产物大小约为800 bp,与预期相符。SDS-PAGE结果显示,经IPTG诱导后,在E.coli菌株 Rosetta(DE3)及BL21(DE3)的细胞破碎上清液中均出现大小约为30 kDa的特异性条带,与目的蛋白的预测分子量相符,且两菌株之间的表达量没有明显差异 (图3),在细胞沉淀中目的蛋白的表达量相对较少(数据未附)。
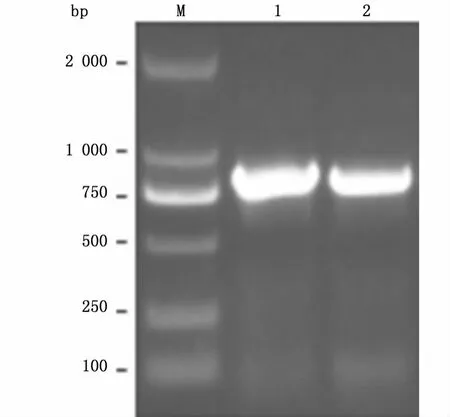
图2 阳性克隆的菌落PCR鉴定Fig.2 Identification of pET-24b-BmSpr positive transformants by colony PCR
以Rosetta(DE3)为宿主菌,使用1.0 mmol/L的IPTG诱导,分别以4℃、16℃、28℃和37℃诱导表达4 h,分析重组蛋白在不同诱导温度条件下的表达情况。结果如图4所示,无 IPTG诱导时,SDS-PAGE未检测到目的蛋白的表达,37℃诱导条件下目的蛋白的表达量明显高于其他诱导温度。
以Rosetta(DE3)为宿主菌,在37℃的培养条件下,通过改变IPTG浓度 (0.2-2.0 mmol/L)及培养时间(1-6 h),分析重组蛋白在不同诱导培养条件下的表达情况。结果如图5所示,无IPTG诱导时,SDS-PAGE未检测到目的蛋白的表达,而不同IPTG诱导浓度(图5A)之间及不同诱导时间(图5B)之间对目的蛋白的表达量几乎没有影响,表明重组蛋白在该表达系统能够稳定表达。
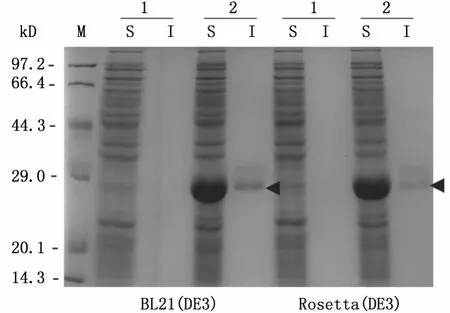
图3 重组BmSPR在不同E.coli菌株中的表达情况Fig.3 Expression of recombinant BmSPR in different E.coli strains
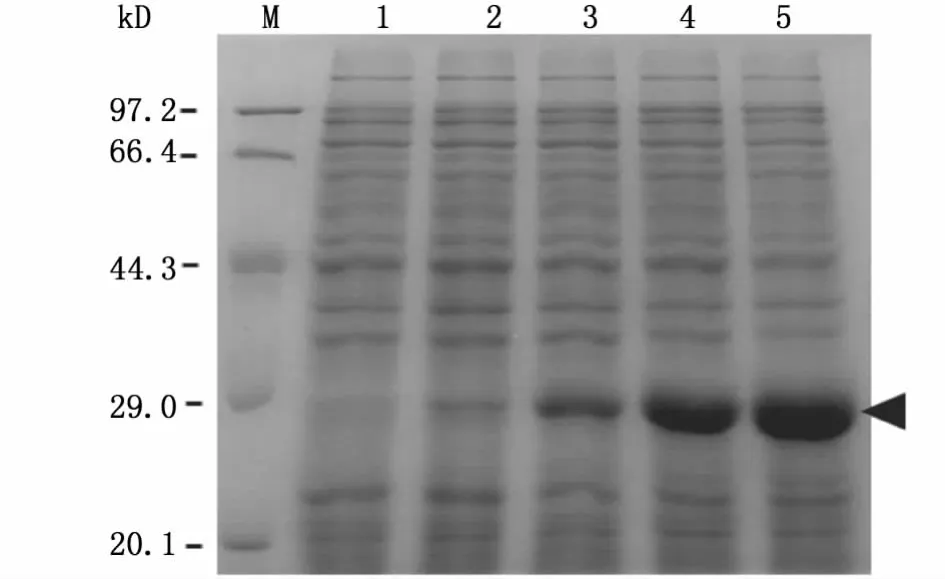
图4 不同诱导温度下重组BmSPR表达量的SDSPAGE分析Fig.4 SDS-PAGE analysis of the expression of recombinant protein at different inducing temperature
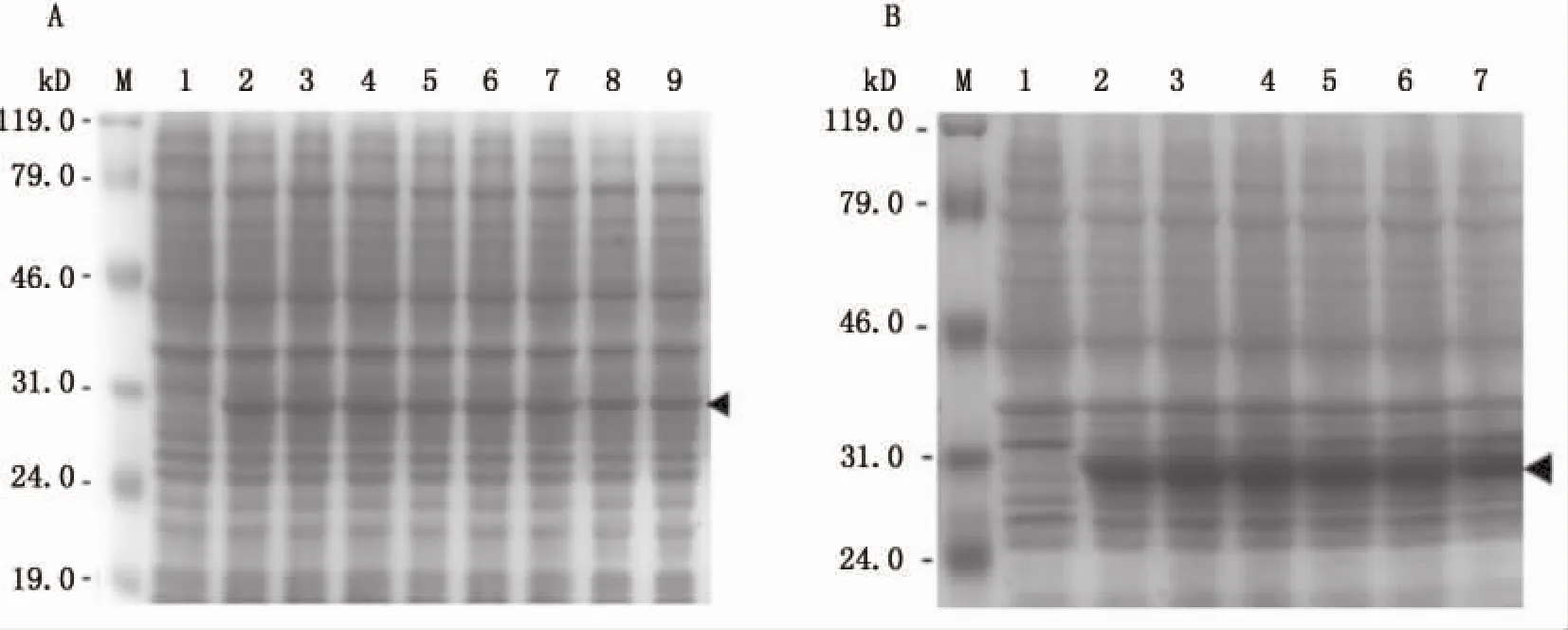
图5 不同浓度IPTG(A)及不同培养时间(B)对重组BmSPR诱导表达的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the induced expression of recombinant BmSPR by different concentrations of IPTG(A)and different incubation time(B)
2.2 BmSPR蛋白的纯化及 Western blot检测
根据上述表达条件的优化结果,以E.coli Rosetta(DE3)菌株为宿主菌,用 0.4 mmol/L IPTG大量诱导BmSPR的体外表达,培养3 h后破碎细胞,收集上清液蛋白,SDS-PAGE确认了重组蛋白的表达(图 6A)。
用Ni-NTA亲和层析柱对重组BmSPR蛋白进行纯化,SDS-PAGE检测得到符合预期分子量大小的单一条带,初步说明重组蛋白纯化效果较佳 (图6B)。Western blot检测发现,经IPTG诱导且纯化过的蛋白得到特异性条带,而对照组(未经诱导)没有检出信号,再次证明了所表达和纯化的蛋白为目的重组蛋白 BmSPR(图6C)。

图6 重组BmSPR的表达(A)、纯化(B)与鉴定(C)Fig.6 SDS-PAGE analysis of the expression(A)and purification(B)and western blot analysis of the identification(C)of recombinant BmSPR
2.3 BmSPR的酶活性分析
如图7A所示,BmSPR在40-70℃的温度范围内,保持较高的活性,50℃为最适反应温度。为分析pH对BmSPR活性的影响,使用终浓度为50 mmol/L不同 pH(2.0-12.0)的 Britton-Robinson buffer,酶蛋白加入各反应体系,于37℃反应10 min后计算酶活性。如图7B所示,BmSPR在 pH 4-6之间表现出较高的酶活性,pH 5为最适pH值。
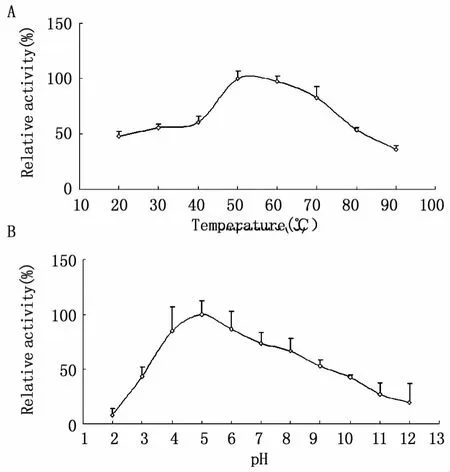
图7 不同反应温度(A)和pH(B)对BmSPR酶活性的影响Fig.7 Relative enzymatic activities of BmSPR at different reaction temperatures(A)and pH values(B)
3 讨论
本实验用 E.coli不同菌株 (图3),通过改变诱导温度、IPTG诱导浓度和诱导时间对家蚕SPR的体外表达条件进行了优化 (图4,图5),最终选用 E.coli Rosetta(DE3)对其进行大量诱导表达分析,SDS-PAGE和 Western blot的检测结果表明BmSPR融合蛋白能够在原核表达系统中稳定表达(图6)。以SP为反应底物,用分光光度法分析所纯化蛋白的酶活性的数据显示,当温度为50℃、pH值为5时,BmSPR对SP表现出良好的催化活性(图7),为通过表达重组BmSPR的方式,开展体外合成制备BH4的课题研究提供了重要依据。
作为芳香族氨基酸羟化酶和一氧化氮合酶的重要辅酶,BH4的合成缺陷会引起肌张力低下、不明原因的高热、发育迟缓、脑脊液中神经递质代谢产物的浓度偏低等神经系统疾病[15,16];同时也是导致高血压、动脉粥样硬化、糖尿病等内皮功能异常的重要原因[16]。口服BH4已被作为临床治疗其中某些疾病的常规方案[17-19]。然而经化工合成市售的 BH4价格非常昂贵[18]。因此,低耗高效的BH4生产工艺的开发创立显得十分必要[20]。随着与BH4合成相关的酶如 GTPCHI[21]、PTPS[22]、DHPR[23]、SPR[11,24]以及DHFR[25]等的研究日益增多,酶基因的克隆与功能鉴定,蛋白质晶体结构的探明,使得BH4合成代谢的调控通路愈发清楚。这些研究一方面有助于加速对BH4缺乏症实现基因治疗的进程,另一方面为非化工途径合成BH4的应用基础研究奠定必要的理论基础。
原核表达系统是目前应用最普遍的基因工程蛋白表达系统,具有操作简单、高效低廉等明显优势[26]。我们利用大肠杆菌表达系统,获得了纯度较高、催化活性较好的重组 BmSPR(图6,7)和BmDHFR[25]。家蚕 lem突变体的幼虫体表沉积大量的SP[4,27],本课题组已建立了从 lem 蚕高效地分离纯化SP的实验体系[27],并且对BH4的补救合成途径所需要的两个酶进行了分子克隆和功能分析[11,25]。下一步我们打算利用从lem突变体大量提取的SP为底物,筛选共表达BmSPR和BmDHFR的工程菌,进行体外合成制备BH4的研究试验,以期获得一种较为简便有效的合成BH4的方法。
[1]WANG J,XIA Q Y,HE X,et al.SilkDB:a knowledgebase for silkworm biology and genomics[J].Nucleic Acids Res,2005,33(1):399-402.
[2]XIA Q Y,ZHOU Z Y,LU C,et al.A draft sequence for the genome of the domesticated silkworm(Bombyx mori)[J].Science,2004,306(5703):1937-1940.
[3]XIA Q Y,GUO Y,ZHANG Z,et al.Complete resequencing of 40 genomes reveals domestication events and genes in silkworm(Bombyx)[J].Science,2009,326(5951):433-436.
[4]TSUSUE M,AKINO M.Yellow pterins in mutant lemon of silkworm and mutant sepia of D.melanogaster[J].J Zool Mag(Tokyo),1965,74:336-341.
[5]THONY B,AUERBACH G,BLAU N.Tetrahydrobiopterin biosynthesis,regeneration and functions[J].Biochem J,2000,347(1):1-16.
[6]CURTIUS H C,HEINTEL D,GHISLA S,et al.Tetrahydrobiopterin biosynthesis-Studies with specifically labeled(2H)NAD(P)H and 2H2O and of the enzymes involved[J].Eur J Biochem,1985,148(3),413-419.
[7]FAN C L,BROWN G M.Partial purification and some properties of biopterin synthase and dihydropterin oxidase from Drosophila melanogaster[J].Biochem Genet,1979,17(3-4):351-369.
[8]BLAU N,THONY B .Tetrahydrobiopterin in biomedical research [J].Inherit Metab Dis,2009,3(2):1-2
[9]SCHERER-OPPLIGER T,MATASOVIC A,LAUFS S,et al.Dominant negative allele(N47D)in a compound heterozygote for a variant of 6-pyruvoyltetrahydropterin synthase deficiency causing transient hyperphenylalaninemia [J]. Hum Mutat,1999,13(4):286-289.
[10]KIM H L,CHOI Y K,KIM D H,et al.Tetrahydropteridine deficiency impairs mitochondrial function in Dictyostelium discoideum Ax2 [J].FEBS Lett,2007,581(28):5430-5434.
[11]MENG Y,KATSUMA S,DAIMON T,et al.The silkworm mutant lemon(lemon lethal)is a potential insect model for human sepiapterin reductase deficiency[J].J Biol Chem,2008,284(17):11698-11705.
[12]LAEMMLI U K .Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,5259(227):680-685.
[13]ZHU B J,WU X Z.Characterization and function of CREB homologue from Crassostrea ariakensis stimulated by rickettsialike organism[J].Dev Comp Immunol,2008,32(12):1572-1581.
[14]KATOH S.Sepiapterin reductase from horse liver:purification and properties of the enzyme [J].Arch Biochem Biophys,1971,146(1):202-214.
[15]THONY B,LEIMBACHER W,BLAU N,et al.Hyperphenylalaninemia due to defects in tetrahydrobiopterin metabolism-Molecular characterization of mutations in 6-pyruvoyl-tetrahydropterin synthase[J].Am J Hum Genet,1994,54(5):782-79.
[16]WERNER-FELMAYER G,GOLDERER G,WERNER E R.Tetrahydrobiopterin biosynthesis,utilization and pharmacological effects[J].Curr Drug Metab,2002,3(2):159-173.
[17]DHILLON B,BADIWALA M V,MAITLAND A,et al.Tetrahydrobiopterin attenuates homocysteine induced endothelial dysfunction[J].Mol Cell Biochem,2003,247(1-2):223-227.
[18]SHINOZAKI K,NISHIO Y,OKAMURA T,et al.Oral administration of tetrahydrobiopterin prevents endothelial dysfunction and vascular oxidative stress in the aortas of insulin-resistant rats[J].J Circulation,2002,87(7):566-573.
[19]HIGASHI Y,SASAKI S,NAKAGAWA K,et al.Tetrahydrobiopterin enhances forearm vascular response to acetylcholine in both normotensive and hypertensive individuals[J].Am J Hypertens,2002,15(4):326-332.
[20]YAMAMOTO K,KATAOKA E,MIYAMOTO N,et al.Genetic engineering of Escherichia coli for production of tetrahydrobiopterin[J].Metab Eng,2003,5(4):246-254.
[21]HATAKEYAMA K,INOUE I,HARADA T,et al.Cloning and sequencing of cDNA encoding rat GTP cyclohydrolase I.The first enzyme of the tetrahydrobiopterin biosynthetic pathway[J].J Biol Chem,1991,266(2):765-769.
[22]THONY B,LEIMBACHER W,BURGISSER D,et al.Human 6-pyruvoyltetrahydropterin synthase:cDNA cloning and heterologous expression of the recombinant enzyme[J].Biochem Biophys Res Co,1992,189(3):1437-1443.
[23]PARK D,PARK S,YIM J.Molecular characterization of Dro-sophila melanogaster dihydropteridine reductase[J].Biochim Biophys Acta,2000,1492(1):247-251.
[24]MANU SHARMA,DEMETRIUS M MARAGANORE,JOHN P A,IOANNIDIS,et al.Role of sepiapterin reductase gene at the PARK3 locus in Parkinson’s disease[J].Neurobiol Aging,2011,32:2108(e1-e5).
[25]WANG W J,GAO J S,WANG J,et al.Cloning,expression and enzymatic properties analysis of dihydrofolate reductase gene from the silkworm,Bombyx mori[J].Molecular Biology Reports,2012,39(12):10285-10291.
[26]NUC P,NUC K.Recombinant protein production in Escherichia coli[J].Postepy Biochem,2006,52(4):448-456.
[27]GAO J S,WANG J,WANG W J,et al.Isolation,purification and identification of an important pigment sepiapterin from integument of the lemon mutant of silkworm,Bombyx mori[J].Journal of Insect Science,2013,13:118.
