伴有辅酶原位再生的胞外酶耦合法制备(R)-苯基乙二醇*
2014-06-14彭益强李汉林
彭益强,李汉林
(华侨大学工业生物技术福建省高等学校重点实验室,福建 厦门 361021)
做为手性化合物的苯基乙二醇不仅是液晶材料中不可缺少的重要手性添加剂,也是制备具有光学活性的医药、农药和功能材料的重要中间体[1-3]。许多手性醇可以通过羰基还原酶(Carbonyl reductase,CR)对潜手性酮的立体选择性还原得到[4,5]。羰基还原酶是辅酶依赖型的氧化还原酶,属于短链脱氢/还原酶家族,其催化转化过程依赖辅酶的连续供给[6,7]。目前羰基还原酶催化制备手性醇的生产一般采用细胞转化法,目的是利用细胞自身的代谢为羰基还原酶的催化提供还原质子[8]。为加强辅酶供给,也有将羰基还原酶表达基因与辅酶NADH普适性再生酶如甲酸脱氢酶(Formate dehydrogenase,FDH)表达基因整合于同一质粒中共表达于同一宿主细胞中进行全细胞法转化[9,10]。
从工业生产的角度来讲,细胞催化转化法普遍存在着菌株培养条件复杂,生产过程的稳定性与安全性易受灭菌情况的潜在威胁,在很多情况下产物从发酵液中提取分离的过程较复杂,生产废液需进行环保处理等问题,而且发酵底物因细胞代谢途径复杂等原因不全转化为目的产物,因此对产率的提高也是一种限制[11,12]。胞外酶催化法做为近年来在工业生物技术领域中极受关注的催化转化法可以克服微生物细胞转化法中存在的局限性,具有反应速率快,底物转化较彻底,生产过程清洁和易于操作等特点[13]。本实验室从近平滑假丝酵母(Candida parapsilosis CICC1676)中经诱变分离得到了产高立体选择性的羰基还原酶(CRCp-9)的菌株,所产羰基还原酶能在体外将β-羟基苯乙酮不对称的还原为(R)型苯基乙二醇。同时为了解决体外氧化还原酶催化过程中辅酶的供应问题,本文将甲酸脱氢酶 (Formate dehydrogenase,FDH)与之相耦合解决还原型辅酶I(NADH)持续供给问题,实现了立体醇的胞外酶法连续制备(图1)。FDH是一种优良且使用广泛的NADH 循环利用再生物催化剂[14],德国的 Kula[15]在2002年提出的HCOOH/FDH体系已成为还原型辅酶NADH酶法再生最成功的再生系统。本文通过比较体外单酶催化和双酶耦合催化,构建一个伴有辅酶再生的体外双酶耦合催化体系连续制备立体醇手性化合物,为手性化合物的制备提供一个新型的催化转化体系。
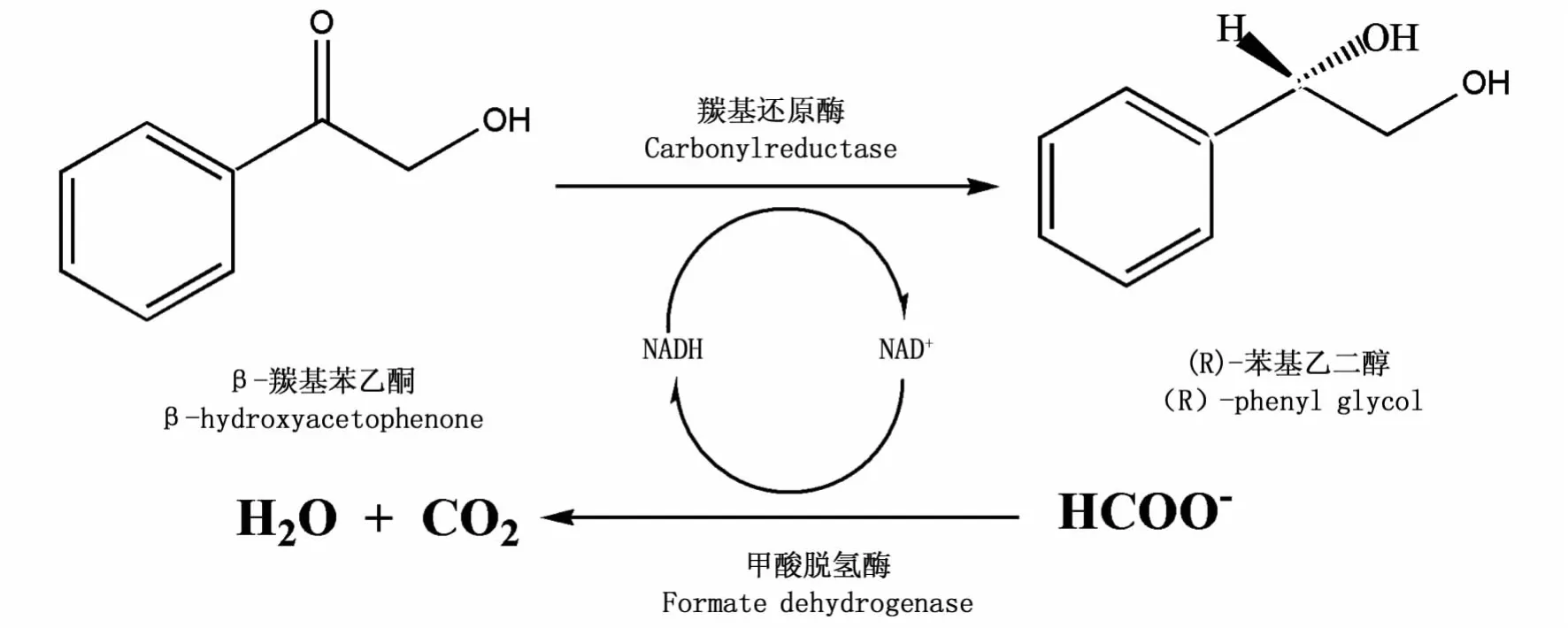
图1 伴有辅酶再生与循环利用的CR/FDH耦合制备(R)-苯基乙二醇体系Fig.1 (R)-phenyl-1,2-ethanediol preparation system of CR/FDH with cofactor regeneration and recycling
1 材料与方法
1.1 菌株
近平滑假丝酵母(Candida parapsilosis CICC1676)。
1.2 试剂、酶、缓冲液与培养基
氧化型辅酶I,还原型辅酶I(厦门泰京),(S)-苯基乙二醇与(R)-苯基乙二醇(Sigma公司),β-羟基苯乙酮(Aladdin Chemistry Co.Ltd),乙酸乙酯(上海国药);甲酸脱氢酶(恩瑞丽柏公司,最适反应pH8.0,pH 稳定范围6.0 ~9.0,最适反应温度45 ℃,温度稳定范围40~55℃);Tris-HCL缓冲液,Critic acid缓冲液,Gly-NaOH缓冲液,0.5 mmol/L的NADH溶液,5 mmol/L β-羟基苯乙酮溶液;LB培养基(胰蛋白胨 10.0 g/L,酵母浸膏 5.0 g/L,NaCl 10.0 g/L,pH自然),MYPG斜面培养基(麦芽汁 1%,酵母粉0.3% ,蛋白胨 0.5% ,葡萄糖 1% ,琼脂 2%),液体培养基(葡萄糖3%,酵母粉0.5%,蛋白胨0.5%,Mg-SO4·7H2O 0.05%,K2HPO3·3H2O 0.1%,KH2PO30.1%)。
1.3 主要仪器
高效液相色谱仪HP1100(Agillent),751型紫外可见光分光光度计(上海光谱)。
1.4 近平滑假丝酵母的活化与诱变培养
将保藏在LB培养基上的菌种活化,稀释一定浓度后涂布于培养皿上培养24 h,放在紫外灯下照射30 s后放入保温箱培养,观察菌株生长状况。48 h后,将生长良好的菌株筛选出来,接种到斜面培养基上。挑取斜面生长细胞接种于100 mL液体培养基进行发酵培养,30℃摇床(200 r/min)培养24 h破碎细胞测定酶活,挑取酶活最大菌株继续进行诱变筛选,共进行了5轮。
1.5 羰基还原酶液制备
斜面培养诱变后酶活最高菌株,挑取细胞接种于100 mL液体培养基,30℃摇床(200 r/min)培养24 h作为种子液。按5%的接种量将种子菌液接种于250 mL三角瓶中(含100 mL液体培养基),摇床(200 r/min)中继续培养24 h。菌液在8000 r/min的条件下离心,离心后的酵母菌体分散于Tris-HCL(pH8.5,10 mmol/L)缓冲液中,每升中菌体含量约为100 g湿重,置于冰浴中进行超声破碎(功率400 W,超声4 s,间歇 12 s,超声破碎 120 次),然后于4℃下离心(12000 r/min,10 min),所得上清液按文献[7]方法进行离子交换层析快速分离纯化即得羰基还原酶液,保藏待用。
1.6 羰基还原酶酶学性质考查
1.6.1 最适pH与pH稳定性的的测定 总反应体积为 2.5 mL,在不同 pH(3.0-11.0)的缓冲液中分别加入 0.5 mL 0.5 mmol/L NADH,0.5 mL 5 mmol/L底物 β-羟基苯乙酮,1.5 mL 0.2 mol/L 磷酸钾缓冲液,40℃水浴恒温2 min,加入0.5 mL酶液启动反应,测量340 nm处吸光度的变化,根据测定的吸光度变化数值计算酶活,考查pH对酶活的影响。将酶液分别在放置在不同的pH(3.0-9.0)缓冲液中静置2 h后,相同测活体系测定剩余酶活以考察该酶的pH稳定性。
1.6.2 最适反应温度与温度稳定性的测定 测活体系如 1.6.1所示,分别在 pH7.0,不同的温度(20-70℃)下水浴恒温2 min,加入相同的酶量启动反应,测量340 nm处吸光度的变化,根据测定的吸光度变化数值计算酶活,考查温度对酶活的影响。分别取相同的酶液在不同的温度下(10-70℃)保温1 h后,相同测活体系测定剩余酶活以考察该酶的温度稳定性。
1.7 R-苯基乙二醇胞外酶催化制备
1.7.1 R-苯基乙二醇单酶催化制备 反应体系中含 0.07 g NAD+,加入 β-羟基苯乙酮2.9 mL(终浓度6 g/L),然后加入磷酸钾缓冲液7.1 mL,用漩涡混合器将整个反应体系混匀后加入0.5 mL的羰基还原酶,摇床微微震荡充分反应,每隔0.5 h取样测定底产物含量。
1.7.2 R-苯基乙二醇双酶耦合催化制备 反应在50 mL反应器中进行。体系中含0.05 g NAD+,加入β-羟基苯乙酮溶液(终浓度6 g/L)和另一底物甲酸钠溶液,然后加入磷酸钾缓冲液定容。整个反应体系混匀后加入羰基还原酶液和甲酸脱氢酶液启动耦合反应。摇床微微震荡充分反应,每隔0.5 h取样测定底产物含量。
1.8 分析方法
羰基还原酶酶活的测定:测活体系如1.6.1所述。酶活定义:在上述条件下,每分钟催化还原1 μmol NADH的酶活力为1个酶活单位。每单位体积酶活计算公式如下:
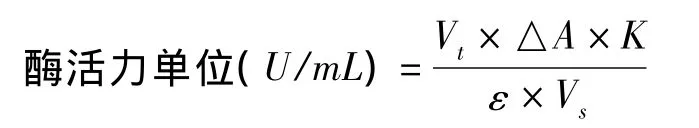
其中,Vt:反应液总体积;Vs:抽提液样品体积;△A:每分钟吸光度变化值;K:样品稀释倍数;ε:摩尔消光系数,数值为6.22。
底物β-羟基苯乙酮测量:参考文献[16]的方法,β-羟基苯乙酮的羟基在240 nm处有着最大的紫外吸收峰,测定不同反应时间体系中β-羟基苯乙酮的吸光值,对照标准曲线,可计算出β-羟基苯乙酮的量。
产物 R-苯基乙二醇测定:参考文献[15,17]方法,样品液用一倍体积的乙酸乙酯萃取,萃取5 h,微孔过滤后有机相用液相色谱分析产物(R)-苯基乙二醇光学纯度及产率,计算相应产物量。
2 结果与分析
2.1 酶液制备及催化实验
经过5轮诱变筛选,标号为9的菌株经扩培发酵测得产羰基还原酶的酶活最高,此菌株编号为CP-9,单位体积酶活为1.9 U/mL(表1)。将此菌株扩培,细胞破碎后离心分离进行硫酸铵提取与离子交换层析快速分离纯化,获得纯化倍数为11.5倍的羰基还原酶酶液(表2)。此羰基还原酶(CRCp-9)催化底物β-苯基乙二酮后产物经鉴定为(R)-苯基乙二醇,说明筛选菌株产的羰基还原酶为(R)-专一性次级醇还原酶。
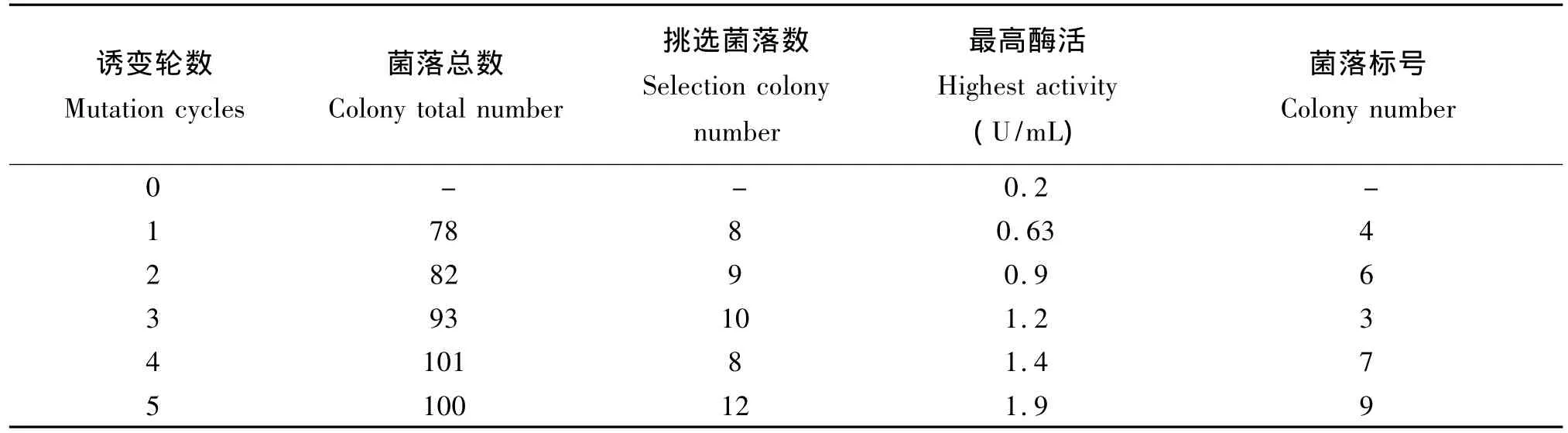
表1 产羰基还原酶的近平滑假丝酵母菌株诱变筛选Tab.1 Mutation and filtration of Candida parapsilosis producing carbonyl reductase
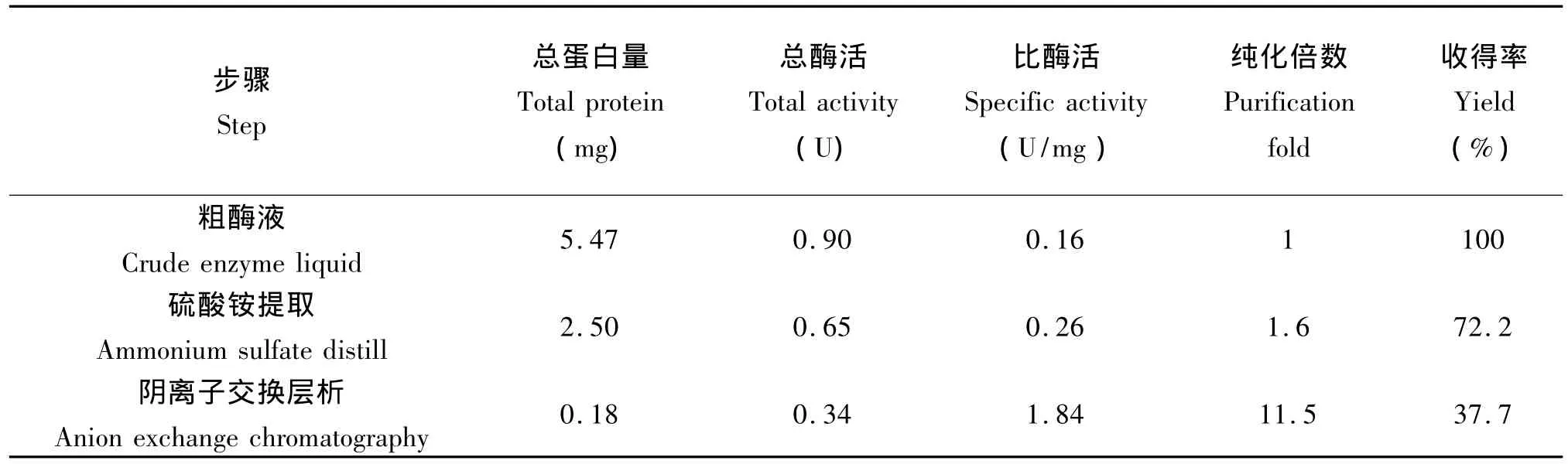
表2 羰基还原酶(CRCp-9)酶液的快速分离纯化Tab.2 Quick purification of carbonyl reductase(CRCp-9)from Candida parapsilosis CICC1676
2.2 羰基还原酶酶学性质的研究
2.2.1 最适pH值与pH稳定性 根据不同pH下测得的吸光度值计算出相应的酶活,以最高酶活作为100%,计算出不同pH下的相对酶活,做相对酶活对pH值的变化曲线,如图2所示。由图可知,羰基还原酶(CRCp-9)催化还原β-羟基苯乙酮的最适pH值为6.5。同时测定在不同pH缓冲液保存一段时间后的酶液的酶活,以最高酶活为100%,做相对酶活对pH值的变化曲线,如图3所示。由图可知,该羰基还原酶具有较广的pH稳定范围,在 pH4.0-8.0之间酶活相对比较稳定。解睛等[18]从拟热带假丝酵母(Candida pseudotropicalis C104)中分离筛选到的羰基还原酶还原反应最适 pH为6.0-6.5,耿亚维等[19]从近平滑假丝酵母(Candida parapsilosis CTCCM 203011)中基因组中钓取新型(s)-羰基还原酶基因,在E.coli中构建重组表达菌,最适反应pH为5.5,而羊明等[20]从近平滑假丝酵母 (Candida parapsilosis CCTCC 203011)分离到(R)-羰基还原酶,最适反应pH为6.0。由此可见不同来源的羰基还原酶最适反应pH较相似,但也存在一些差异,如催化(S)型与(R)型的不同,基因表达的性质也有些变化。本文的目的是要在胞外与甲酸脱氢酶(最适反应pH为8.0)耦合构建双酶催化制备体系。催化体系要求双酶的酶学性质尽量相近,以保持双酶体系具有较高的催化能力。由此可知两酶的最适pH值还是有一定差别,但 CRCp-9的 pH 稳定范围为4.0-8.0,这为两酶耦合反应设置较合适pH提供了条件。综合两酶性质,设定耦合反应体系pH值为7.0。

图2 羰基还原酶CRCp-9最适反应pHFig.2 Optimum pH of carbonyl reductase(CRCp-9)catalytic reaction
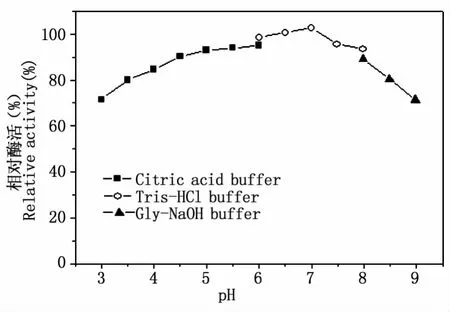
图3 羰基还原酶CRCp-9pH稳定性Fig.3 Effect of pH on carbonyl reductase(CRCp-9)stability
2.2.2 最适温度与温度稳定性 根据不同温度下测得的吸光度值计算出不同温度一下的酶活,以最高酶活为100%,计算出不同温度时的相对酶活。做酶活对反应温度变化曲线,如图4所示。如图所示,酶催化还原反应的最适温度为40℃。从各种微生物中纯化所得到的羰基还原酶在催化反应是最适温度不同,但大多都在30~40℃之间[18-20]。同时测定酶液在不同温度下保藏一段时间后的酶活,以最高酶活为100%,做不同温度下酶活变化曲线,如图5所示。如图所示,40℃下保存的酶活力损失不大,可保持原酶活的90%以上,说明该酶能耐受一定的温度变化。但当温度高于50℃时,酶蛋白的失活较为严重,在60~70℃之间,酶活近乎丧失。在与甲酸脱氢酶(最适反应温度45℃,温度稳定范围40~55℃)构建耦合反应体系时,要求双酶最适反应温度尽量相近。从研究结果看,双酶温度稳定性具有一定的交集,根据耦合反应要求,体系反应温度可定为45℃。

图4 羰基还原酶CRCp-9最适反应温度Fig.4 Optimum temperature of carbonyl reductase(CRCp-9)catalytic reaction
2.3 羰基还原酶催化单反应
为了与伴有辅酶反复利用的双酶耦合反应相比较,考查在没有进行辅酶再生的情况下羰基还原酶转化底物的效果。通过每0.5 h取样,测定样品中底产物量的变化,可得单酶催化反应中底物转化和产物生成的变化趋势(图6)。由图6可见,在反应前1.5 h,底物苯乙酮和产物苯乙醇以较衡定的速率进行转化和产生(可由曲线的斜率判断),这是由于体系中辅酶NADH的量还可提供足够的质子还原力;反应进行2 h后,底产物转化和产生速率均趋近于零,反应达到一个平衡状态,这是由于辅酶量逐渐消耗,己不足以维持酶的还原反应。因此批次单酶催化反应平衡时间为2.5 h,底物未能完全转化,底物转化率为25%,同时测定产物(R)-苯基乙二酮的ee值为98.6%。这是由于胞外纯酶催化,消除了胞内转化时其它酶的干扰,可以得到更高纯度的立体醇[21]。
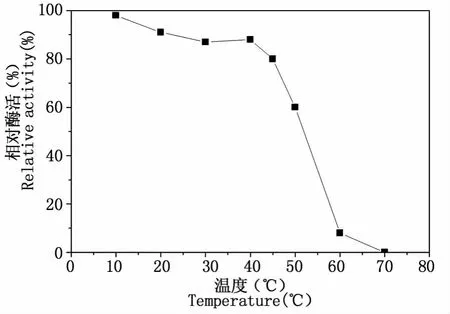
图5 羰基还原酶CRCp-9温度稳定性Fig.5 Effect of temperature on carbonyl reductase(CRCp-9)Stability

图6 羰基还原酶CRCp-9单反应转化 β-羟基苯乙酮过程Fig.6 Translation process of β-hydroxyacetophenone by carbonyl reductase single catalyse
2.4 (R)-苯基乙二醇的胞外耦合酶法制备
在CRCp-9转化苯乙酮反应中耦合NADH再生酶-甲酸脱氢酶以解决反应所需还原力问题。在耦合体系反应过程中每0.5-1 h取样测定底产物的量,获得CR/FDH耦合反应中底产物变化趋势图(图7)。由图7可见,虽然耦合体系中NAD+的量较之单反应的还少,但由于FDH的辅酶再生作用,可为CR的还原反应提供持续的还原力,保证了CR还原反应的连续进行。反应平衡时底物苯乙酮转化率较单反应有较大提高,达到了95.4%(底物转化率未达100%的原因可能与酶耦合反应条件,底产物抑制和酶活存在半衰期等有关),产物(R)-苯基乙二醇得率为93%,产物ee值达98.6%。由于在胞外进行单一纯酶催化,同时利用专一性的辅酶再生酶解决辅酶持续供给问题,伴有辅酶循环利用的胞外耦合催化法获得了较高的转化率和较高的光学纯度e.e.值,辅酶的总转化数为267。从工业生产角度更注重转化体系的生产能力(productivity),胞外CR/FDH耦合体系批次反应平衡时间为7 h(图7),生产能力达0.8 g/L/h,较相似的细胞转化法的生产能力有较大的提高[22]。
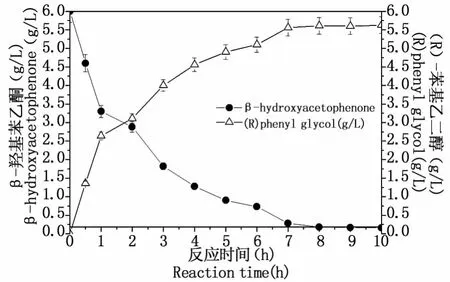
图7 CR/FDH耦合反应转化β-羟基苯乙酮过程Fig.7 Translation process of β-hydroxyacetophenone by CR/FDH coupling reaction
3 结论
实验室保藏的近平滑假丝酵母(Candida parapsilosis CICC1676)经5轮诱变筛选获得具(R)-专一性羰基还原酶CRCp-9,经快速分离纯化获得纯化倍数为11.5倍的酶液,其最适反应pH为6.5,pH稳定范围为4.0-8.0,最适反应温度为40℃,温度稳定范围为30-45℃,与甲酸脱氢酶(FDH)最适pH与最适反应温度较接近,有利于耦合构建伴有辅酶再生与循环利用的CR/FDH双酶连续催化反应。与CRCp-9单酶转化底物反应相比较,CR/FDH耦合体系转化时间延长,底物β-羟基苯乙酮转化更彻底,转化率提高到95.4%,产物(R)-苯基乙二醇得率也提高到93%,产物 e.e.值达 98.6% ,辅酶总转化数(TTN)为 267。与相类似转化反应的细胞转化法相比,也具备较好的耦合体系生产能力,批式生产能力达0.8 g/L/h。胞外双酶耦合催化法解决了立体醇酶法催化制备过程中辅酶再生与循环利用问题并表现出了较高的生产能力,为立体醇等手性化合物的工业生产提供了一种新型、有效的制备体系。
[1]LIU J Y,LIN Y P,QIU H,et al.Substituted phenyl groups improve the pharmacokinetic profile and anti-inflammatory effect of urea-based soluble epoxide hydrolase inhibitors in murine models[J].European Journal of Pharmaceutical Sciences,2013,(1):1-9.
[2]CAUDA V,SCHLOSSBAUER A,BEIN T.Bio-degradation study of colloidal mesoporous silica nanoparticles:effect of surface functionalization with organo-silanes and poly(ethylene glycol)[J].Microporous and Mesoporous Materials,2010,132(9):60-71.
[3]聂尧,徐岩,王海燕,等.重组大肠杆菌不对称还原2-羟基苯乙酮合成(R)-苯基乙二醇[J].化工进展,2006,25(10):1231-1236.NIE Yao,XU Yan,WANG Haiyan,et al.Synthesis of(R)-1-phenyl-1,2-ethanediol by stereospecific reduction of2-hydroxyacetophenone using recombinant Escherichia coli expressing(R)-specific carbonyl reductase[J].Chemical Industry and Engineering Progress,2006,25(10):1231-1236.
[4]WANG L J,LI C X,NI Y,et al.Highly efficient synthesis of chiral alcohols with a novel NADH-dependent reductase from Streptomyces coelicolor[J].Bioresource Technology,2011,102(4):7023-7028.
[5]ALANVERT E,DOHERTY C,MOODY T S,et al.Highly stereoselective biocatalytic reduction of alpha-halo ketones[J].Tetrahedron:Asymmetry,2009,20(9):2462-2466.
[6]YE Q,YAN M,XU L,et al.A novel carbonyl reductase from Pichia stipitis for the production of ethyl(S)-4-chloro-3-hydroxybutanoate[J].Biotechnology Letter,2009,31(1):537-542.
[7]羊明,徐岩,穆晓清,等.一种新的高立体选择性羰基还原酶的性质及分离[J].化工进展,2006,25(9):1082-1088.YANG Ming,XU Yan,MU Xiaoqing,et al.Purification and characterization of a novel carbonyl reductase with high stereo-selectivity[J]. Chemical Industry and Engineering Progress,2006,25(9):1082-1088.
[8]ZHANG R Z,GENG Y W,XU Y,et al.Carbonyl reductase SCRII from Candida parapsilosis catalyzes anti-Prelog reaction to(S)-1-phenyl-1,2-ethanediol with absolute stereochemical selectivity[J].Bioresource Technology,2011,102(8):483-489.
[9]EMA T,YAGASAKI H,OKIY N,et al.Asymmetric reduction of ketones using recombinant E.coli cells that produce a versatile carbonyl reductase with high enantioselectivity and broad substrate specificity[J].Tetrahedron,2006,62(5):6143-6149.
[10]GORETTI M,PONZONI C,CASELLI E,et al.Bioreduction of α,β-unsaturated ketones and aldehydes by non-conventional yeast(NCY)whole-cells[J].Bioresource Technology,2011,102(11):3993-3998.
[11]ZHANG Y,GAO F,ZHANG S P,et al.Simultaneous production of 1,3-dihydroxyacetone and xylitol from glycerol and xylose using a nanoparticle-supported multi-enzyme system with in situ cofactor regeneration[J].Bioresource Technology,2011,102(6):1837-1843.
[12]TONG X D,EL-ZAHAB B,ZHAO X Y,et al.Enzymatic synthesis of L-Lactic acid from carbon dioxide and ethanol with an inherent cofactor regeneration cycle[J].Biotechnology and Bioengineering,2011,108(2):465-469.
[13]KOELLER K M,WONG C.Enzymes for chemical synthesis[J].Nature,2001,40:232-240.
[14]WICHMANN R,VASIC-RACKI D.Technology Transfer in Biotechnology:from lab to industry to production[M].Berlin:Springer-Verlag,2005.
[15]NIE Y,XU Y,MU X Q.Highly enantioselective conversion of racemic 1-phenyl-1,2-ethanediol by stereoinversion involving a novel cofactor-dependent oxidoreduction system of Candida parapsilosis CCTCC M203011 [J].Organic Process Research.Development,2004,8:246-251.
[16]马丽,韦一萍,刘雄民.双波长紫外分光光度法测定生物转化液中苯乙酮和肉桂酸的含量[J].食品工业科技,2009,6:336-338.MA Li,WEI Yiping,LIU Xiongming.Determination of acetophenone and cinnamic acid in bioconversion broth by dualwavelength ultraviolet spectrophotometry[J].Science and Technology of Food Industry,2009,6:336-338.
[17]聂尧,徐岩.全细胞近平滑假丝酵母(Candida parapsilosis)SYB-1不对称转化苯基乙二醇[J].过程工程学报,2003,3(1):80-85.NIE Yao,XU Yan.Asymmetric conversion of 1-Phenyl-1,2-ethanediol by Candida parapsilosis SYB-1[J].The Chinese Journal of Process Engineering,2003,3(1):80-85.
[18]解晴,吴坚平,林立,等.拟热带假丝酵母中羰基还原酶的纯化及其酶学性质研究[J].高校化学工程学报,2009,23(1):92-98.XIE Qin,WU Jianping,LIN Li,et al.Purification and characterization of a carbonyl reductase from Candida pseudotropicalis[J].Journal of Chemical Engineering of Chinese Universities,2009,23(1):92-98.
[19]耿亚维,张荣珍,王珊珊,等.一种新型(S)2羰基还原酶的克隆及其功能表达[J].微生物学报,2010,50(1):60-66.GENG Yawei,ZHANG Rongzhen,WANG Shanshan,et al.Gene cloning and expression of a novel(S)-specific carbonyl reductase[J].Acta Microbiologica Sinica,2010,50(1):60-66.
[20]羊明,徐岩,穆晓清,等.近平滑假丝酵母NAD(H)依赖型次级醇脱氢酶的分离纯化及酶学性质[J].应用与环境生物学报,2007,13(1):121-125.YANG Ming,XU Yan,MU Xiaoqing,et al.Purification and characterization of NAD(H)dependent second alcohol dehydrogenase from Candida parapsilosis[J].China Journal of Application Environment Biology,2007,13(1):121-125.
[21]曾嵘,杨忠华,姚善泾.生物催化羰基不对称还原合成手性醇的研究及应用进展[J].化工进展,2004,23(11):1169-1173.ZENG Rong,YANG Zhonghua,YAO Shanjing.Progress of asymmetric reduction of carbonyl compounds to chiral alcohol with biocatalysis[J].Chemical Industry and Engineering Progress,2004,23(11):1169-1173.
[22]张荣珍,徐岩,耿亚维,等.羰基还原酶与甲酸脱氢酶偶联催化制备(R)-苯基乙二醇[J].过程工程学报,2009,9(4):801-805.ZHANG Rongzhen,XU Yan,GENG Yawei,et al.Preparation of(R)-1-Phenyl-1,2-ethanediol by Biotransformation with a Coupled System of(R)-Specific Carbonyl Reductase and Formate Dehydrogenase[J].The Chinese Journal of Process Engineering,2009,9(4):801-805.
