干扰素α-2b治疗JAK2V617F阳性的真性红细胞增多症和原发性血小板增多症的疗效分析*
2014-06-13靳凯宇
靳凯宇
(菏泽医学专科学校,山东 菏泽 274000)
PV和ET属于常见的骨髓增生性肿瘤(MPN),血象特点为不明原因的血细胞持续升高,临床容易发生血栓栓塞和出血并发症,部分患者可转化为骨髓纤维化或白血病。通过分子生物学研究发现约90%的PV和约50%的ET患者骨髓细胞存在激酶JAK2V617F点突变,该突变的检测是诊断PV和ET的重要指标之一。近年来国外有学者将检测该突变的拷贝数用来评价疗效和微小残留病灶(MRD)[1-3],国内报道还很少[4]。目前,IFN在MPN的治疗中处于重要地位[5],近年来我科采用IFNα作为一线治疗,并通过随访,发现IFNα不但具有较高的血液学缓解率,而且能使部分JAK2V617F阳性的患者达到分子学缓解,收到良好的治疗效果。
1 材料与方法
1.1患者资料
所有患者均为我院自2009年6月至2013年6月在我院门诊就诊及住院的患者,PV和ET诊断符合WHO2001标准。JAK2V617F阳性患者接受IFNα治疗6月以上的47例(男26例,女21例),就诊中位年龄55岁(41~78岁),其中PV27例, ET20例。拒绝使用干扰素者采用羟基脲治疗共44例,其中PV25例(男11例,女14例,中位年龄53岁),ET19例(男10例,女19例,中位年龄51岁)。
1.2治疗方案及疗效评价
1.2.1预治疗:白细胞>50×109/L或血小板>1000×109/L的患者给予小剂量羟基脲0.5~1 g/d,并给予阿司匹林100 mg/d口服治疗,血小板>1500×109/L的ET患者则禁止应用阿司匹林;血红蛋白>200 g/L的PV患者给予放血疗法,每次200~400 ml,每周2次。当患者外周血白细胞<50×109/L、血红蛋白<180 g/L、血小板<800×109/L以下时,再进行IFNα或羟基脲治疗。
1.2.2治疗方案 干扰素组:IFNα-2b(哈药集团生物工程有限公司) 300万IU,皮下注射,每周3次,当达到完全血液学缓解后可减量至每周1~2次维持。羟基脲组:给予羟基脲0.5~1.5g/d,当血细胞接近正常时减量至0.25~0.5/d维持治疗。
1.2.3疗效评价 疗效评价参考WHO2001年标准。完全血液学缓解(CHR) 定义为: 脾大消失; 血细胞计数正常,白细胞<10.0×109/L, 及血小板<400×109/L,红细胞压积小于45%( 男),42%(女) (持续3 个月以上)。部分血液学缓解(PHR) 定义为: 血细胞计数下降较初诊时下降50%,可伴有脾大。治疗无效判断标准:达不到部分缓解者。完全分子学缓解(CMR)定义为JAK2V617F 基因突变转为阴性。部分分子学缓解(PMR) 定义为JAK2V617F 突变负荷较前减少50%。微小分子学反应(MMR) 定义为JAK2V617F 突变负荷减少20%~49%。
1.3JAK2V617F基因突变检测
治疗前和开始治疗后每6月无菌抽取患者骨髓5 ml,提取基因组DNA,参考文献[4]方法,采用巢式基因突变定量PCR检测患者JAK2V617F基因突变。按下列公式检测其Ct值。
JAK2V617F 负荷( %V617F) = DNA(JAK2V617F) /DNA( JAK2WT + JAK2V617F)
△ Ct = CtJAK2V617F-CtJAK2WT
应用JAK2V617F 负荷( % V617F) 做横坐标,△Ct值做纵坐标,做出标准曲线。所有样本重复检测3 遍,根据不同样本3 次△Ct 的平均值,在标准曲线上计算出其相对应的JAK2V617F 负荷。
1.4统计学处理
2 结 果
2.1两组MPN患者血液学缓解率的比较
如表1,PV患者应用IFNα-2b治疗组血液学总缓解率(CHR+PHR)85.19%,达CHR时间3.5±1.2月,应用羟基脲治疗组血液学总缓解率56.0%,达CHR时间6.0±1.5月。IFNα-2b总缓解率高于羟基脲治疗组(P=0.02<0.05),达缓解时间短于羟基脲组(P<0.001)。ET患者应用IFNα-2b总血液学缓解率75.0%,达CHR时间3.6±1.6月,应用羟基脲治疗组总血液学缓解率42.1%,达CHR时间6.4±2.3月。IFNα-2b总缓解率高于羟基脲治疗组(P=0.037<0.05),达缓解时间短于羟基脲组(P<0.001)。
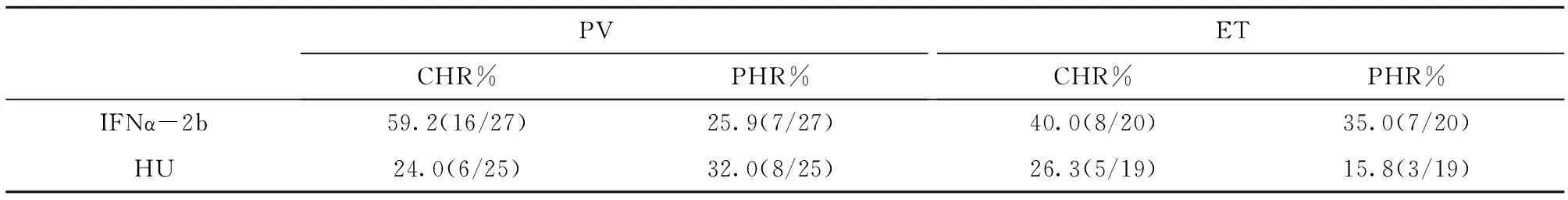
表1 两组MPN患者血液学缓解率的比较
2.2两组MPN患者分子学缓解率的比较
如表2,PV患者IFNα-2b治疗组总分子学缓解率(CMR+PMR)77.7%,羟基脲治疗组4.0%,P<0.001。ET患者IFNα-2b治疗组总分子学缓解率60%,羟基脲治疗组0%,P<0.001。PV和ET患者IFNα-2b治疗后达CMR时间分别为20±6月和18±4.9月。 2例PV患者达到CMR停用IFNα-2b,分别在6月和12月后出现分子学复发,继续应用6月后又达到CMR。
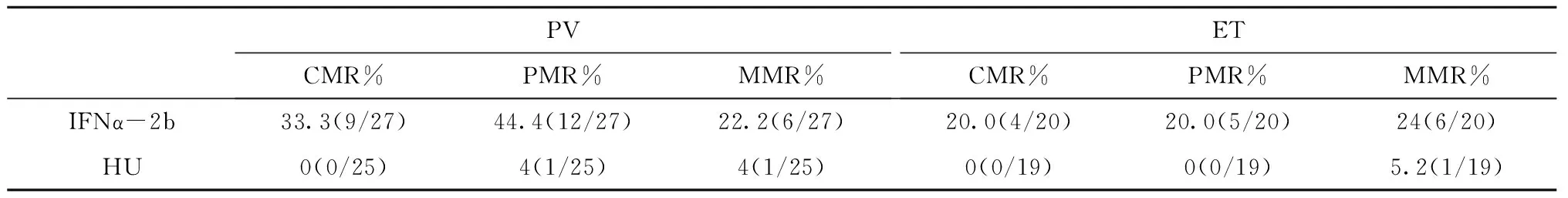
表2 两组MPN患者分子学缓解率的比较
2.3两组MPN患者并发症的比较
如表3,两组MPN患者IFNα-2b治疗血栓和出血发生率均低于羟基脲治疗组,但P均>0.05。

表3 两组MPN患者并发症的比较
2.4干扰素的不良反应
患者在首次应用IFNα-2b后,均出现发热、头痛、肌肉关节酸痛等类流感样症状,体温在37.8℃~39.9℃,给予非甾体类抗炎药后大部分患者好转。应用3~6次后,发热症状消失。3例患者出现纳差,腹胀,2例患者出现嗜睡,抑郁,1例患者出现脱发。
3 讨 论
在2008年世界卫生组织(WHO)造血和淋巴组织肿瘤分类中,PV和ET均归为造血干细胞恶性克隆性疾病,病理学特点是骨髓增生异常活跃,外周血细胞持续升高并伴有不成熟性,因此抑制骨髓细胞恶性增生是治疗的重点。JAK2V617F基因突变的发现使得该类疾病的靶向治疗成为可能,目前国外JAK激酶抑制剂正在进行临床实验,但进入临床应用还需要时间,且疗效和副作用还需要观察,目前IFNs的应用仍处于一线地位。IFNs具有以下生物学作用:1抑制骨髓细胞增殖。IFN-α能下调cyclin E, cyclin A, cdc25A, cyclin D-cdk4, 和 cyclin-cdk6的表达及活化,并抑制Rb蛋白的磷酸化,从而抑制细胞由G1期进入S期,延缓细胞的增生和分裂[6]。IFN-α能抑制造血生长因子如粒细胞集落刺激因子(G-CSF)、巨核细胞集落刺激因子(Mk-CSF)、促血小板生成素(TPO)的合成和分泌,并且能促进抑制造血的细胞因子如转化生长因子(TGF)、肿瘤坏死因子(TNF)的分泌,从而起到抑制巨核细胞、红细胞以及粒细胞的增生和分化[7,8]。 2促进细胞凋亡。IFNs能引起细胞膜和细胞浆的结构改变,DNA片段化和凋亡小体的形成;IFNs能上调TRAIL、FasL,与相应受体结合后活化Fas相关的死亡结构域,并活化下游的蛋白酶如Caspase-4,Caspase-8等诱发凋亡[9]。3免疫调节作用。IFNs能促进宿主体内不成熟细胞如T淋巴细胞、NK细胞和单核细胞的分化。单核细胞分化为抗原呈递细胞活化T和B细胞,而T细胞和NK细胞可起到杀伤肿瘤细胞的用[10]。4抑制骨髓纤维化。虽然存在争议,但有研究证明, TGF-β能够刺激多种器官和组织中成纤维细胞增生,调节血小板源性生长因子(PDGF)的分泌,是促进胶原纤维的合成和沉积的重要调节因子。IFN-γ能通过STAT途径调节TGF-β的分泌,抑制胶原在骨髓中的沉积[11]。5诱导细胞遗传学缓解。在MPN患者中,往往存在克隆性的染色体异常,IFNs作为一种非致白血病的生物治疗方式,可以诱导患者达到细胞遗传学缓解[12]。
我们研究数据发现,与传统的药物羟基脲相比,IFN-α治疗具有血液学缓解率高,血栓发生率低的特点,并且能诱导患者达到分子学缓解,并且不具有致白血病作用。IFN-α的这些特性使得它成为治疗MPN的一种适宜的生物制剂。但IFN-α具有发热、寒颤、肌肉酸痛、乏力、食欲减退等副作用,并且会对神经系统、内分泌、生殖系统有不良影响。另外IFN-α需要长期注射使得部分患者不能坚持。从我们研究看出,中断IFN-α治疗可以使JAK2V617F拷贝数升高,继续应用拷贝数可再下降。因此,IFN-α治疗需要长期维持,具体维持时间和剂量尚无统一标准。聚乙二醇干扰素(peg-IFN)最初用来治疗乙型肝炎,与传统IFN相比,具有半衰期长和副作用低的特点,每周只需注射1次,耐受性好。近来有报道peg-IFN治疗MPN亦取得了不错的疗效[13]。目前peg-IFN和羟基脲治疗PV和ET的随机对照试验正在进行中,有望成为治疗Ph染色体阴性的MPN的更好选择。
[1] Larsen TS, Pallisgaard N, Moller MB,et al. The JAK2 V617F alleleburden in essential thrombocythemia, polycythemia vera and primary myelofi-brosis - impact on disease phenotype[J]. Eur J Haematol, 2007,79(6):508-515.
[2] Kiladjian J, Cassinat B, Chevret S, et al.Pegylated interferon-alfa-2a induces complete hematologic and molecularresponses with low toxicity in polycythemia vera[J]. Blood,2008,112(8):3065-3072.
[3] Barosi G, Birgegard G, Finazzi G, et al. Response criteria for essential thrombocythemia and poly-cythemia vera: result of a European Leukemia Net consensus conference[J].Blood,2009,113(20):4829-33.
[4] 白洁,薛艳萍,张磊等.干扰素α-2b 治疗真性红细胞增多症及其继发骨髓纤维化患者分子生物学反应的研究[J].中国实验血液学杂志,2011,19( 2) : 444-449.
[5] Barbui T,Finazzi MC,Finazzi G.Front-line therapy in polycythemia vera and essential thrombocythemia[J].Blood Rev,2012,26(5):205-211.
[6] Hasselbalch HC .A new era for IFN-α in the treatment of Philadelphia-negative chronic myeloproliferative neoplasms[J].Expert Rev Hematol,2011,4(6):637-55.
[7] Wang Q, Miyakawa Y, Fox N,et al.Interferon-alpha directly represses megakaryopoiesis by inhibiting thrombopoietin-induced signaling through induction of SOCS-1[J].Blood,2000,96(6):2093-2099.
[8] Dai CH,Price JO,Brunner T,et al.Fas ligand is present in human erythroid colony-forming cells and interacts with Fas induced by interferon gamma to produce erythroid cell apoptosis[J]. Blood,1998,91(4):1235-1242.
[9] Chawla-Sarkar M, Lindner DJ, Liu YF,et al. Apoptosis and interferons: role of interferon-stimulated genes as mediators of apoptosis[J]. Apoptosis,2003,8(3):237-249.
[10] Rizza P,Moretti F,Belardelli F. Recent advances on the immunomodulatory effects of IFN-alpha: implications for cancer immunotherapy and autoimmunity[J].Autoimmunity,2010,43(3):204-209.
[11] Eickelberg O, Pansky A, Koehler E,et al. Molecular mechanisms of TGF-(beta) antagonism by interferon (gamma) and cyclosporine A in lung fibroblasts[J].FASEB J,2001,15(3):797-806.
[12] Kiladjian JJ, Cassinat B, Chevret S,et al. Pegylated interferon-alfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera[J].Blood,2008,112(8):3065-3072.
[13] Quintás-Cardama A, Abdel-Wahab O, Manshouri T,et al.Molecular analysis of patients with polycythemia vera or essential thrombocythemia receiving pegylated interferon α-2a[J].Blood,2013,122(6):893-901.
