超声造影引导射频消融治疗等回声肝癌的临床应用
2014-06-09翁高龙黄建国褚丹梅丽丽卢志华张新华
翁高龙,黄建国,褚丹,梅丽丽,卢志华,张新华
·临床研究Clinical research·
超声造影引导射频消融治疗等回声肝癌的临床应用
翁高龙,黄建国,褚丹,梅丽丽,卢志华,张新华
目的探讨超声造影(CEUS)对等回声肝癌的检出率,评价CEUS技术在射频消融(RFA)治疗等回声肝癌中的应用价值。方法术前常规超声反复检查未发现,而增强CT(CECT)或增强MRI(CEMRI)检出并经临床确诊的27例患者共31个病灶,其中11例(11个病灶)为肝细胞肝癌(HCC),16例(20个病灶)为转移性肝癌。在CEUS实时引导下对31个病灶行RFA,术后用CEUS评价肿瘤消融程度并指导补充治疗。结果31个病灶CEUS时均检出,并全部行RFA治疗,无一例出现严重并发症。术后1个月,CEUS和CECT均提示31个病灶完全坏死,11例HCC患者血清AFP均降至正常范围,而转移性肝癌患者血清CEA、CA-199、CA-153水平均较术前明显降低,P<0.01。结论CEUS技术可明显提高等回声肝癌的检出率,在引导等回声肝癌RFA治疗中具有重要的临床应用价值。
超声造影;肝癌;射频消融
【Key words】contrast-enhanced ultrasound;liver cancer;radiofrequency ablation
近年来,射频消融(radiofrequency ablation,RFA)因其具有微创、安全、疗效确切的优势广泛应用于治疗肝脏恶性肿瘤[1]。优质的影像引导技术对RFA治疗效果的影响至关重要,超声造影(contrastenhanced ultrasound,CEUS)因其可以提高肝脏肿瘤的检出率、清晰显示肿瘤浸润范围及与邻近脏器、血管的关系[2],已广泛应用于肝癌的介入性诊疗。本研究旨在探讨CEUS在等回声肝癌的RFA治疗中的应用价值。
1 材料与方法
1.1 材料
1.1.1 研究对象2010年5月—2013年6月,对我院常规超声未检出的肝癌患者27例(31个病灶)在CEUS引导下行RFA,其中男21例,女6例,年龄41~71岁,平均(57±7)岁。11例(11个病灶)为肝细胞肝癌(HCC),16例(20个病灶)为转移性肝癌,其中原发灶11例(14个病灶)来自胃肠道,3例(3个病灶)来自乳腺,2例(3个病灶)来自胰腺。所有肝癌诊断符合卫生部“原发性肝癌诊疗规范(2011年版)”,转移性肝癌患者的原发灶均行根治性切除手术,肝内转移灶通过增强CT(contrastenhanced CT,CECT)、增强MRI(contrast-enhanced,MRI,CEMRI)或穿刺活检病理证实诊断,且RFA治疗前均未行全身或局部化疗。病灶长径0.7~3.2 cm,平均长径(2.0±0.4)cm。
1.1.2 仪器设备超声设备采用GE LOGIQ 9彩色多普勒超声(彩超)诊断仪,探头频率3.5~5.0MHz,配有TruAgent双模式造影成像技术。对比剂为意大利Brocca公司的声诺维(SonoVue)干粉剂,按标准方法配制成六氟化硫微泡混悬液,造影时每次抽取2.4m l经肘部浅静脉团注。
CT采用GE-lightspeed-VCT64排128层螺旋CT扫描机,MR采用Siemens verio 3.0 T超导磁共振机。
RFA系统采用上海迈德公司S-1500肿瘤射频治疗仪,具有双模(温度与阻抗)控制,最大功率200W,频率480 kHz。电极针为17 G多极针,单次消融范围2.0~5.0 cm。
1.2 方法
1.2.1 手术方法
1.2.1.1 术前:27例患者31个病灶在常规超声检查肝脏时均未检出,HCC患者由于血清甲胎蛋白(AFP)显著升高,而转移性肝癌患者由于血清CEA、CA-19-9、CA-15-3等相关肿瘤标记物持续升高,通过CECT、CEMRI检查或穿刺活检病理证实肝内有癌灶。
1.2.1.2 术中:参照CECT或CEMRI图像,于常规超声扫查同一肝区,启动造影模式,经肘部浅静脉快速团注配制好的六氟化硫微泡混悬液2.4 ml,同时启动计时器,随后用5m l 0.9%氯化钠溶液快速冲管,连续实时观察并记录造影过程6 min:造影过程分为动脉相(10~30 s)、门脉相(31~120 s)和延迟相(121~360 s)[3]。根据CEUS显示的病灶浸润范围和形态迅速确定最佳穿刺路径及布针方案,引导射频电极针进行消融治疗(图1),消融范围为覆盖整个瘤体并超出瘤体0.5~1.0 cm。根据患者全身状况及消融范围大小,采用连续硬膜外麻醉或局部麻醉。治疗过程中均给予心功能监测及低流量氧气吸入。
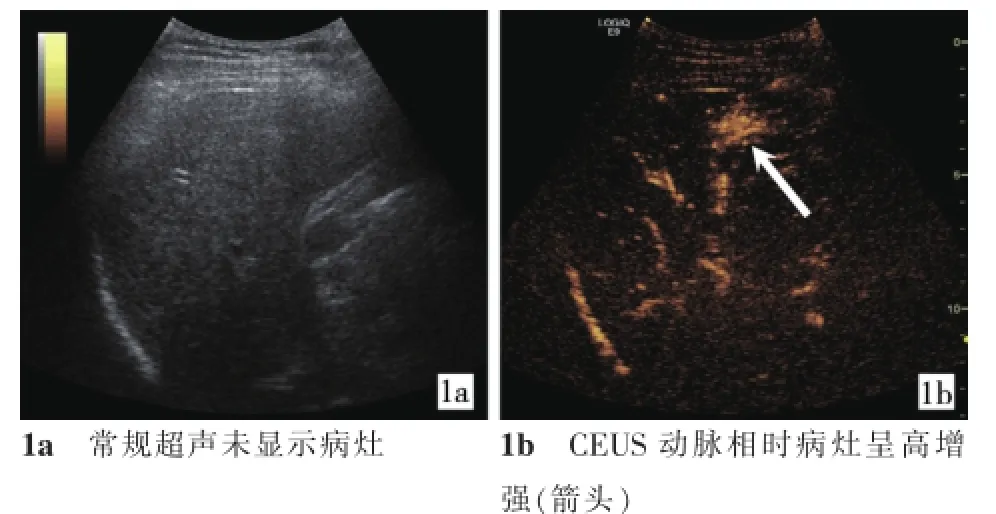
图1 常规超声和CEUS对比
1.2.1.3 术后:RFA后30 min对病灶行CEUS检查;治疗后1个月行CEUS、CECT和相关血清肿瘤标记物检查。
1.2.2 疗效评价CEUS或CECT检查,消融瘤体内完全无增强,即无血流灌注,判定为完全消融;而消融瘤体内于动脉期出现不规则的增强、门脉期消退则判定为不完全消融[4]。
1.3 统计学分析
2 结果
参照CECT或CEMRI图像,所有27例患者31个病灶在CEUS时均成功检出,病灶检出率为100%(31/31),表现为动脉相时呈不同程度的高增强,门脉相时呈低增强。HCC与转移性肝癌病灶CEUS的始增时间、达峰时间和对比剂持续时间的比较结果见表1。
表1 HCC与转移性肝癌CEUS参数比较(±s)

表1 HCC与转移性肝癌CEUS参数比较(±s)
病灶类型病灶数量/个始增时间/s达峰时间/s对比剂持续时间/s HCC 11 14.52±4.63 51.32±19.47 295.38±41.59转移性肝癌20 13.69±4.15 47.51±17.95 162.76±35.84 t值0.52 0.55 0.89 P值0.61 0.59<0.01
即刻对27例31个病灶CEUS引导下行RFA治疗,术后30 min再行CEUS,29个消融灶内无增强,即无血流灌注,判定为完全消融;2个消融灶内于动脉期局部出现不规则的高增强,门脉期呈低增强,判定为不完全消融,随即行第2次RFA治疗,手术均顺利进行。RFA过程中所有患者出现不同程度的右上腹不适,腹痛等症状,可耐受,治疗结束后自行缓解。2例患者于消融过程中出现心率减慢至40~45次/min,心电图示窦性心动过缓。立即暂停治疗,并给予硫酸阿托品0.5 mg静脉推注,6~10 min后心率恢复正常,继续完成治疗。8例患者术后24 h内出现发热,体温为37~38.2℃。无一例出现腹腔出血、胃肠道穿孔、胆漏等严重并发症。
术后1个月复查CEUS、CECT和血清肿瘤标记物AFP、CEA、CA-19-9、CA-15-3。CEUS和CECT均提示消融灶内无增强,即无血流灌注,病灶完全坏死。11例HCC患者血清AFP均降至正常范围,而转移性肝癌患者血清CEA、CA-19-9、CA-15-3水平均较术前明显降低(表2)。
表2 16例转移性肝癌患者RFA前后血清肿瘤标记物水平比较(±s)

表2 16例转移性肝癌患者RFA前后血清肿瘤标记物水平比较(±s)
时间CEA/(μg/L)CA-199/(u/ml)CA-153/(u/m l)术前69.28±51.43 259.48±83.73 42.65±27.51术后1个月8.53±4.31 32.34±24.59 20.57±13.64 t值4.71 10.41 2.88 P值<0.01<0.01<0.01
3 讨论
RFA广泛应用于治疗各种实体肿瘤,且取得了一定的疗效[5]。肝癌的RFA已成为治疗肝癌的一项重要的局部消融技术,其治疗小肝癌的疗效可与传统的外科手术相当[6-7]。超声引导下RFA可以清晰地观察肿瘤的形态、位置和毗邻结构,并实时监控消融治疗过程,进一步完善肿瘤的原位消融和病理性完全消融[8]。但因各种原因如肝硬化背景、脂肪肝和治疗等使部分病灶与肝脏呈等回声或边界不清晰导致常规二维超声下肿瘤无法显示,从而影响RFA治疗。所以,当常规超声结果与临床相关指标及症状不相符时,应考虑可能存在等回声肝癌,需同时做其他影像学检查,以及时明确诊断。
研究表明,CEUS在肝脏肿瘤的发现和定性方面具有极高的灵敏度和特异度[9-10]。本组在常规超声未检出的27例患者31个病灶在CEUS时均成功检出。CEUS实时引导的肝癌RFA治疗,不仅可清晰地显示病灶的部位、边界及周边结构,更可实时显示动态穿刺全程,提高穿刺准确性和安全性,减少RFA治疗的并发症。本组31个病灶均顺利行RFA治疗,无一例出现腹腔出血、胃肠道穿孔、胆漏等严重并发症。其中2例患者在治疗过程中出现心率减慢,分析其原因为RFA治疗刺激导致迷走神经兴奋过度,神经末梢释放大量乙酰胆碱与M受体结合,从而导致心率下降,给予阿托品0.5 mg静脉推注后心率恢复。故建议在治疗过程中,应全程使用心功能监测,以及时发现患者基本生命体征的变化。
准确评价肿瘤是否完全消融是肝癌RFA治疗成功与否的关键。常规超声在肝癌RFA后多表现为肿瘤边界不清,难以区分凝固性坏死肿瘤的范围,在RFA术后疗效的评价上具有一定的局限性[11]。因此,临床上多采用CECT或CEMRI评价肝癌RFA治疗疗效,但操作过程非常复杂,并不适合即刻床旁检查,也不宜短期内反复检查,且RFA治疗后短期内肿瘤周边微血管通透性增高,CECT或CEMRI对比剂可渗入周围组织,从而造成假像。随着CEUS技术及对比剂的发展,CEUS能动态实时地观察病灶内的血流灌注情况,客观地反映肿瘤治疗前后血流动力学变化,准确判断RFA治疗后病灶的灭活情况[12],及时对病灶残留部分进行补充治疗,以达到完全消融。完全消融表现为CEUS各时相消融瘤体内完全无增强,即无血流灌注;不完全消融多表现为消融瘤体内于CEUS动脉期出现不规则的快速增强,而门脉期消退。本组病例治疗后30 min,2个消融灶经CEUS判定为不完全消融,随即行第2次RFA治疗。术后1个月复查,CEUS和CECT均提示31个消融灶内无增强,即无血流灌注,病灶完全坏死。
综上所述,CEUS检查可在等回声肝癌RFA治疗前清晰显示病灶的实际大小、浸润范围、毗邻关系等;在术中实时引导治疗过程,提高穿刺准确率;术后即刻判断肿瘤消融程度,指导残留病灶的补充治疗。
[1]Casaril A,Abu Hilal M,Harb A,et al.The safety of radiofrequency thermal ablation in the treatment of liver malignancies[J].Eur JSurg Oncol,2008,34:668-672.
[2]刘文英,严昆,尹珊珊,等.超声造影、二维超声及增强CT检出肝转移癌的价值比较[J].中华超声影像学杂志,2012,21:401-404.
[3]Claudon M,Cosgrove D,Albrecht T,etal.Guidelines and good clinical practice recommendations for contrast enhanced ultrasound(CEUS)-update 2008[J].Ultraschall Med,2008,29:28-44.
[4]徐作峰,徐辉雄,吕明德,等.超声造影评估肝癌消融局部疗效价值的研究[J].中国超声医学杂志,2007,23:284-286.
[5]Shah DR,Green S,Elliot A,et al.Current oncologic applications of radiofrequency ablation therapies[J].World J Gastrointest Oncol,2013,5:71-80.
[6]Rampone B,Schiavone B,Confuorto G.Currentmanagement of hepatocellular cancer[J].Curr Oncol Rep,2010,12:186-192.
[7]Reuter NP,Woodall CE,Scoggins CR,et al.Radiofrequency ablation vs.resection for hepatic colorectal metastasis:therapeutically equivalent?[J].JGastrointest Surg,2009,13:486-491.
[8]孙文兵.重视病理性完全消融提高肝癌射频消融疗效[J].中华肝胆外科杂志,2011,17:182-185.
[9]陈敏华,戴莹,严昆,等.超声造影对肝硬化合并小肝癌的早期诊断价值[J].中华超声影像学杂志,2005,14:116-120.
[10]Nicolau C,CataláV,Vilana R,et al.Evaluation of hepatocellular carcinoma using SonoVue,a second Generation ultrasound contrastagent:correlation with cellular differentiation[J].Eur Radiol,2004,14:1092-1099.
[11]Chen MH,YangW,Yan K,etal.The role of contrast-enhanced ultrasound in planning treatment protocols for hepatocellular carcinoma before radiofrequency ablation[J].Clin Radiol,2007,62:752-760.
[12]王俊玲,郑慕白,李志平,等.超声造影对肝肿瘤微波局部消融治疗早期疗效评估的临床价值研究[J].中国超声医学杂志,2010,26:1102-1105.
The clinical application of contrast-enhanced ultrasound-guided radiofrequency ab lation in treating iso-echo liver cancer
WENG Gao-long,HUANG Jian-guo,CHU Dan,MEI Li-li,LU Zhi-hua,ZHANG Xin-hua.Department of Ultrasonography,Hubei Provincial Cancer Hospital,Wuhan,Hubei Province 430079,China
HUANG Jian-guo,E-mail:2004huangjianguo@163.com
ObjectiveTo investigate the detection rate of contrast-enhanced ultrasound(CEUS)for iso-echo liver cancers,and to evaluate the application of CEUS in treating iso-echo liver cancers with radiofrequency ablation(RFA).M ethods A total of 27 patients with liver cancers(31 lesions in total)were enrolled in this study.Of the 27 patients,hepatocellular carcinoma(HCC)was seen in 11(11 lesions)and hepatic metastasis in 16(20 lesions).In all patients the diagnosis was detected by contrast-enhanced CT or contrast-enhanced MRIand was clinically confirmed.Under real-time CEUSguidance,RFA was carried out for all the 31 lesions.The ablated extentwas evaluated by CEUS,and CEUS findingswere used to guide the further treatment.Results All 31 lesions were detected by CEUS and were treated with RFA.No serious comp lications occurred after RFA.Both CEUS and CECT performed one month after RFA showed that complete tumor necrosis was seen in all the 31 lesions.After RFA the serum AFP levels in all 11 HCC patients fell to normal range,and the serum CEA,CA-199 as well as CA-153 levels in patients with hepatic metastasis decreased significantly(P<0.01).Conclusion CEUS canmarkedly increase the detection rate of iso-echo liver cancers.Besides,CEUS plays an important role in guiding the performance of RFA for iso-echo liver lesions.(J Intervent Radiol,2014,23:922-925)
R735.7
B
1008-794X(2014)-10-0922-04
2014-02-17)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.10.021
430079武汉湖北省肿瘤医院超声影像科(翁高龙、黄建国、褚丹、梅丽丽、卢志华),微创介入科(张新华)
黄建国E-mail:2004huangjianguo@163.com