经皮肝穿金属支架植入治疗恶性肝门部胆道梗阻30天病死率危险因素分析
2014-06-09李明武武文彬殷占新韩国宏
李明武,武文彬,殷占新,韩国宏
·非血管介入Non-vascular intervention·
经皮肝穿金属支架植入治疗恶性肝门部胆道梗阻30天病死率危险因素分析
李明武,武文彬,殷占新,韩国宏
目的分析经皮肝穿胆道支架植入(PTBS)治疗恶性肝门部梗阻30 d病死率的危险因素。方法纳入由胆管癌和胆囊癌所致恶性肝门部梗阻的连续性患者159例。应用单因素和多因素分析对30个潜在的相关危险因素进行分析。对危险因素先行单因素的二元Logistic回归分析,单因素分析中P<0.10的自变量进入多因素分析。结果PTBS术后30 d病死率为9.4%。单因素的分析结果显示30个潜在相关危险因素中:6个为具有统计学意义的危险因素:WBC(OR=1.224,95%CI[1.07~1.44],P<0.01),INR(OR=78.75,95%CI[5.02~1 235.70,P<0.01),PT(OR=1.55,95%CI[1.18~2.04],P<0.01),BUN(OR=1.19,95%CI[1.02~1.38],P<0.05),CRE(OR=1.02,95%CI[1.00~1.04],P<0.1),淋巴结转移(OR=0.334,95%CI[0.105~1.131],P<0.1)。多因素分析具有统计学意义的危险因素:WBC(OR=1.19,95%CI[1.026~1.380],P<0.05),INR(OR=151.5,95%CI[5.48.13~5 440.7],P<0.01),CRE(OR=1.025,95%CI[1.002~1.048],P<0.05)。结论PTBS是一种有效、安全的治疗恶性肝门部梗阻的姑息方法。术前应采取积极措施改善肝、肾功能,控制术前感染以降低病死率。
恶性肝门部梗阻;经皮胆道支架植入;病死率;危险因素
恶性肝门部梗阻是指梗阻水平高于胆囊管和肝总管汇合口的胆道梗阻[1]。经皮肝穿胆道支架植入术(percutaneous transhepatic biliary stent,PTBS)治疗肝门部梗阻性黄疸的姑息性治疗方法已得到广泛应用。PTBS术后30 d病死率为8.2%~36%[2-3]。本文旨在通过多因素分析评估PTBS治疗恶性肝门部梗阻30 d病死率的危险因素,以预防和降低术后30 d病死率。
1 材料与方法
1.1 临床资料
研究纳入2010年1月—2013年6月间恶性肝门部梗阻行PTBS的患者共159例,其中胆管癌98例、胆囊癌61例;男96例,女63例;年龄37~90岁,平均64岁。黄疸均为肿瘤直接侵犯或压迫胆管所致。
1.2 方法
1.2.1 金属支架植入所有患者先在B超室用18 G穿刺针经皮穿刺左或(和)右肝内胆管,穿中靶胆管后置入0.035英寸的短导丝及5 F血管鞘内鞘。然后将患者推入介入室,根据术中造影情况确定行一步法或者二步法金属支架植入,对于肝内胆管解剖结构不清晰,合并术前胆管炎、胆管壁水肿的无法准确植入支架的患者先行内外引流。患者一般情况尚好,肝内胆管解剖结构清晰则行一步法支架植入。支架植入术后留置5 F Cobra导管以备术后造影,观察支架扩张及通畅情况。患者术前24 h内及术后常规经静脉给予抗生素预防感染。
1.2.2 定义30 d病死率定义为:PTBS术后30 d内患者发生死亡的比率。成功支架植入定义为:支架植入术后造影剂和胆汁能够顺利通过支架进入肠道。
1.2.3 资料收集
1.2.3.1 一般资料:年龄、性别、病史[糖尿病、手术或经内镜逆行胰胆管造影术(ERCP)史、肝硬化等]、肝功能(Child-Pugh评分、分级)、黄疸距离手术的时间、术前胆管炎、手术、影像资料(CT和MRI)、Bismuth分型。
1.2.3.2 术前实验室检查指标:红细胞(RBC)、血红蛋白(Hb)、白细胞计数(WBC)、血小板(PLT)、凝血机制、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(TBIL)、直接胆红素(DBIL)、白蛋白、血尿素氮(BUN)、肌酐(CRE)。
1.2.3.3 随访内容:包括患者一般情况、是否有发热、白细胞升高、黄疸加重和(或)上腹部疼痛、肺部感染、感染性休克、呕血等症状。患者再次入:及继续治疗的详细情况。
1.3 统计学分析
PTBS术后30 d病死率危险因素的单因素和多因素分析采用SPSS16.0,将基线和干预的变量值输入SPSS数据编辑器,建立数据库。对30个潜在的危险因素先行单因素的二元Logistic回归分析。当单因素分析中P<0.10的自变量进入多因素分析;在多因素分析中使用双侧性检验,P<0.05被认为差异有统计学意义。
2 结果
2.1 PTBS术后30 d病死率
PTBS术后30 d病死率为9.4%,其中4例PTBS术后20~30 d肝肾功能衰竭死亡;2例支架植入术后2 d急性肾衰竭,尽管有1例患者随后又行内外引流术,仍然于第4天死亡;5例PTBS术后肺部感染、呼吸功能差导致死亡;1例支架植入术后心肺功能不良伴感染性休克于术后第6天死亡;1例术后长期卧床,突然呕血导致死亡;1例术后呼吸衰竭伴肝肾综合征、胆道出血、肺部感染;1例术后伴发肠梗阻、腹水导致死亡。
2.2 单因素、多因素分析
PTBS术后30 d死亡的30个术前潜在危险因素中,单因素分析显示6个因素具有统计学意义:WBC(OR=1.224,95%CI[1.07~1.44],P<0.01),INR(OR=78.75,95%CI[5.02~1 235.7,P<0.01),PT(OR=1.55,95%CI[1.18~2.04],P<0.01);BUN(OR=1.19,95%CI[1.02~1.38],P<0.05),CRE(OR=1.02,95%CI[1.000~1.04],P<0.1),淋巴结转移(OR=0.334,95%CI[0.105~1.131],P<0.1)。在进行多因素logistic分析时,由于PT和INR,BUN与CER可能存在自变量共线性,因而只选择了INR和CER 2个影响因素较高,影响PTBS术后30 d病死率的代表因素。对4个因素进行多因素分析显示3个因素具有统计学意义:WBC(OR=1.19,95%CI[1.026~1.38],P<0.05),INR(OR=151.51,95%CI[3.13~5 440.7],P<0.05),CRE(OR=1.025,95%CI[1.006~1.06],P<0.05)(表1)。
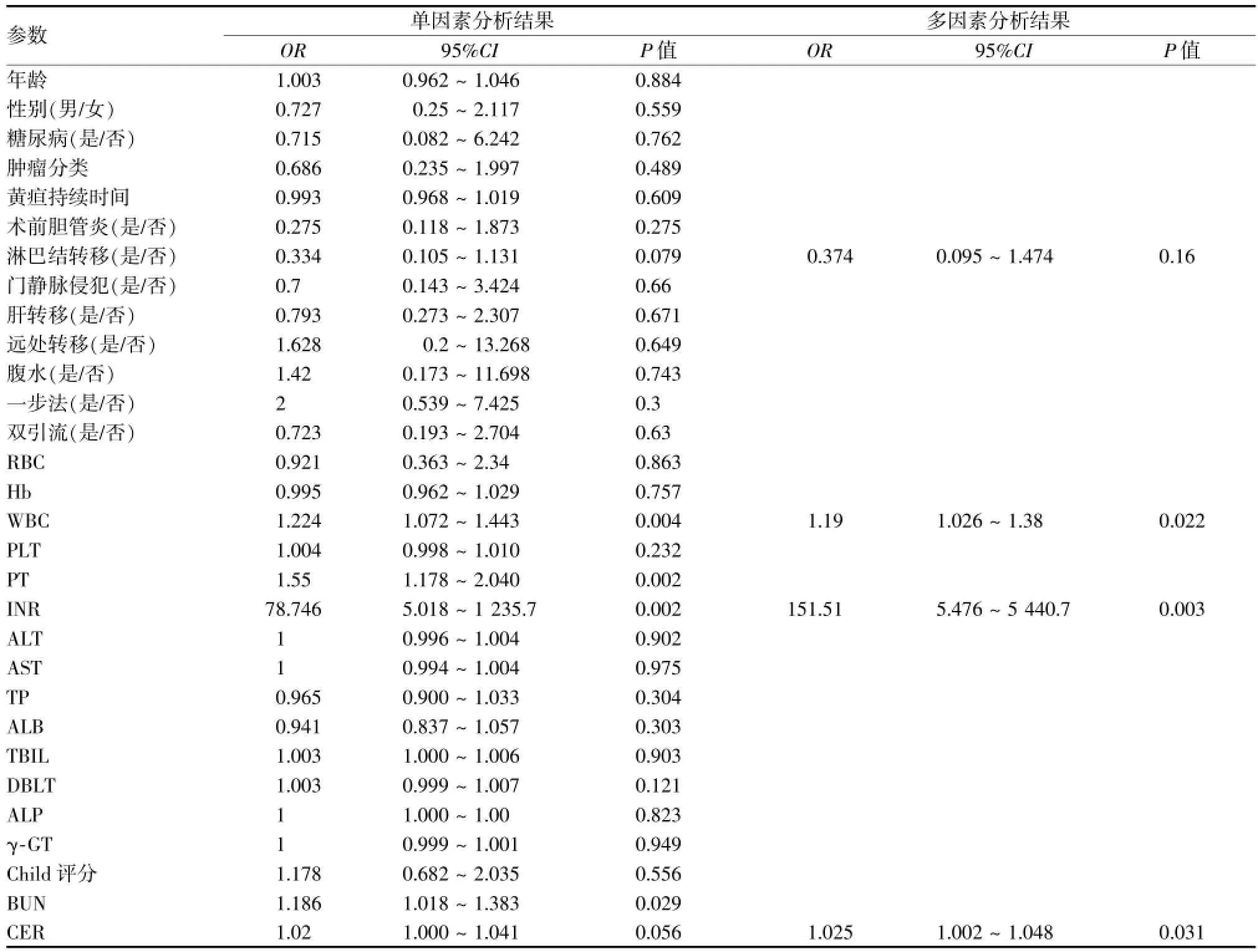
表1 30天病死率的单因素和多因素分析结果
3 讨论
恶性肝门部梗阻的预后不佳,无法手术切除或者有远处转移的患者中位生存期大约6~11.3个月[3-5]。虽然根治性切除是治愈和延长恶性肝门部梗阻生存的唯一途径,然而只有10%~30%患者能行根治性切除[6-8]。姑息性治疗成为恶性肝门部梗阻的重要治疗手段,其主要目标是减轻黄疸症状、提高生活质量、延长生存期,也为其后的化疗和放疗提供机会。尽管肝门部胆管癌的亚太共识[9]和欧洲内镜学会的支架植入指南[10]对恶性肝门部梗阻预生存期大于3个月的患者推荐金属支架植入,但是对PTBS术后30 d病死率的高危因素及如何预防和降低其发生没有做出明确的推荐。本组病例的30 d病死率在9.4%,稍低于既往研究[2-3,11]。多因素分析显示:INR值延长、血肌酐清除率下降、术前白细胞增高是PTBS术后30 d病死率的独立危险因素。
本研究的单变量和多变量分析均显示患者基线的INR值延长、血肌酐清除率下降是PTBS术后30 d病死率的独立危险因素。本组中6例患者因肝肾功能衰竭、2例并发了急性肾衰竭死亡。多因素分析显示INR延长的患者30 d病死率比正常增加151倍。由于胆道梗阻使肠道内缺乏胆汁酸、脂溶性维生素K的吸收障碍,再加上本身肝细胞的损坏,从而使凝血因子生成减少,导致凝血功能的障碍。在患者本身具有凝血机制异常的情况下,同时伴有高胆红素血症会显著降低肝脏的储备功能,致使支架植入术后30 d死亡危险增高。此外,梗阻性黄疸导致肾脏的血流动力学改变、肾脏血流重新分布和内毒素所致的肾交感神经兴奋性增高、激活肾素-血管紧张素系统使肾小管和肾皮质的坏死,患者可出现不同程度的肾功能障碍。鉴于此,应当对肝、肾功能不全的患者进行充分的术前准备,对于高危患者可行术后透析治疗。
本组6例患者术后并发肺部感染、1例感染性休克、呼吸衰竭致PTBS术后30 d内死亡。PTBS术后患者并发肺部感染导致病情控制非常棘手。梗阻性黄疸对辅助性T细胞的分化、增殖行抑制状态。机体本身处于一种低防御状态下,再加上外源性感染的侵袭使病情复杂化。
术前感染也是术后30 d病死率的独立危险因素。PTBS术后30 d内死亡的15例患者中,5例术前存在明显的白细胞增高,但是术前的胆管炎无论在单因素、多因素分析均不是30 d病死率的高危因素,可能和PTBS术后胆道及时解压、胆道感染症状得到控制有关。这项结果提示:梗阻性黄疸患者合并其他感染更应引起关注。
此外,1例术后伴发肠梗阻、腹水导致死亡。对于PTBS术后发生肠梗阻的患者及时行胃肠加压、灌肠治疗以保持肠道通畅。
Tapping等[12]认为,糖尿病是恶性梗阻性黄疸患者行胆道引流术后30 d病死率的高危因素,但是在本研究中糖尿病不是30 d病死率的高危因素。本组患者中有8例患者伴有糖尿病,仅有1例患者术后伴发肺部感染于支架植入术后16 d死亡。多项研究证实有效引流是患者生存的保护因素[5-6],在本组患者中71.6%患者接受了双支架引流,其中3例患者还行3枚支架进行引流。Vienne等[13]研究结果表明:引流>50%正常肝实质的体积能让患者的生存获益。
总之,经过多因素的Logestic回归分析发现:INR值延长、血肌酐清除率下降、术前感染是30 d病死率的独立危险因素。术前应采取更多积极的措施调整肝肾功能、控制感染、提高引流的有效性,以减低PBTS术后恶性肝门部梗阻的30 d病死率。
[1]Covey AM,Brown KT.Percutaneous transhepatic biliary drainage[J].Tech Vasc Interv Radiol,2008,11:14-20.
[2]钱晓军,金文辉,戴定可,等.经皮肝穿胆汁引流治疗肝门胆管癌[J].介入放射学杂志,2007,16:669-672.
[3]Brountzos EN,Ptochis N,Panagiotou I,et al.A survival analysis of patients with malignant biliary strictures treated by percutaneousmetallic stenting[J].Cardiovasc Intervent Radiol,2006,30:66-73.
[4]Valle J,Wasan H,Palmer DH,etal.Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer[J].N Engl JMed,2010,362:1273-1281.
[5]Walter T,Ho CS,Horgan AM,et al.Endoscopic or percutaneous biliary drainage for Klatskin tumors?[J].JVasc Interv Radiol,2013,24:113-121.
[6]Paik WH,Park YS,Hwang JH,et al.Palliative treatmentwith self-expandablemetallic stents in patients with advanced typeⅢorⅣhilar cholangiocarcinoma:a percutaneous versus endoscopic approach[J].Gastrointest Endosc,2009,69:55-62.
[7]Valero V,Cosgrove D,Herman JM,et al.Management of perihilar cholangiocarcinoma in the era of multimodal therapy[J].Expert Rev Gastroenterol Hepatol,2012,6:481-495.
[8]Zhu AX,Hong TS,Hezel AF,et al.Current management of gallbladder carcinoma[J].Oncologist,2010,15:168-181.
[9]Rerknimitr R,Angsuwatcharakon P,Ratanachu-Ek T,et al. Asia-Pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma[J].J Gastroenterol Hepatol,2013,28:593-607.
[10]Dumonceau JM,Tringali A,Blero D,et al.Biliary stenting:indications,choice of stents and results:European Society of Gastrointestinal Endoscopy(ESGE)clinical guideline[J]. Endoscopy,2012,44:277-298.
[11]InalM,Akgül E,Aksungur E,etal.Percutaneous placementof biliary metallic stents in patients with malignant hilar obstruction:unilobar versus bilobar drainage[J].JVasc Interv Radiol,2003,14:1409-1416.
[12]Tapping CR,Byass OR,Cast J.Percutaneous transhepatic biliary drainage(PTBD)with or without stenting—complications,re-stent rate and a new risk stratification score[J].Eur Radiol,2011,21:1948-1955.
[13]Vienne A,Hobeika E,Gouya H,et al.Prediction of drainage effectiveness during endoscopic stenting of malignant hilar strictures:the role of liver volume assessment[J].Gastrointest Endosc,2010,72:728-735.
Risk factor analysis for 30-day mortality in patients with malignant hilar obstruction after percutaneous transhepatic biliary stent dep loyment
LIMing-wu,WU Wen-bing,YIN Zhan-xin,HAN Guo-hong.Department of Interventional Radiology,Xijing Hospital of Digestive Diseases,the Fourth Military Medical University,Xi'an,Shaanxi Province 710032,China
HANGuo-hong,E-mail:guohh@fmmu.edu.cn
ObjectiveTo analyze the risk factors of 30-day mortality in patients with malignant hilar obstruction(MHO)after percutaneous transhepatic biliary metal stent deployment.MethodsOne hundred and fifty-nine consecutive patients with MHO caused by cholangiocarcinoma or gallbladder carcinoma were enrolled in this study.Percutaneous transhepatic biliary stent(PTBS)implantation was carried out in all the patients.Independent predictors for 30-daymortality were evaluated by logistic regression analysis.Covariates that were incorporated into the multivariate analysis were the variables that reached statistical significance(P<0.1)in univariate analysis.Two-tailed,P value of less than 0.05 was considered to be statistically significant.ResultsThe 30-day mortality of patient with MHO after metal stent deployment was 9.4%. Univariate analysis indicated that the differences in WBC(OR=1.224.95%CI[1.07-1.44],P<0.01),INR(OR=78.75,95%CI[5.02-1 235.70],P<0.01),PT(OR=1.55,95%CI[1.18-2.04],P<0.01),BUN(OR=1.19,95%CI[1.02-1.38],P<0.05),CRE(OR=1.02,95%CI[1.000-1.041],P<0.1)and lymph nodesmetastasis(OR=0.334.95%CI[0.105-1.131],P<0.1)were statistically significantly between 30-daymortality group and non-30-daymortality group.Multivariate analysis showed that statistically significant differences in WBC(OR=1.19,95%CI[1.026-1.380],P<0.05),INR(OR=151.5,95%CI[3.13-5 440.7],P<0.05)and CRE(OR=1.025,95%CI[1.002-1.048],P<0.05)also existed between 30-day mortality group and non-30-day mortality group.ConclusionPercutaneous transhepatic biliary metal stent placement is a safe and effectivepalliative treatment for patients with malignant hilar obstruction.Active preoperative measures to improve hepatic and renal functions as well as to control infection are necessary in order to reduce 30-day mortality.(J Intervent Radiol,2014,23:788-791)
malignant hilar obstruction;percutaneous transhepatic biliary stent;30-day mortality;risk factor
R735.7
A
1008-794X(2014)-09-0788-04
2014-01-12)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.09.012
710032西安第四军医大学西京消化病医院介入科
韩国宏E-mail:guohh@fmmu.edu.cn
