闭鞘姜化学成分及药理作用研究进展
2014-06-07陈娜娜贺正山
胡 琳,陈娜娜,贺正山
(1.云南民族大学民族药资源化学国家民委-教育部重点实验室,云南昆明650500;2.昆明翔昊科技有限公司,云南昆明650204)
闭鞘姜化学成分及药理作用研究进展
胡 琳1,陈娜娜1,贺正山2
(1.云南民族大学民族药资源化学国家民委-教育部重点实验室,云南昆明650500;2.昆明翔昊科技有限公司,云南昆明650204)
闭鞘姜(Costus speciosus)为我国和印度民族传统用药.对闭鞘姜不同部位的化学成分及闭鞘姜的药理活性研究概况进行了综述,为该药材的进一步研究和应用提供参考.
闭鞘姜;化学成分;药理作用
闭鞘姜(C.speciosus)为闭鞘姜科(Costaceae)闭鞘姜属植物.产于云南、广东、广西、台湾等省区,不丹、柬埔寨、印度等热带亚洲及澳大利亚也有分布,生于海拔1 700 m以下的林缘、山谷等潮湿地[1].闭鞘姜属有90多种,分布于热带和亚热带,我国有5种(2种特有).闭鞘姜作为观花观叶植物较常见,在中国和印度医药体系中均有应用.闭鞘姜在我国多以根茎入药,名樟柳头、恩倒(意为“具有很强的安神通气效果的药”)、串盘姜、水蕉花等,是傣族、壮族、佤族等多民族常用药,具有利水消肿、清热解毒、除风止痛的功效[2-3].闭鞘姜在印度等国也有很长的药用历史,根用于灼伤、便秘、麻风病、蠕虫感染、皮肤病、发热、哮喘、支气管炎等症[4],根茎用于肺炎、风湿、水肿、黄疸、头痛及泌尿系统疾病,叶用于发热及精神疾病,茎用于发热及痢疾[5].
我们对闭鞘姜的化学成分和药理活性进行综述,为传统民族药材的应用提供参考.
1 化学成分
20世纪70年代发现闭鞘姜根茎是重要医药原料薯蓣皂苷元(diosgenin)的来源之一[6],此后对其各部分的化学成分进行了深入研究.目前从闭鞘姜中分离得到60余个化合物,主要为甾类化合物(异螺甾烷醇类和呋甾烷醇类型的甾体皂苷或甙元),此外还发现闭鞘姜中含有三萜、倍半萜、单萜等萜类化合物、黄酮类化合物、酮类化合物、脂肪酸及其酯等类化学成分.
1.1 甾类化合物
闭鞘姜中的甾类化合物最为丰富的是甾体皂苷(元)类化合物(表1),包括异螺甾烷醇类甾体皂苷(元)和呋甾烷醇类甾体皂苷类成分.据报道,从闭鞘姜中发现了一种名为furostanol glycoside 26-O-β-glucosidase的酶,能够将呋甾烷醇类甾体皂苷转化(异)螺甾烷醇类甾体皂苷[15].此外,闭鞘姜还含有甾醇类化合物,如胡萝卜苷(daucosterin)、β-谷甾醇[12]、5α-stigmast-9(11)-en-3β-ol(lindesterol)[16]等.闭鞘姜中的甾体皂苷类化合物的结构见图1~2.该类化合物主要存在于闭鞘姜的根和茎中,种子中也含有一些具有较多糖基的甾体皂苷,如costusoside I和costusoside J[7].
1.2 萜类化合物
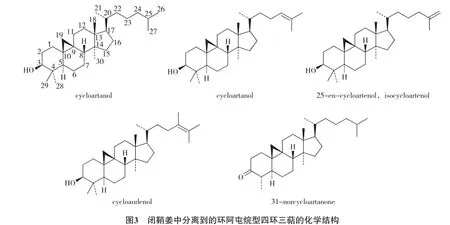
闭鞘姜的地下部分含有阿屯烷型的四环三萜(结构见图3),如环阿屯烷醇(cycloartanol)[10]、25-烯-环阿屯醇(25-en-cycloartenol,isocycloartenol)[10],31-去甲环阿屯烷醇(31-norcycloartanone)[17]、环阿屯烷醇(cycloartanol)[17]、环阿屯烯醇(cycloartenol)[17]、环劳顿醇(cycloaudenol)[17].其根茎得精油成分含有3个单萜成分:松香芹烯(pinocarveol)、樟树脑(cineole)和香芹酚(carvacrol)及1个倍半萜成分:杜松烯(cadinene)[18].而种籽中的萜类物质则是一些混源萜类物质,如α-托可醌(α-tocopherolquinone)[19]、6-methyl dihydrophytylplastoquinone[19]、dihydrophytylplastoquinone[19]和ζ2-生育酚(ζ2-tocopherol)[20].
从闭鞘姜的根中还分离得到2个倍半萜内酯,为木香烃内酯(costunolide)和巴西菊内酯(eremanthin)[21].

表1 闭鞘姜中的甾体皂苷(元)类化合物


1.3 黄酮类化合物
从闭鞘姜的花中分离到3个黄酮类化合物,为芦丁(rutin)、槲皮苷(quercitrin)和槲皮素(quercetin)[22].
1.4 其它
闭鞘姜根茎中含有苯酮类物质如姜黄素(curcumin)和对甲氧基二苯甲酮(p-methoxybenzophenone)[23].此外,闭鞘姜根茎中还分离得到一系列脂肪酮类化合物,如24-羟基三十一烷-27-酮(24-hydroxyhentriacontan-27-one)[24]、24-羟基三十烷-27-酮(24-hydroxytriacontan-26-one)[24]、8-羟基三十烷-25-酮(8-hydroxytriacontan-25-one)[25]等.
闭鞘姜根茎中还含有一些不常见的烷醇和脂肪酸酯.如根茎中含有稀有的14-氧代二十八酸(14-oxooctacosanoic acid)[16]、14-氧代二十三酸(14-oxotricosanoic acid)[16],13-甲基十五烷酸十四酯(tetradecyl 13-methylpentadecanoate)[16]、11-甲基十三烷酸十四酯(tetradecyl 11-methyltridecanoate)[16]、邻苯二甲酸二(2-乙基己基)酯(bis(2-ethylhexyl)phthalate)[26]、3-(4-羟基苯基)-2E-丙烯酸甲酯(methyl-3-(4-hydroxyphenyl)-2E-propenoate)[27]等.
2 药理活性
2.1 对生殖系统的作用
2.1.1 雌激素样活性
闭鞘姜根茎中薯蓣皂苷元与雌激素结构相似,具有与已烯雌酚(stilbestrol)相似的雌激素样活性,能显著增加摘除卵巢的大鼠子宫的重量和糖原浓度,使子宫和阴道产生增生性病变[28].
2.1.2 子宫收缩活性
闭鞘姜根茎的汁液对大鼠、豚鼠、兔、犬和人的离体子宫均有兴奋作用,可增加子宫收缩的基线、振幅及频率,这种活性不被阿托品或血安定(pentolinium)阻断,说明其与毒蕈碱或γ-氨基丁酸受体无关而直接作用于子宫肌.闭鞘姜根茎乙醇提取物(10mg/100mL)增加了非妊娠大鼠离体子宫的自发收缩,节律收缩的幅度和频率也随着基础张力的增加而增加.这种增加子宫收缩力的作用可以被Ⅰ-型钙通道或是肌球蛋白轻链激酶(MLCK)阻断,但不被雌激素受体阻断剂氟维司群fulvestrant阻断.提取物在缺乏细胞外钙时仍可以增加子宫收缩力,这种作用可被肌浆网钙ATP酶(SRCA)阻断而不被氟维司群阻断.因此,闭鞘姜根茎乙醇提取物是通过Ⅰ-型钙通道的钙内流和肌浆网钙的释放而非通过雌激素受体来增加子宫收缩力的[29].
2.2 降糖活性
四氧嘧啶(alloxan)诱导的糖尿病大鼠在经口喂饲闭鞘姜根的乙醇提取物(300,450mg/kg BW)后,其血糖浓度和糖原异生作用下降,糖原生成作用升高,血脂总量、胆固醇和甘油三酯含量降低,肝脏抗氧化酶活性增强(450mg/kg BW剂量时的抗氧化作用比600μg/kg BW格列本脲的还强),提示闭鞘姜根的提取物有降血糖、降血脂和抗氧化的作用,可用于治疗糖尿病及其并发症[30].链脲霉素(streptozotocin)诱导的糖尿病雄性大鼠在经口连续喂饲木香烃内酯(costunolide)30天或巴西菊内酯(eremanthin)60天(剂量均分别为为5,10,20 mg/kg BW)后,血糖浓度均呈剂量依赖性降低.20mg/kg剂量口服给药时,糖化血红蛋白(HbA1c)、血浆总胆固醇、甘油三酯、低密度脂蛋白胆固醇含量均降低,而血浆胰岛素、组织糖原、高密度脂蛋白胆固醇、血浆蛋白含量均升高,血浆酶如天冬氨酸氨基转移酶AST、丙氨酸氨基转移酶SLT、乳酸脱氢酶、碱性磷酸酶ALP、酸性磷酸酶的活性均恢复至正常水平.木香烃内酯可能通过抑制NO合酶的表达而刺激胰岛分泌胰岛素.之后他们对抗氧化作用的研究发现,木香烃内酯和巴西菊内酯连续喂饲60天(剂量均为20 mg/kg BW),可使链脲霉素诱导的糖尿病雄性大鼠的TBARS含量显著下降,还原型谷胱甘肽含量显著升高,与未给药的糖尿病大鼠相比,脑、肝、肾、心脏、胰腺中的超氧化物歧化酶SOD、过氧化氢酶CAT、谷胱甘肽过氧化物酶GPx等酶的活性均显著升高.闭鞘姜根茎的己烷提取物(250 mg/kg BW)及其中主要的活性成分——木香烃内酯和巴西菊内酯使得血糖降低的同时还可以使得组织蛋白、胰腺DNA、血浆胰岛素和血浆C肽水平恢复正常.除己烷提取物外,与对照组相比,闭鞘姜根茎的乙酸乙酯提取物(400mg/kg BW)、甲醇提取物(400mg/kg BW)以及水提物(600mg/kg BW)均可使链脲霉素诱导的糖尿病大鼠的血糖含量显著下降.
2.3 抗炎、解热、镇痛作用
闭鞘姜根茎醇水提取物中的混合皂苷具有与倍他米松(β-methasone)相当的抗炎作用.闭鞘姜根茎乙醇提取物400mg/kg BW剂量给药即可以显著抑制大鼠的棉球肉芽肿形成,800mg/kg BW可以显著抑制角叉菜胶诱导的大鼠足水肿形成.但其解热活性一般,800mg/kg BW剂量时才可以减轻酵母菌诱导的大鼠发热[32].醋酸扭体法显示闭鞘姜根茎水提物和乙醇提取物均有外周镇痛活性,前者75和150mg/kg BW均显著抑制小鼠扭体反应,后者仅150mg/kg BW显著抑制扭体反应.但光辐射热甩尾法显示只有乙醇提取物有中枢镇痛活性,但也远较硫酸吗啡弱[33].
闭鞘姜根的己烷提取物中的木香烃内酯可减少脂多糖(LPS)激活的BV2小神经胶质细胞中的多种神经炎症介质如肿瘤坏死因子TNF-α、白介素IL-1、IL-6、诱导型NO合酶(iNOS)、单核细胞趋化蛋白-1(MCP-1)和环氧合酶(COX-2)的表达,这种抗神经炎症作用是通过抑制NFκB的活化以及MAPK途径的活化(通过诱导MKP-1的生成)实现的[34].
2.4 抗菌活性
闭鞘姜根茎中分离到的methyl-3-(4-hydroxyphenyl)-2E-propenoate可抑制黑曲霉(Aspergillusniger)、枝状枝孢菌(Cladosporiumcladosporioides)、盘长孢状刺盘孢(Colletotrichumgloeosporioides)、弯孢属Curvularia sp.及青霉属Penicillium sp.的病原真菌,新鲜根茎与芒果盘长孢(Gloeospori-ummangiferae)共培养并没有增加该化合物的产量,说明该化合物是一种抗菌成分而不是植物抗毒素[27].闭鞘姜皂苷(四种稀释度——1%、25%、5%、100%)对—黑粉菌属的甘蔗鞭黑粉菌(Ustilagoscitaminea)和核黑粉菌属的缘核黑粉菌(Cintractialimitata)的孢子萌发抑制作用最强,狗牙根黑粉菌(U.cynodontis)次之(1%下与对照相比仅有30%左右的抑制作用),小麦散黑粉菌(U.tritici)最弱(1%下无抑制作用)[35].
2.5 肝脏保护作用
四氯化碳诱导的肝损伤小白鼠在腹腔给药闭鞘姜根茎甲醇提取物(50,100 mg/kg BW)后,血浆肝功指示酶如AST、ALT、ALP及血浆总胆红素和总蛋白均恢复到正常水平,肝组织结构也趋于正常,提示闭鞘姜根茎甲醇提取物具有肝脏保护作用[36].
3 结语
闭鞘姜化学成分的研究表明,闭鞘姜主要药用部位(地下根茎)的化学成分以异螺甾烷醇类和呋甾烷醇类甾体皂苷(元)为主,种子中也含有较多与根茎中相同的甾体皂苷(元)类及甾醇类成分,提示种子也可能具有与根茎相似的药理活性.对于地上部分来说,其花和种子均有研究,但生物量较大的茎叶尚无化学成分报道,值得进一步研究以探求其可能应用价值.
闭鞘姜的现代药理作用研究显示该药材作用广泛,主要有对生殖系统的作用(雌激素样作用、缩宫作用)、抗糖尿病、抗炎、保肝、抑菌等作用.闭鞘姜主要成分薯蓣皂甙(元)具有祛痰、脱敏、抗炎、降脂、抗肿瘤及雌激素样等作用,与该药材传统应用有着密切的关系.药理研究显示了闭鞘姜提取物对糖尿病及其并发症的治疗或改善作用.其不但能够显著降低血糖作用,对如血脂总量、胆固醇及甘油三酯含量等多指标还有明显的改善作用.由于低副作用降糖药在现代社会中有较大的社会意义和应用前景,闭鞘姜在降糖方面的物质基础值和作用特点值得深入研究,以充分挖掘这一民族药材的潜在应用价值.
[1]WU De-lin,LARSEN K.Costaceae[M]//Flora of China 24.北京:科学出版社,2000:320-321.
[2]云南省食品药品监督管理局.云南省中药材标准(第3册·傣族药)[M].昆明:云南科技出版社,2005.
[3]赵国平,戴慎,陈仁寿.中药大辞典:上册[M].2版.上海:上海科学技术出版社,2006:93-94.
[4]ELIZA J,DAISY P,IGNACIMUTHU S,etal.Normo-glycemic and hypolipidemic effect of costunolide isolated from Costus speciosus(Koen ex.Retz.)Sm.in streptozotocininduced diabetic rats[J].Chemico-Biological Interactions,2009,179(2):329-334.
[5]SRIVASTAVA S,SINGH P,MISHRA G,et al.Costus speciosus(Keukand):A review[J].Der Pharmacia Sinica,2011,2(1):118-128.
[6]SARIN Y K,BEDIK L,ATALCK.Costus speciosus rhizome as source of diosgenin[J].Curr Sci,1974,43(18):569-570.
[7]SINGH S B,THAKUR R S.Saponins from the seeds of Costus speciosus[J].Journal of Natural Products,1982,45(6):667-671.
[8]DASGUPTA B,PANDEY V B.A new Indian source of diosgenin(Costus speciosus)[J].Cellular and Molecular Life Sciences,1970,26(5):475-476.
[9]TSCHESCHE R,PANDEY V B.Steroidal saponins of Costus speciosus[J].Phytochemistry,1978,17(10):1781-1782.
[10]乔春峰,李秋文,董辉,等.闭鞘姜属两种植物的化学成分研究[J].中国中药杂志,2002,27(2):123-125.
[11]AGRAWAL PK,JAIN D C,GUPTA R K,etal.Carbon-13 NMR spectroscopy of steroidal sapogenins and steroidal saponins[J].Phytochemistry,1985,24(11):2479-2496.
[12]陈延镛,杨永庆.从闭鞘姜根茎提取薯蓣皂苷元[J].中草药,1981,12(11):505-506.
[13]INOUE K,KOBAYASHI S,NOGUCHI H,et al.Spirostanol and furostanol glycosides of costus speciosus(KOENIG.)SM[J].生药学杂志,1995,49(3):336-339.
[14]SINGH SB,THAKUR R S.Costusoside-Iand costusoside-J,two new furostanol saponins from the seeds of Costus speciosus[J].Phytochemistry,1982,21(4):911-915.
[15]INOUE K,EBIZUKA Y.Purification and characterization of furostanol glycoside 26-O-β-glucosidase from Costus speciosus rhizomes[J].FEBS letters,1996,378(2):157-160.
[16]GUPTA M M,VERMA R K,AKHILA A.Oxo acids and branched fatty acid esters from rhizomes of Costus speciosus[J].Phytochemistry,1986,25(8):1899-1902.
[17]GUPTA M M,SINGH SB,SHUKLA Y N.Investigation of Costus;V.Triterpenes of Costus speciosus roots[J].Planta Med,1988,54(3):268.
[18]SHARMA M L,NIGAM M C,HANDE K L.Essentialoilof Costus speciosus[J].Perfum Essent Oil Rec,1963,54(9):579-580.
[19]MAHMOOD U,SHUKLA Y N,THAKUR R S.Benzoquinones from Costus speciosus seeds[J].Phytochemistry,1984,23(8):1725-1727.
[20]MAHMOOD U,SHUKLA Y N,THAKUR R S.Costus speciosus seeds:a new source of tocopherol[J].Chem Ind,1985,(2):56.
[21]ELIZA J,DAISY P,IGNACIMUTHU S,et al.Antidiabetic and antilipidemic effect of eremanthin from Costus speciosus(Koen.)Sm,in STZ-induced diabetic rats[J].Chem-Biol Interact,2009,182(1):67-72.
[22]CHANG Y Q,TAN SN,YONG JW H,et al.Surfactant-assisted pressurized liquid extraction for determination of flavonoids from Costus speciosus by micellar electrokinetic chromatography[J].J Sep Sci,2011,34(4):462-468.
[23]GAITONDE R V,SAPRE SP.Quantitative standardization of curcumin derived from rhizomes of Curcuma species and Costus specious[J].Indian JNat Prod,1989,5(2):18-19.
[24]GUPTA M M,LAL R N,SHUKLA Y N.Aliphatic hydroxy ketones and diosgenin from Costus speciosus roots[J].Phytochemistry,1981,20(11):2553-2555.
[25]GUPTA M M,LAL R N,SHUKLA Y N.Aliphatic compounds from Costus speciosus roots[J].Phytochemistry,1982,21(1):230-231.
[26]FAROOQUIA H A,SHUKLA Y N.A biologically active phthalic acid ester from Costus speciosus rhizomes[J].Indian Drugs,1987,25(1):37.
[27]BANDARA B M R,HEWAGE C M,KARUNARATNE V,et al.Methyl ester of para-coumaric acid:antifungal principle of the rhizome of Costus speciosus[J].Planta Med,1988,54(5):477-478.
[28]SINGH S,SANYAL A K,BHATTACHARYA SK,etal.Estrogenic activity of saponins from Costus speciosus(Koen)Sm[J].Indian JMed Res,1972,60(2):287-290.
[29]LIJUANW,KUPITTAYANANT P,CHUDAPONGSE N,et al.The effects of wild ginger(Costus speciosus(Koen)Smith)rhizome extractand diosgenin on ratuterine contractions[J].Reprod Sci,2011,18(6):516-524.
[30]BAVARVA JH,NARASIMHACHARYA A V R L.Antihyperglycemic and hypolipidemic effects of Costus speciosus in alloxan induced diabetic rats[J].Phytother Res,2008,22(5):620-626.
[31]ELIZA J,RAJALAKSHMIM,IGNACIMUTHU S J,et al.Normalizing effects of Costus speciosus rhizome crude extracts and its fractions on diabetic complications in STZ-induced diabetic rats[J].Med Chem Res,2011,20(7):1111-1118.
[32]BINNY K,KUMAR S,THOMAS D.Antiinflammatory and antipyretic properties of the rhizome of Costus Speciosus(Koen.)Sm[J].Journal of Basic and Clinical Pharmacy,2010,1(3):177-181.
[33]BHATTACHARYA S,NAGAICH U.Assessment of anti-nociceptive efficacy of Costus Speciosus rhizome in swiss albinomice[J].Journal of Advanced Pharmaceutical Technology&Research,2010,1(1):34-40.
[34]RAYAN N A,BABY N,PITCHAID,et al.Costunolide inhibits proinflammatory cytokines and iNOS in activated murine BV2microglia[J].Front Biosci,Elite Ed,2011,E3(3):1079-1091.
[35]JAITLY N,WADHWANIK,BANERJIR,etal.Effectof saponins on ustilospore germination of smut[J].Curr Sci,1989,58(2):75-76.
[36]BHUYAN B,ZAMAN K.Evaluation of hepatoprotactive activity of rhizomes of Costus speciosus(J.Konig)Smith[J].Pharmacologyonline,2008,(3):119-126.
(责任编辑 王 琳)
Advances in the studies of chemical constituents and pharmacological actions of costus speciosus
HU Lin1,CHEN Na-na1,HE Zheng-shan2
(1.Key Laboratory of Chemistry in Ethnic Medicinal Resources,State Ethnic Affairs Commission and Ministry of Education,Yunnan University of Nationalities,Kunming 650500,China;2.Kunming Xianghao Technology Co.,Ltd.,Kunming 650204,China)
Costus speciosus is a traditional medicinal material in China and India.This paper reviews the advances in the chemical constituents and pharmacological activities of C.speciosus to provide a reference for the further research and application of this medicinal herb.
Costus speciosus;chemical constituents;pharmacological actions
R284.1;R285
:A
:1672-8513(2014)01-0018-06
2013-03-21.
云南省应用基础研究项目(2012F13172).
胡琳(1976-),女,博士,副教授.主要研究方向:民族药用植物的开发利用.
