表面接枝胶原蛋白的聚偏氟乙烯膜的研究
2014-06-04孙俊芬童发钦颜志勇
孙俊芬,童发钦,颜志勇
(1.东华大学a.纤维材料改性国家重点实验室;b.材料科学与工程学院,上海 201620;2.嘉兴学院 材料与纺织工程学院,浙江 嘉兴 314001)
表面接枝胶原蛋白的聚偏氟乙烯膜的研究
孙俊芬1a,1b,童发钦1b,颜志勇2
(1.东华大学a.纤维材料改性国家重点实验室;b.材料科学与工程学院,上海 201620;2.嘉兴学院 材料与纺织工程学院,浙江 嘉兴 314001)
利用低温等离子体技术对聚偏氟乙烯(PVDF)膜表面进行改性,并接枝胶原蛋白,研究了胶原蛋白的质量浓度和接枝时间对膜性能的影响.对接枝后的膜材料进行了水通量、接触角、染色性能方面的测试,并利用傅里叶红外光谱对膜表面结构进行研究.研究结果表明,通过等离子体技术在PVDF膜表面成功接枝了胶原蛋白,提高了膜的亲水性能.
聚偏氟乙烯膜;胶原蛋白;等离子体
聚偏氟乙烯(PVDF)是一种新兴的、综合性能优良的聚合物膜材料,具有较高的力学强度、优良的化学稳定性和突出的介电性能,是制备膜的优选材料[1].PVDF膜自身的强疏水性导致PVDF膜容易被污染、处理水体系过程中阻力大、通量小,必须通过亲水化等改性手段来提高膜的抗污染能力和降低膜运行的动力能耗.在PVDF膜表面接枝亲水性单体或带有亲水性基团的聚合物,可提高膜的亲水性能并赋予其特种功能.胶原蛋白具有良好的物理性能和生物学特性,在医学、生物材料以及食品等领域有着广泛的应用[2].胶原蛋白富含大量氨基酸,且氨基酸含有氨基和羧基等亲水性基团,因此,将胶原蛋白接枝到PVDF膜的表面,可以改善PVDF膜的亲水性和生物相容性.
等离子体改性PVDF膜在国内外得到了广泛的研究.文献[3]将丙烯酸单体和赖氨酸依次接枝在PVDF微滤膜,用来培养神经元细胞,氨基酸中含有较多的亲水性基团,使膜的水通量增大,接触角减小,膜的抗污染能力增强.文献[4]在PVDF膜表面用等离子体接枝氨基硅氧烷基团,制成阴离子交换膜用来电离六价铬离子.文献[5]将等离子体表面改性PVDF膜用于有机化合物水溶液的过滤,经Ar等离子体处理45 s后,PVDF膜水接触角从90°降到70°.
鉴于目前国内外对PVDF膜表面接枝蛋白的研究尚鲜见报道,本文利用氦气等离子体将含有大量亲水性基团的胶原蛋白接枝到PVDF膜表面,使得到的改性PVDF膜具有良好的亲水性能和生物相容性,进而研究接枝胶原蛋白的质量浓度和接枝时间对改性后的PVDF膜性能的影响.
1 实验部分
1.1 实验材料
PVDF平板膜:Millipore IPVH00010,杭州兰堡生物,孔径为0.45μm;胶原蛋白:Mn=3 000 Da,黄骅市天福园生物科技有限公司;高纯氦:上海氯闵气体有限公司;戊二醛溶液(25%),牛血清蛋白(BSA):国药集团化学试剂有限公司.
1.2 实验方法
将PVDF膜裁剪成5 cm×5 cm的小块试样,将试样膜置于冷等离子体处理仪(采用射频电源,电感耦合式电极)工作室中.先将工作室抽真空,然后将氦气充满整个工作室,工作气体的压力为20 Pa.在不同处理时间、处理功率下进行等离子体表面处理.处理后将PVDF膜取出,在室温下迅速将膜浸入质量浓度为25 g/L的胶原蛋白交联溶液中进行接枝反应,60 min后将PVDF膜取出,用蒸馏水充分洗涤、浸泡,直到表面吸附的胶原蛋白溶液清洗干净,最后将膜以湿态保存.
1.3 膜性能的表征
1.3.1 膜水通量的测定
在自制的超滤评价装置上测试水通量.先将膜在0.15 MPa压力下预压45 min,然后将压力调至0.1 MPa,使水通量保持稳定,再按式(1)计算水通量J.

其中:V为透过水的体积,L;A为膜面积,m2;t为时间,h.
1.3.2 膜接触角的测定
将PVDF膜裁剪成1 cm×5 cm的小块试样,置于真空烘箱中,在室温下抽真空12 h,然后进行接触角测定.在温度为(25±2)℃、相对湿度为(65±5)%环境下测试.用Dataphysics公司的OCA 40型视频接触角测量仪测定接触角.液滴量为1μL,每个液滴左右两侧测量角的平均值作为此液滴的接触角测量值.每个样品测量7个不同点,每个测量点的误差范围为±3°,取7次数据平均值作为该样品的接触角.
1.3.3 膜的全反射红外光谱测定
测试前将PVDF膜在烘箱中室温抽真空12 h.采用傅里叶变换衰减全反射红外光谱法(ATRFTIR),使用美国Nicolet公司的Nicolet 8700型傅里叶变换红外光谱仪对PVDF膜和PVDF改性膜进行红外光谱分析.光谱范围为4 000~400 cm-1,精度为4 cm-1,扫描次数为32次.
1.3.4 膜表面染色观察
含有羟基、羧基、氨基等极性基团的物质,可以在酸性条件下染色又可在碱性条件下染色.根据胶原蛋白的化学成分,可以用直接性染料、酸性染料以及活性染料对其进行染色.
用蒸馏水配制质量浓度为0.5 g/L的酸性雅格赛特酱红M-B染料溶液,置于烧杯中.将处理过的PVDF膜裁剪成1.5 cm×2 cm的小块条膜后浸入染料液中,放置2 h.膜充分染色后,取出膜,用蒸馏水洗涤干净,用滤纸吸干水分,然后置于DM750P型偏光显微镜下观察染色膜表面.
2 结果与讨论
2.1 胶原蛋白质量浓度对PVDF膜性能的影响
不同质量浓度的胶原蛋白溶液对PVDF膜水通量和接触角的影响如图1所示.处理条件:等离子体处理时间为90 s,处理功率为50 W,接枝温度为35℃,接枝时间为30 min.

图1 胶原蛋白质量浓度对膜水通量和接触角的影响Fig.1 Effect of collagen mass concentration on pure water flux and contact angle of membranes
由图1可知,在胶原蛋白质量浓度为15 g/L时,PVDF膜的水通量达到最大,为183.3 L/(m2·h);当胶原蛋白质量浓度超过15 g/L时,随着胶原蛋白质量浓度的增大,PVDF膜的水通量逐渐减小.同时,由图1可知,利用胶原蛋白接枝PVDF膜后,膜的接触角明显降低,当胶原蛋白质量浓度为15 g/L时,PVDF膜的水接触角最小,为47.8°.随着胶原蛋白质量浓度的进一步增大,PVDF膜的接触角反而逐渐增大,从47.8°上升到57.5°.因为随着胶原蛋白质量浓度的进一步增大,胶原蛋白的分子链开始相互缠结,阻碍胶原蛋白分子与PVDF膜表面接触,从而使其不能与活性自由基发生反应,导致膜接触角增大,亲水性下降.
图2为PVDF原膜与胶原蛋白的红外光谱图.由图2可知,未经处理的疏水性PVDF原膜的红外谱图在3 400~3 000 cm-1处没有吸收峰,胶原蛋白的红外谱图与文献[6]研究提到的基本一致.由胶原蛋白的红外谱图可以看出,在3 600~3 200 cm-1处(氨基化合物中—OH、—NH2等官能团)有很强的吸收峰,酰胺I谱带— ==C O的伸缩振动在1 661~1 636 cm-1处有较强的吸收峰[7].

图2 PVDF原膜与胶原蛋白的红外光谱图Fig.2 FTIR spectrum of original PVDF membrane and collagen
图3为不同质量浓度的胶原蛋白接枝PVDF膜的红外光谱图.由图3可知,经等离子体处理后,不同质量浓度的胶原蛋白接枝后的PVDF膜的红外谱图在3 600~3 200 cm-1处出现相应的吸收峰.胶原蛋白质量浓度为5 g/L时,在3 600~3 200 cm-1处几乎看不到吸收峰;当胶原蛋白质量浓度为15 g/L时,在3 600~3 200 cm-1处有较强的吸收峰且达到最大;继续增大胶原蛋白的质量浓度,峰值又开始下降.从接枝PVDF膜的谱图可以看出,在等离子体的作用下,PVDF膜表面的活性自由基与空气中的氧气、水分发生反应,从而改善了PVDF膜的疏水性.接枝PVDF膜在3 370 cm-1处的N—H伸缩振动峰和1 647 cm-1处的酰胺I谱带 ==C O的伸缩振动峰较明显,尤其是用15 g/L的胶原蛋白接枝的PVDF膜,从而可以认为在PVDF膜上成功接枝上胶原蛋白.
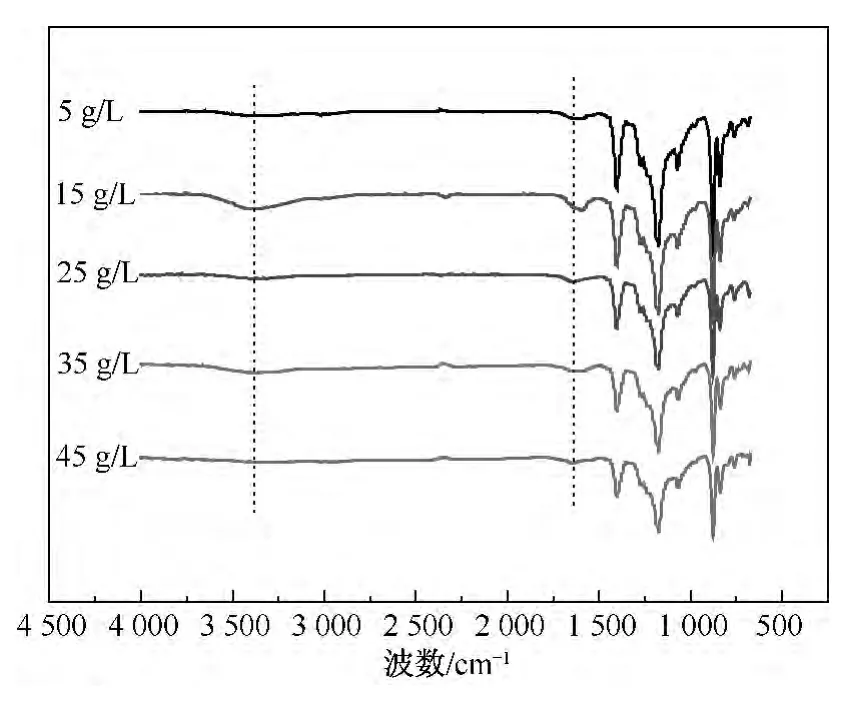
图3 不同质量浓度胶原蛋白接枝PVDF膜的红外光谱图Fig.3 FTIR spectrum of PVDF membranes grafted by collagen with different mass concentration
2.2 接枝时间对PVDF膜性能的影响
接枝胶原蛋白的时间对PVDF膜水通量和接触角的影响如图4所示.处理条件:等离子体处理时间为90 s,处理功率为50 W,接枝胶原蛋白的质量浓度为15 g/L,接枝温度为35℃.由图4可知,接枝胶原蛋白的时间从0.5 h增加到1.0 h,PVDF膜 的 水 通 量 从183.3 L/(m2·h)上 升 到 197.4 L/(m2·h).在接枝时间超过1.0 h之后,PVDF膜的水通量下降并趋于稳定.这是因为PVDF膜表面的活性自由基在接枝1.0 h后基本反应完全,随着接枝时间的进一步增加,接枝反应基本终止.
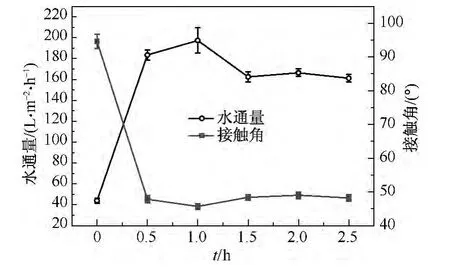
图4 接枝时间对膜水通量和接触角的影响Fig.4 Effect of graft time on pure water flux and contact angle of membranes
由图4还可知,利用胶原蛋白接枝PVDF膜后,膜的接触角明显降低,当接枝时间为1.0 h时,接触角达到最小值,为45.7°,但整体上接枝时间的不同对PVDF膜接触角的影响不大,其他接枝时间制备的膜的接触角在47°左右.
采用光学扫描显微镜分别用4×10和10×10的放大倍数对染色膜表面进行拍照,所得照片如图5所示.膜的等离子体处理时间为90 s,处理功率为50 W,接枝温度为35℃,接枝胶原蛋白的质量浓度为15 g/L,接枝时间为1.0 h.由图5可知,PVDF原膜表面没有任何染色痕迹;而接枝胶原蛋白的PVDF膜表面出现斑点(图5(c)和5(d)),表明PVDF膜表面已经接枝上了胶原蛋白.胶原蛋白分子中含有羧基、氨基等极性基团,用酸性雅格赛特酱红M-B染料对接枝后的膜进行染色,其与胶原蛋白中的极性基团结合,在膜的表面进行染色,而原膜由于没有亲水基团,不与染色剂反应,原膜的表面不发生改变.

图5 染色后的PVDF原膜和接枝胶原蛋白的PVDF膜Fig.5 Dyeing original PVDF membrane and PVDF membrane grafted with collagen
3 结 语
本文利用低温等离子体技术在PVDF膜接枝胶原蛋白,讨论接枝胶原蛋白的质量浓度和接枝时间对PVDF膜性能的影响,得到如下结论:
(1)当胶原蛋白质量浓度为15 g/L时,接枝后的PVDF膜水通量达到最大值183.3 L/(m2·h),接触角达到最小值47.8°;
(2)当接枝时间为1.0 h时,PVDF膜的水通量达到最大值197.4 L/(m2·h),接触角达到最小值45.7°;
(3)通过对PVDF原膜和接枝胶原蛋白的PVDF膜进行染色后发现,表面接枝胶原蛋白的PVDF膜被染色,间接证明了胶原蛋白成功接枝到PVDF膜的表面.
[1]唐广军,孙本惠.聚偏氟乙烯膜的亲水性改性研究进展[J].化工进展,2004,23(5):480-484.
[2]张其清,王彭延,朱明华,等.胶原材料的生物学评价[J].生物医学工程学杂志,1989,6(3):216-218.
[3]YOUNG T H,LU J N,LIN D J,et al.Immobilization of l-lysine on dense and porous poly(vinylidene fluride)surfaces for neuron culture [J].Desalination,2008,234(1/2/3):134-143.
[4]ROUALDES S,KOURDA N,DURAND J,et al.Plasmagrafted PVDF polymers as anion exchange membranes for the electrotransport of Cr(VI)[J].Desalination,2002,146(1/2/3):273-278.
[5]BUONOMENNA M G,LOPEZ L C,FAVIA P,et al.New PVDF membranes:The effect of plasma surface modification on retention in nanofiltration of aqueous solution containing organic compounds [J]. Water Res,2007,41 (19):4309-4316.
[6]SUN H X,ZHANG L,CHAI H,et al.A study of human globulin adsorption capacity of PVDF hollow fiber affinity membranes containing different amino acid ligands[J].Sep Purif Technol,2006,48(3):215-222.
[7]MUYONGA J H,COLE C G B,DUODU K G.Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatine from skins and bones of young and adult Nile perch[J].Food Chem,2004,86(3):325-332.
Study on PVDF Membranes Grafted with Collagen
SUNJun-fen1a,1b,TONGFa-qin1b,YANZhi-yong2
(a.State Key Laboratory for Modification of Chemical Fibers and Polymer Materials;b.College of Materials Science and Engineering,1.Donghua University,Shanghai 201620,China;2.College of Materials and Textile Engineering,Jiaxing University,Jiaxing Zhejiang 314001,China)
Polyvinylidene fluoride(PVDF)membrane was modified by low-temperature plasma technique and grafted with collagen.The ef fects of collagen mass concentration and graft time on membrane properties were studied.The grafted membrane was investigated by pure water flux,contact angle measurement,dyeing property and Fourier transform infrared spectroscopy(FTIR).The results showed that the surface of PVDF membrane was grafted with collagen and the hydrophilic property of membrane was improved by low-temperature plasma technique.
polyvinylidene fluoride membrane;collagen;plasma
TQ 342.25
A
2013-09-21
国家自然科学基金资助项目(51203020);上海市自然科学基金资助项目(11ZR1400500);教育部留学回国人员科研启动基金资助项目;中央高校基本科研业务费专项资金资助项目(2232012D3-32);浙江省高效节能短流程纺织先进加工技术重点科技创新团队资助项目(2012R10012-05)
孙俊芬(1973—),女,内蒙古乌海人,副研究员,博士,研究方向为功能材料.E-mail:junfensun@dhu.edu.cn
1671-0444(2014)03-0249-04
