北极黄河站地区不同基底中真菌的分离培养及初步鉴定
2014-06-01丁慧王能飞臧家业杨晓冉祥滨张波涛
丁慧,王能飞,臧家业,杨晓,冉祥滨,张波涛
(1.青岛大学化学科学与工程学院,山东青岛 260071;2.国家海洋局第一海洋研究所国家海洋局海洋生物活性物质重点实验室,山东青岛 266061)
北极黄河站地区不同基底中真菌的分离培养及初步鉴定
丁慧1,2,王能飞2*,臧家业2,杨晓1,2,冉祥滨2,张波涛1
(1.青岛大学化学科学与工程学院,山东青岛 260071;2.国家海洋局第一海洋研究所国家海洋局海洋生物活性物质重点实验室,山东青岛 266061)
为了探索北极陆域真菌的多样性,进一步揭示其生态学角色,本研究对中国第5次北极科学考察采集自黄河站区附近的24份样品进行了真菌的分离培养及鉴定,样品涂布划线后共分离得到60株真菌,其中腐殖质样品中分离到的真菌种类和数量最多;对选取的28株代表菌株进行了真菌ITS区序列鉴定,结果表明它们分属于4个纲,12个属,分别为散囊菌纲、粪壳菌纲、座囊菌纲和微藻菌纲,其中地丝霉属为优势类群。该结果表明北极地区具有丰富的真菌物种多样性。通过对代表土壤理化性质的测定,探究了真菌多样性和土壤理化参数的相关性,其中有机碳氮及可溶性营养盐含量是影响北极土壤真菌多样性的重要指标。
北极黄河站;真菌多样性;系统进化分析;土壤理化性质
1 引言
常年低温,结冰期长,冰水反复冻融,年降水少,强风,强辐射是极地典型的气候特征。能够适应这种极端环境的微生物成为极地地区的主要生物类群。极地微生物在长期进化过程中,形成了能适应极端环境的独特遗传进化特征和生物代谢途径[1]。极地微生物资源的开发和利用已经成为国际极端微生物学的热点之一,研究多集中在极地嗜冷细菌[2]和功能放线菌的开发与利用[3],而对于极地真菌的研究报道相对较少[4]。
北极区域的微生物多样性研究主要集中在海水-冰这一生态系统中[5—7],对冰川和湖泊中的微生物多样性研究也有报道[8—9]。相比之下,对北极区域土壤微生物的研究较少,对土壤真菌这一特定群落的研究更少。Ma等[10]对格陵兰GISP2冰芯的中的真菌多样性做了研究。Gunde-Cimerman等[11]对北极海冰真菌进行了分离纯化及多样性分析。Miteva等[12]对不同冰期(温和期、冷期、温暖期)格陵兰冰芯中的微生物研究证明冰芯中微生物的结构在一定程度上能反映古气候特征。Singh等[13]调查了斯匹次卑尔根(Spitsbergen)群岛的新奥尔松(Ny-Ålesund)地区土壤中真菌种类和分布情况,并发现了新菌种。Gawas-Sakhalkar等[14]对北极苔藓植物及黏附土壤中的真菌分离鉴定,并对其产淀粉酶、纤维素酶果胶酶等的产酶情况做了研究。Wallenstein[15]的研究表明,同细菌群落一样,北极土壤真菌的群落和多样性呈现季节性变化。这些研究多集中于各自国家的考察站附近,对于中国北极黄河科考站周围真菌的系统调查研究不多,只有那广水等[16]和许丹等[17]对站区附近真菌多样性及产酶活性的报道。极地地区是全球生态环境最为脆弱的地区,近年来随着全球气温变暖和人类在极地区域活动的增加,对极地生态环境产生了影响,了解北极科考站周围真菌多样性,对这些地区的生命活动进行持续的数据积累和系统研究十分必要。
中国北极黄河科学考察站,位于78°55′N、11°56′E的挪威斯匹次卑尔根群岛新奥尔松地区王湾西岸。该地区最冷为2月份,平均气温约-14℃,最暖7月份,平均气温约5℃,年平均气温约为-5.8℃,年平均降水量约400 mm。黄河站周围多苔原和湿地,生长的低等植物主要为苔藓和地衣,高等植物比较少,如发草及少数廖科植物,是研究高纬度北极微生物的理想场所。本研究利用中国第5次北极科学考察期间采集的样品为研究对象,系统分析了该地区不同基底中真菌的种类、数量组成等,并结合土壤理化性质对真菌群落菌落多样性和土壤理化指标的相关性进行了分析,旨在揭示该区域环境中真菌群落的基本特征、分布状况及物种多样性等,以期为进一步了解、开发、利用该地区微生物资源和阐明极地真菌生态学意义提供依据。
2 材料与方法
2.1 样品来源
研究样品来源于中国第5次北极科学考察所取得的黄河站附近部分样品,土壤样品采用无菌铲取表层大约0~5 cm深度的土样,装入无菌密封样品袋中,低温条件下运送回国,于4℃低温冰箱中保存备用,24份样品具体采样时间和站位描述见表1。

表1 样品采集站位Tab.1 Sample collection stations

续表1
2.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):土豆200 g,葡萄糖10 g,琼脂17 g,去离子水1 000 mL,p H自然,115℃高压湿热灭菌30 min,用于涂布和划线。
2.3 真菌分离纯化培养及保种
分别称取1 g左右样品,加入到10 mL无菌水中,震荡混匀后静置于12℃培养箱中过夜后,将样品悬液做梯度稀释,稀释为10-1、10-2、10-3和10-4。将10-3和10-42个梯度分别取100μL涂布于PDA固体培养基上,每个样品做3个平行,将平板放于12℃培养箱中倒置培养。培养约1~2周后,待培养基长出真菌菌落,根据菌落形态、所产色素颜色、干燥性等特征,挑取形态差异较大的真菌将其及时转移至相应的新鲜PDA培养基上划线分离纯化。为了得到纯菌落,分离纯化步骤至少进行3次,纯化后的单菌落,分别在4℃下用相应PDA斜面和-80℃下用25%甘油保种。
2.4 菌株的统计计数及菌落形态观察
统计计数:平板涂布后,从第7天开始统计每个样品长出真菌的数目及菌落形态特征做好记录,直到统计的数目不再发生变化。
菌落形态观察:将平板划线纯化后的菌株接种在新鲜PDA平板上,于12℃倒置培养1~2周,观察记录菌落形态及生长速度,主要包括包括菌落大小(菌落直径大小、边缘是否规整)、菌落颜色(培养基正反面颜色,边缘和中心颜色)、菌落整体隆起形态(丝线状、树根状、绒毛状、地毯状等)和菌丝形态(疏松或紧密、放射状或同心轮纹、裂片状、有无水珠渗出等)。
2.5 南极真菌系统发育分析
2.5.1 真菌总DNA的提取
将平板划线纯化后的真菌培养一段时间后,用接种环刮取新鲜菌丝约50 mg,于研钵中液氮研磨充分,采用真菌DNA小剂量快速提取试剂盒(Omega公司),按照使用说明中的操作手册进行真菌总DNA提取。取5μL总DNA用质量分数为1%的琼脂糖凝胶电泳检测,提取成功的DNA于-20℃冰箱中保存备用。
2.5.2 真菌ITS区PCR扩增
引物序列ITS1∶5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′[18](引物由上海美吉生物公司合成),对真菌总DNA进行ITS区扩增。PCR扩增体系为50μL∶2×Taq PCR Master Mix(康为世纪)25μL,引物各2 μL,模板DNA 5μL,重蒸水16μL。扩增程序为:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环,最后72℃延伸10 min;取5μL PCR扩增产物经质量分数为1%的琼脂糖凝胶电泳检测,4℃保存,之后统一送至中科院海洋所测序。
2.5.3 系统发育树的构建
将测序后的真菌ITS r DNA序列登录GenBank数据库进行Blast对比,与NCBI上已有序列进行相似性比较分析,选取与实验菌株同源性相近的菌株用BioEdit软件的多序列比对排列(Clustalw multiple alignment)进行序列比对,采用Mega5.1软件的邻接法(neighbor-joining method)进行系统发育分析并构建系统发育树。
2.6 土壤理化性质分析
选取有代表性的4份样品,对基本的土壤理化性质:含水率、p H、有机碳、有机氮、可溶出性营养盐(硅盐、磷盐、氮盐)进行测定。其中土壤含水率的测定用烘干法;p H测定参照国标(NY/T 1377-2007)采用电位法用酸度计测定(水土比为2.5∶1);有机碳氮含量的测定采用元素分析仪(EA3000);可溶性营养盐的测定(水土比为5∶1)采用全自动连续流动分析仪(Qu AAtro)。每个样品重复3次,测量结果取平均值[19]。
3 结果
3.1 菌株的分离纯化与形态观察
通过涂布及平板划线培养,从24份样品中共分离获得60株真菌,由肉眼观察培养基中菌落形态可知分离出的北极真菌表面形态不一,主要有绒毛状,同心轮状,棉絮状,还有的呈现发射状;菌落的颜色多样,有白色、黑色、棕色等;部分菌落在生长后期菌体形成孢子层渗出水珠,代表菌落的形态见图1所示。
不同基底分离得到的真菌数目和形态特征见表2,根据菌落形态观察,从每份样品中选取形态颜色大小等特征差异较为明显的真菌做进一步进行分子鉴定,总计测序28株真菌。

表2 样品中分离出的真菌数量及种类Tab.2 The number and species of fungi from different samples
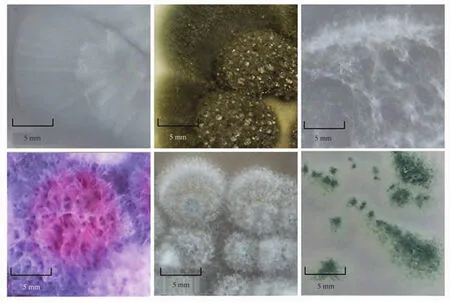
图1 部分代表真菌菌株的菌落形态Fig.1 Morphological character of representative isolated fungal strains
3.2 基因序列测定及系统进化分析
通过进行ITS rDNA的PCR反应,扩增出的基因平均片段大约为650 bp,将这28株真菌的ITS rDNA序列测序结果登录到GenBank数据库进行Blast对比,与NCBI上已有序列进行相似性比较分析,选取同源性最近的菌株用于系统进化树的构建,系统进化树如图2所示。
3.3 土壤理化性质测定结果
选取有代表性的4份样品,对基本的土壤理化性质:含水率、p H、有机碳、有机氮、可溶出性营养盐(硅盐、磷盐、氮盐)进行了测定,结果如表4所示,从表中数据可知,各项理化性质指标存在一定程度的差异。土壤含水率基本都在10%~20%之间,只有S岛蓼科根际土的含水率比较高为59.96%;p H酸碱性不一,在6.5~8.5之间波动;有机碳氮的含量大都比较低,其中S岛蓼科根际土的含量相对其他样品要高出许多;可溶出态营养盐含量也比较少。总体而言,该地区土壤中营养成分比较贫瘠。
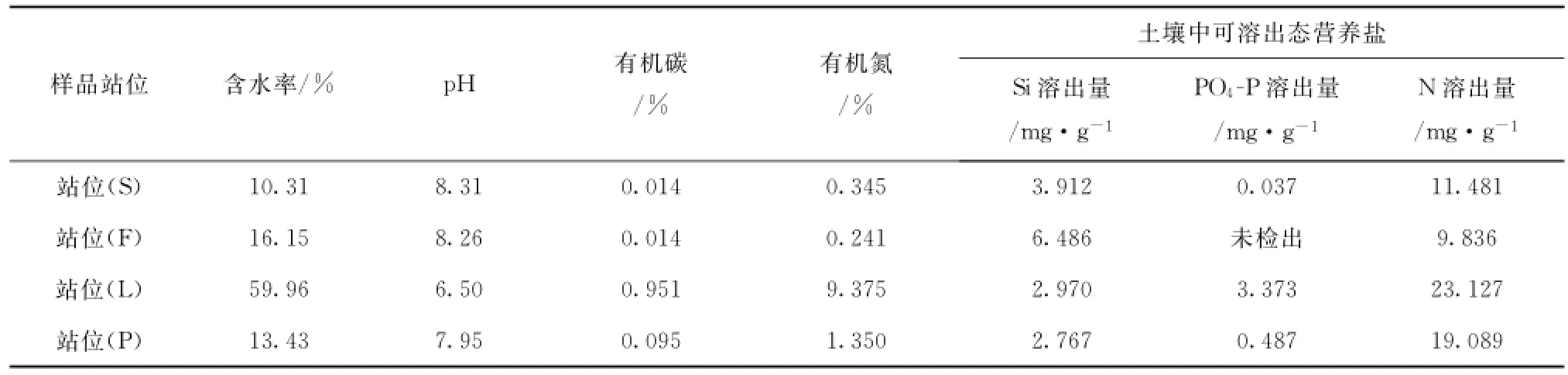
表4 不同地区样品理化性质Tab.4 Basic physicochemical properties of samples at different sites

图2 根据真菌ITS基因序列构建菌株系统进化树。进化距离的计算采用Kimura双参数计算模型;树的拓扑形状采用neighbour-joining方法构建;分枝上的数字为1 000次bootstrap分析所得的值;线段0.05代表0.05进化距离;括号内数字为序列的登录号;粗体字为本研究中得到的序列Fig.2 Phylogenetic trees of fungi ITS sequences.The numbers at the nodes indicate the bootstrap values based on neighbourjoining analyses of 1000 data sets,brackets are GenBan K accession number
4 讨论
北极不同基质所处的生态环境大都不同,导致真菌的数目和种类也有所差异。本研究对北极黄河站区附近的不同基底采样点的真菌进行了分离培养,对菌落在固体培养基上的形态进行了描述,并根据ITS区基因序列对菌株进行了分子生物学鉴定。本研究结果表明,北极不同基质中大部分都有可培养真菌的分布,北极地区的真菌已经适应了当地残酷的生存环境。
新奥尔松地区气候季节性差异比较大,周围多苔原和湿地,生长的动植物种类比较简单,是研究高纬度北极微生物的理想场所,法国、印度、英国等国家都在此建立考察站。现有的对北极真菌的报道,Singh等[13]从斯匹次卑尔根群岛的新奥尔松地区土壤中分离出30株真菌,研究显示真菌的数量0.5×104~2.0×105g-1。通过形态学分类及序列分析鉴定为18个属的19个物种,被孢霉属Mortierella占主导地位,其中4株为首次分离自北极土壤的真菌。Gawas-Sakhalkar和Singh[14]从北极苔藓植物及粘附土壤中分离出46株微真菌,分属于12个属的20个种,其中7株为新发现的种,并对其产淀粉酶、纤维素酶、果胶酶等的产酶情况做了研究。许丹等[17]采用多种培养基对新奥尔松地区土壤的真菌进行分离纯化,获得真菌65株,18S rDNA序列的系统发育多样性表明,65株真菌多样性较高,分属25个属,其中数量上最多的是青霉属Penicillium,其次为丛赤壳属Nectria和节枝孢属Articulospora,并筛选出β-葡萄糖苷酶活性菌株28株。那广水等[16]从北极黄河站2006年考察采集土壤样本中共分离出14株真菌,对菌株进行了抗菌、抗肿瘤活性菌株的筛选,但是未对其进行种属鉴定。上述研究报道表明,北极地区具有较高的真菌多样性,并且菌株具有潜在多种酶活表现。
本研究从24份不同基质的样品中共分离培养得到60株真菌,通过ITS rDNA序列分析表明它们分属于4个纲,12个属,分别为散囊菌纲、粪壳菌纲、座囊菌纲和微藻菌纲。结果显示该地区的优势类群为地丝霉属Geomyces,共23株,占菌株总数目的38.33%,分布于12个站位;其次为被孢霉属Mortierella,共15株,占菌株总数目的25.00%,分布于5个站位,本研究的结果和上述文献存在一定的差异,这可能与采样地点、培养方法等不同有关,但是主要的真菌类群基本是一致的。本研究丰富了对黄河站附近地区陆域真菌多样性和优势菌群的认识。
此外,对南北极的微生物研究中,有研究者发现两极地区有许多相同或者相近的微生物资源[20]。我们的实验发现,许多经测序的代表真菌菌株与来源于南极土壤中的参比菌株具有很高的相似性,有的可达100%,也在一定程度上论证了南北极微生物的部分同源性。
土壤理化性质的差异会影响微生物群落的多样性,文章通过对代表样品的主要土壤理化性质的测定,结合不同样品中真菌分布的种类和数目来分析真菌多样性和土壤理化指标的相关性。测定结果表明各项理化性质指标对真菌的多样性都有一定程度的影响,在土壤p H接近中性的条件下,有机碳氮及可溶性营养盐含量越高,可培养性真菌的分布越广。对于土壤理化性质与整个微生物群落多样性的相关性还需要结合不依赖培养的分子生物学方法如高通量测序技术进行深入分析。
在极地地区,真菌是重要的初级生产者之一,在生态系统中发挥着重要的作用。相对于极地陆域细菌,目前对于极地真菌的研究较少,本文对中国北极黄河站附近24个站位的样品中可培养真菌的多样性以及典型代表土壤理化性质做了初步探究,为进一步了解该地区的微生物多样性以及深入探求土壤理化指标对生物多样性的响应机理提供了参考。
[1] 何剑锋,崔世开,张芳,等.北冰洋海域微食物环研究进展[J].生态学报,2011,31(23):7279-7286.
[2] 辛玉华,周宇光,东秀珠.低温细菌与古菌的生物多样性及其冷适应机制[J].生物多样性,2013,21(4):468-480.
[3] Steven B,Briggs G,Mc Kay C P,et al.Characterization of the microbial diversity in a permafrost sample from the Canadian high Arctic using culture-dependent and culture-independent methods[J].FEMS Microbiology Ecology,2007,59(2):513-523.
[4] 孔维栋.极地陆域微生物多样性研究进展[J].生物多样性,2013,21(4):457-467.
[5] 徐旭,汪涛,陈吉刚.16SrDNA文库法应用于北冰洋海水可培养细菌多样性研究[J].中国科技论文在线,2013:1-7.
[6] Bhatia M,Sharp M,Foght J.Distinct bacterial communities exist beneath a high Arctic polythermal glacier[J].Applied and Environmental Microbiology,2006,72(9):5838-5845.
[7] Bowman JS,Rasmussen S,Blom N,et al.Microbial community structure of Arctic multiyear seaice and surface seawater by 454 sequencing of the 16S RNA gene[J].The ISME Journal,2012,6(1):11-20.
[8] Tung H,Price P,Bramall N,et al.Microorganisms metabolizing on clay grains in 3-km-deep Greenland basal ice[J].Astrobiology,2006,6(1):69-86.
[9] Glatz R,Lepp P,Ward B,et al.Planktonic microbial community composition across steep physical/chemical gradients in permanently ice-covered Lake Bonney,Antarctica[J].Geobiology,2006,4(1):53-67.
[10] Ma L,Catranis C M,Starmer W T,et al.Revival and characterization of fungi from ancient polar ice[J].Mycologist,1999,13(2):70-73.
[11] Gunde-Cimerman N,Sonjak S,Zalar P,et al.Extremophilic fungi in arctic ice:a relationship between adaptation to low temperature and water activity[J].Physics and Chemistry of the Earth,Parts A/B/C,2003,28(28/32):1273-1278.
[12] Miteva V,Teacher C,Sowers T,et al.Comparison of the microbial diversity at different depths of the GISP2 Greenland ice core in relationship to deposition climates[J].Environmental Microbiology,2009,11(3):640-656.
[13] Singh S M,Singh S K,Yadav L S,et al.Filamentous soil fungi from Ny-Ålesund,Spitsbergen,and screening for extracellular enzymes[J].Arctic,2012,65(1):45-55.
[14] Gawas-Sakhalkar P,Singh S M.Fungal community associated with Arctic moss,Tetraplodon mimoides and its rhizosphere:bioprospecting for production of industrially useful enzymes[J].Current Science,2011,100(11):1701-1705.
[15] Wallenstein M D,McMahon S,Schimel J.Bacterial and fungal community structure in Arctic tundra tussock and shrub soils[J].FEMS Microbiology Ecology,2007,59(2):428-35.
[16] 那广水,周传光,叶亮,等.北极微生物的分离及抗菌抗肿瘤活性筛选[J].水产科学,2008,27(8):414-416.
[17] 许丹,马吉飞,苗祯,等.北极Ny-Ålesund地区真菌多样性分析及龙胆苦苷转化菌株的筛选[J].极地研究,2012,24(4):372-383.
[18] Borneman J,Hartin R J.PCR primers that amplify fungal r RNA genes from environmental samples[J].Applied and Environmental Microbiology,2000,66(10):4356-4360.
[19] 苏冬雪.土壤有机、无机碳库变化差异及其对理化性质的影响[D].哈尔滨:东北林业大学,2012.
[20] Junge K,Imhoff F,Staley T,et al.Phylogenetic diversity of numerically important Arctic sea-ice bacteria cultured at subzero temperature[J].Microbial Ecology,2002,43(3):315-328.
Isolation and preliminary identification of fungi in different substrate from the Arctic Yellow River Station
Ding Hui1,2,Wang Nengfei2,Zang Jiaye2,Yang Xiao1,2,Ran Xiangbin2,Zhang Botao1
(1.College of Chemical Science and Engineering,Qingdao University,Qingdao 266071,China;2.Key Lab of Marine Bioactive Substances State Oceanic Administration,First Institute of Oceanography,State Oceanic Administration,Qingdao 266061,China)
In order to explore the diversity of fungi in the Arctic land and reveal their ecological roles,fungi were isolated and identified from 24 samples collected from Yellow River Station during the 5thChinese Artic Scientific Expedition in the present study.Sixty strains of fungi were totally isolated by plate spreading and streaking.More fungal species and quantity were isolated in humus than in other samples.Classification and phylogenetic analysis based on ITS rDNA showed that 28 representative fungal strains belonged to 4 classes,including Eurotiomycetes,Sordariomycetes,Dothideomycetes and Phycomycetes,and 12 genus.Geomyces was one of the most dominant genera among them.The data indicated that abundant fungal diversity existed in Arctic.The relationship between physicochemical parameters of soil and fungal diversity was explored through determination of physical and chemical properties of the representative soil.The organic carbon and nitrogen and soluble nutrient content areimportant factors affecting the fungal diversity in Arctic.
Arctic Yellow River Station;fungal diversity;phylogenetic analysis;physicochemical
Q939
A
0253-4193(2014)10-0124-07
2013年全球海洋学SCI期刊引证指标
2013 Articles ANNU REV MAR SCI 1941-1405 1 628 16.381 16.277 2 Abbreviated Journal Title ISSN 2013 Total Cites Impact Factor 5-Year Impact Factor 4 OCEANOGR MAR BIOL 0078-3218 2 180 11.083 10.194 5 PROG OCEANOGR 0079-6611 5 899 3.986 4.713 115 PALEOCEANOGRAPHY 0883-8305 6 793 3.918 4.177 60 LIMNOL OCEANOGR 0024-3590 25 146 3.615 4.332 177 OCEANOGRAPH Y 1042-8275 2 337 3.285 3.779 56 MAR CHEM 0304-4203 8 111 3.2 3.85 97 J PHYS OCEANOGR 0022-3670 11 935 2.871 3.132 169 DEEP-SEA RES PT I 0967-0637 6 581 2.825 3.198 119 DEEP-SEA RES PT II 0967-0645 7 542 2.763 2.989 226 MAR ECOL PROG SER 0171-8630 34 992 2.64 3.17 500 OCEAN MODEL 1463-5003 2 305 2.59 2.988 106 FISH OCEANOGR 1054-6006 1 873 2.542 2.795 39 ICES J MAR SCI 1054-3139 7 533 2.525 2.595 140 TELLUS A 0280-6495 2 382 2.518 2.609 58 J MARINE SYST 0924-7963 4 965 2.476 2.769 136 J PLANKTON RES 0142-7873 6 060 2.263 2.419 108 ESTUAR COAST SHELF S 0272-7714 12 625 2.253 2.782 295 MAR FRESHWATER RES 1323-1650 4 027 2.25 2.191 105 MAR GEOL 0025-3227 9 584 2.201 2.586 153 CONT SHELF RES 0278-4343 7 161 2.115 2.491 246 GEO-MAR LETT 0276-0460 1 340 2.062 2.113 40 OCEAN SCI 1812-0784 883 1.962 2.209 68 J SEA RES 1385-1101 2 277 1.855 2.318 129 OCEAN COAST MANAGE 0964-5691 2 269 1.769 2.029 233 POLAR RES 0800-0395 1 081 1.686 1.966 46 OCEAN DYNAM 1616-7341 1 485 1.683 1.867 79 LIMNOL OCEANOGR-METH 1541-5856 1 499 1.681 2.551 54 DYNAM ATMOS OCEANS 0377-0265 7 63 1.581 2.358 19 J OPER OCEANOGR 1755-876X 62 1.5 1.17 8 J OCEANOGR 0916-8370 1 992 1.464 1.701 55 HELGOLAND MAR RES 1438-387X 1 486 1.408 1.688 63 OCEAN ENG 0029-8018 3 200 1.337 1.615 316 B MAR SCI 0007-4977 4 411 1.333 1.494 53 IEEE J OCEANIC ENG 0364-9059 2 228 1.325 1.524 64 APPL OCEAN RES 0141-1187 988 1.262 1.333 81 THALASSAS 0212-5919 114 1.226 0.875 12 ATMOS OCEAN 0705-5900 949 1.19 1.34 37 ENVIRON FLUID MECH 1567-7419 522 1.164 1.775 31 MAR GEOD 0149-0419 639 1.115 1.757 24 TERR ATMOS OCEAN SCI 1017-0839 804 1.061 0.957 85 OCEANOLOGIA 0078-3234 482 0.927 1.046 47 OCEANOL H YDROBIOL ST 1730-413X 349 0.867 0.698 55 MAR GEOPHYS RES 0025-3235 689 0.763 0.966 28 MAR TECHNOL SOC J 0025-3324 506 0.757 0.827 64 J NAVIGATION 0373-4633 595 0.691 0.813 54 ACTA OCEANOL SIN 0253-505X 868 0.684 0.762 138 CHIN J OCEANOL LIMN 0254-4059 720 0.684 0.715 145 NEW ZEAL J MAR FRESH 0028-8330 1 887 0.678 1.091 38 AUST METEOROL OCEAN 1836-716X 212 0.63 1.256 22 IZV ATMOS OCEAN PHY+0001-4338 702 0.597 0.749 101 BRAZ J OCEANOGR 1679-8759 313 0.534 0.85 28 OCEANOLOGY+0001-4370 805 0.487 0.516 70 REV BIOL MAR OCEANOG 0717-3326 349 0.469 0.658 64 MAR GEORESOUR GEOTEC 1064-119X 153 0.383 0.46 22 J OCEAN U CHINA 1672-5182 356 0.381 80 INDIAN J GEO-MAR SCI 0379-5136 60 0.313 0.324 131 NAV ENG J 0028-1425 130 0.084 0.163 38
2014-02-10;
2014-04-26。
南北极环境综合考察与评估专项(CHINARE-2013-02-01,CHINARE-2013-01-06,CHINARE-2013-04-01-07)。
丁慧(1991—),女,山东省胶南市人,主要从事微生物制药研究。E-mail:dinghui4321@126.com
*通信作者:王能飞。E-mail:wangnengfei@fio.org.cn
丁慧,王能飞,臧家业,等.北极黄河站地区不同基底中真菌的分离培养及初步鉴定[J].海洋学报,2014,36(10):124—130,
10.3969/j.issn.0253-4193.2014.10.013
Ding Hui,Wang Nengfei,Zang Jiaye,et al.Isolation and preliminary identification of fungi in different substrate from the Arctic Yellow River Station[J].Acta Oceanologica Sinica(in Chinese),2014,36(10):124—130,doi:10.3969/j.issn.0253-4193.2014.10.013
