光学功能化蚕丝纤维材料
2014-06-01曹丽薇林乃波刘向阳
曹丽薇,林乃波,刘向阳
(厦门大学材料学院和物理与机电工程学院软物质与生物仿生研究院,福建厦门361005)
光学功能化蚕丝纤维材料
曹丽薇,林乃波,刘向阳
(厦门大学材料学院和物理与机电工程学院软物质与生物仿生研究院,福建厦门361005)
家蚕蚕丝是一种天然的蛋白质纤维,蚕丝及其衍生物(凝胶、蚕丝薄膜和海绵等)具有独特的力学性能、良好的生物相容性和生物降解性,已经被应用在纺织、生物医学等领域。最近,利用蚕丝独特的性质制备光学功能化蚕丝吸引了研究者的兴趣。基于对蚕丝的丝胶和丝素结构组成的总结,介绍了目前蚕丝结构的相关研究进展,综述了近年来对光学功能化蚕丝的研究,具体包括光学功能化蚕丝的重要种类、制备和应用。重点介绍了荧光性功能蚕丝基因工程、喂食法和复合等制备方法,该种材料用于生物支架成像、药物缓释载体和光学器件等领域。总结了利用生物仿生技术制备具有光子晶体结构色的蚕丝材料,这为化妆品,变色服饰和生物光控器件开辟了新方向;此外,蚕丝材料还可以应用于非线性光学领域,如光限幅和激光防护。
蚕丝;荧光;光子晶体;光限幅
1 前 言
蚕丝迄今已有5 000年的历史,是公认的“纤维皇后”,其手感柔软滑爽,有光泽,在纺丝行业已得到广泛的应用[1-2]。作为一种纤维材料,蚕丝应用不仅仅局限于服装行业。蚕丝是一种天然的蛋白质纤维,随着对其结构和性质的深入研究,其独特的机械性能、良好的生物相容性和生物降解性已逐渐显露优势,特别在生物医用领域,可作为药物缓释载体、组织工程支架、手术缝合线等[3-4]。蚕丝可通过溶解制成丝素蛋白溶液,成型可得到再生丝素蛋白纤维、薄膜、凝胶等材料。近几年来,研究人员对蚕丝的功能化进行了更深入研究,采用多种方法对蚕丝材料进行改性和功能化,这不仅提高了蚕丝本身的特性,同时增加了蚕丝本身不具有的功能,从而使其可以应用于光电学器件和生物成像等领域[5-7]。如蚕丝再生薄膜光学透明性良好,在可见光范围内(λ=400~700 nm),透过率达95%,可用于微缩影像技术或光波导材料[6,8];利用基因工程技术、染色和喂食法制备的彩色荧光蚕丝,可作为防伪用材料以及生物体内成像。本文论述了具有光学性能的功能化蚕丝的最新进展,从蚕丝的结构特性出发,集中阐述具有荧光性能的蚕丝的制备方法、材料特性、应用。此外还总结了蚕丝材料上刻蚀纳米/微图案、蚕丝光子晶体材料和光限幅蚕丝等方面研究成果,希望能为蚕丝材料在光学领域的发展起到铺垫作用。
2 蚕丝的结构
蚕丝为一种天然的生物高分子蛋白,它的主要组成结构为外层的丝胶和内层的丝素(图1a),丝胶蛋白约占丝蛋白总量的20%~30%,丝素蛋白约占70%~80%。丝素蛋白由重链(H链,分子量350 kDa)、轻链(L链,分子量25.8 kDa)及糖蛋白P25(分子量23.55 kDa)组成[9]。丝素蛋白重链序列中包含结构高度重复并富含甘氨酸的中间区和2个结构重复性差的C端和N端,GAGAGS作为中间区的主要部分,被认为是蚕丝中β-折叠微晶的构成单位[11](图1b)。丝素蛋白分子的构象可分为两类,即Silk I和Silk II结构,Silk I结构包括无规线团(Random Coil)和α-螺旋(α-Helix),Silk II结构呈反平行β-折叠(β-Sheet)。
蚕丝可视为高分子链沿纤维长轴高度取向的半结晶高分子材料。由图1a可见,蚕丝蛋白纤维由50~100根细纤维(Fibril)组成,细纤维又由无数根直径约为20~30 nm的纳米纤维组成,包含结晶区和无定形区,无定形链段由结晶区的β-折叠晶体链接成丝素蛋白网络结构[12-13]。目前,人们利用不同的方法检测蚕丝结构特征[14]。最近,Liu等[10,15-16]结合XRD,FTIR,TEM和AFM等方法检测和比较蚕丝和蜘蛛丝的结构特点。他们用XRD检测了蚕丝的β-折叠晶体结构和结晶度,采用FTIR测量了蚕丝的β-折叠含量,包括有无微晶结构的β-折叠。结果如表1所示,蜘蛛丝无规则卷曲中含57%的β-折叠结构,其中有43%为β-折叠微晶结构,而蚕丝无序结构中只含18%,但其中含有82%的β-折叠微晶,蚕丝总的β-折叠含量小于蜘蛛丝[17-18]。Ohgo[19]和Asakura[20]等用Rho-核磁观察了蚕丝蛋白溶液在剪切力的作用下二级结构的改变情况。结果发现,无规卷曲结构在剪切力的作用下更加松散,而β-折叠微晶结构没发生变化,因此,可利用适当的剪切力来改变蚕丝的二级结构。Hu等[18]用热重分析和红外光谱研究了蚕丝蛋白薄膜在不同温度的作用下,自组装成β-折叠片行为。将样品从192℃加热至214℃,β-折叠片的含量从0.11上升至0.43,经乙醇处理后,可达到0.56,这是由于无规卷曲结构向β-折叠转变的结果。Teramoto等[21-22]对丝胶进行研究,发现丝胶在丝腺中部区域呈现无规卷曲结构,在抽丝过程中,结构不发生显著改变,而经过热处理后,丝胶蛋白的重复序列中含天冬氨酸的片段的这部分结构容易改变。

表1 N.pilipes蜘蛛丝和家蚕蚕丝β-折叠晶体的比较[10]Tab le 1 A compa rison of theβ-sheet crystallinity of spide r N.p ilipes dragline silk and silkworm Bom byx m ori cocoon silk[10]

图1 家蚕蚕丝多级结构示意图(a),蚕丝由外层的丝胶和内层的丝素组成,丝素蛋白由无数微纤维密切结合而成,包括结晶区和非结晶区;家蚕蚕丝重链氨基酸序列(b),黑色加粗氨基酸序列为β-折叠构成单位[10-11]Fig.1 The hierarchical structure illustration ofsilkworm silk(a),silkworm thread consistsof two proteins:an inner layer called fibroin and an outer covering called sericin,a silk fiber is composed of numerousminute fibrils,which are separated into crystalline and amorphous segments;and typical amino acid sequences of silkworm Bombyx mori silk heavy chain(b),bold amino acids indicate sequencemotifs that are recognized as being involved inβ-structures[10-11]
3 蚕丝的功能化
3.1 荧光蚕丝
蚕丝是一种非常重要的纤维材料,它的应用已经不仅仅局限在纺织行业。天然蚕丝的颜色有白色和黄色,随着科学技术的发展,人们已经获得具有不同颜色的蚕丝,如红色、绿色、橙色等。此外,经过功能化后的蚕丝,还具有一些特殊功能,如荧光、防紫外、抗菌等,可用于纺织、生物医学、防伪领域。目前制备荧光蚕丝方法,包括基因工程、喂食法、纳米材料结合方法以及双光子荧光技术等。
转座子元件介导的转基因技术在研究昆虫的基因功能时发挥了重要的作用。Yamao[23]和Ramura[24]等利用杆状病毒将绿色荧光蛋白(GFP)导入到家蚕体内,PiggyBac转座子可调控重组DNA,使荧光蛋白基因在蚕体内进行表达(如图2所示)。这种高效稳定的家蚕转基因技术可作为生物反应器进行基因工程蛋白体的表达。Cha[25]等利用这种技术,将绿色荧光蛋白(GFPuv)作为标记物,观察HIL-2和CAT在昆虫体内的表达过程。通过GFPuv的荧光性可清晰地呈现目标蛋白的表达过程和时间,以及对目标蛋白产量的检测。人们将荧光蛋白基因导入到蚕体体内后,能够获得发绿色、红色和橙色荧光的蚕丝[26-27]。基因工程技术制备荧光蚕丝的确是一种可行的办法,然而其费用高、效率低、操作复杂以及丝质差等缺点,使在实际应用上受到了一定的限制。此外GFP和其它的荧光蛋白激发谱范围小,转基因得到的蚕丝机械性能普遍较差。并且,荧光特性是否能稳定遗传至下一代[23],仍是一个待解决的问题。因此,基因工程技术在蚕丝方面的应用仍面临很大的挑战。
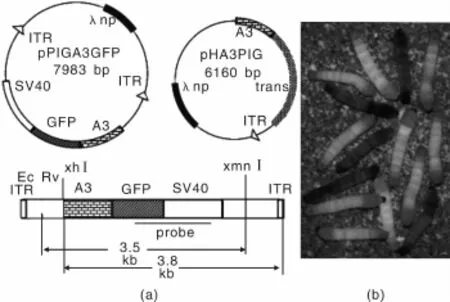
图2 PiggyBac结构组成示意图,绿色荧光蛋白基因(GFP)和家蚕A3肌动蛋白启动子基因序列(a);绿色荧光蛋白在蚕体表达和没有表达的呈现图(b)[24]Fig.2 Organization illustration of the PiggyBac constructs(a),including GFP coding sequence and B.mori A3 cytoplasmic actin gene promoter;and the image of silkworms with GFP expression orwithout(b)[24]
传统的染色工艺制备彩色蚕丝,容易改变蚕丝的结构,降低蚕丝的机械性能[28],同时,大量的染料废液排放,造成环境的污染。早在20世纪初期,人们在蚕的食物中添加有色染料,通过喂食法,最终得到彩色蚕茧,这为后来采用喂食法生产功能蚕丝奠定了重要的基础。Goris[29]等使用很多染料,如普鲁士蓝、番红精、龙胆紫、亚甲基蓝、靛蓝胭脂红、茜草色素、品红等进行实验,但很多染料都没有在蚕茧中呈现。由于当时技术手段的落后,使喂食法的发展受到一定的限制。最近,Tansil等[30-31]将罗丹明B与蚕食混合,蚕进食1 h后,可以明显地观察到罗丹明B已被蚕摄取,在紫外光下蚕体和蚕茧能发出橙色的荧光,同时所得的彩色荧光蚕丝的机械性能与传统的蚕丝相比没有发生很大的改变。此外,Tansil还用罗丹明101和罗丹明110进行同样的实验,都能得到预期的结果(如图3所示)。研究发现,染料能否被蚕所摄取,与它们的亲疏水结构密切相关,亲疏水性适中的染料更易进入蚕腺。这个发现有利于人们对所需的物质进行选择,设计以及合成理想的结构,从而使染料更容易进入丝腺,与蚕丝蛋白结合,产生预期的彩色蚕丝。喂食法制备彩色荧光蚕丝,具有操作简单、高效、环保等优点。但荧光染料在蚕体内的运输复杂,要使其有效进入蚕丝腺内,从而与蚕丝蛋白牢固结合,并保证荧光染料等物质对蚕无害和对丝产量无影响,仍是喂食法生产功能蚕丝所需克服的难点。
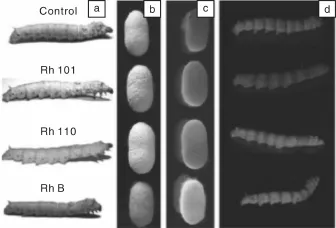
图3 进食罗丹明101、罗丹明110、罗丹明B后以及未进食染料的蚕幼虫图片(a),a图对应的蚕茧照片(b),b图蚕茧在紫外光照射下的图片(c),蚕在紫外光照射下的图片(d)[31]Fig.3 The photographs of silkworm larvae through addition of Rh 101,Rh 110,Rh B and control(a),the photographs of cocoons(b),the cocoons under UV light(c),and the larvae under UV light(d)[31]
近几年来,纳米颗粒的应用受到广泛的关注,由于其粒径小(<1 000 nm),比表面积大,表现出尺寸效应、表面效应,具有光、电、磁等特殊的性能,被应用于医药、光电器件、生物传感器等领域。蚕丝作为一种天然的生物大分子,将蚕丝与无机纳米颗粒结合的潜在应用已经受到人们的关注。Su[32]等将蚕丝蛋白纤维(SFF)依次浸入到硝酸银和氯化钠溶液中,蚕丝表面的氨基酸带负电,为Ag+提供固定位点,逐步聚集形成Ag或AgCl纳米颗粒,AgCl/SFF纳米复合晶体可用作光催化剂和抗菌材料。Dubas[33]等用Layer-by-Layer自组装制备了Ag/SFF抗菌材料,结果显示,在蚕丝纤维上的抗菌率达到80%,而在尼龙纤维为50%,因此蚕丝纤维的抗菌效果更好。Li[34]等将TiO2和TiO2@Ag纳米颗粒利用共价键与蚕丝纤维结合,制备了防紫外及具有抗菌活性的SFF。Chang[35]等以蚕丝纤维作为模板,合成了具有强荧光和光催化特性的CdS和ZnS复合半导体量子点。Chu[36]等制备了外层包有PE/QD/PE三次物质的荧光蚕丝,其可发出绿色、黄色、红色及近红外荧光的CdTe量子点,同时可提高蚕丝的强度,其可穿透厚度约为3.5 mm的不透明猪皮。Parker[37]等将激光染料罗丹明6G作为增益介质,加入到蚕丝溶液中,制作了波导管,其可减小脉冲信号的损失。
蚕丝还可以与量子点复合得到具有特殊性能的发白光的蚕丝薄膜材料。Lin等[38]将一定摩尔比的ZnSe量子点和CdTe量子点混合,制备了(ZnSe)x/CdTe量子点溶液,随后将其与蚕丝蛋白溶液通过分子识别自组装形成复合蚕丝薄膜。通过SEM和TEM观察,薄膜表面光滑,(ZnSe)x/CdTe量子点均匀分散在蚕丝蛋白溶液中。通过改变ZnSe和CdTe的摩尔比,可以调控薄膜的发光性。当ZnSe与CdTe的摩尔比为30:1时,发蓝光的ZnSe与发黄光的CdTe达到平衡,薄膜呈现白光(如图4所示)。该方法为实现蚕丝在光学器件领域应用提供了新的思路。
釆用纳米颗粒结合的方法制备荧光蚕丝的局限性是蚕丝表面粘结的纳米颗粒稳定性不好,如丝织物表面有4~6×10-5Ag溶胶时,在前5次水洗后仍有100%的抗菌活性,但是在洗涤10次后,其抗菌活性仅剩80%[39]。
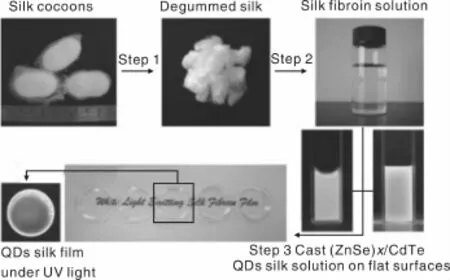
图4 量子点功能化的白光蚕丝薄膜制作过程示意图[38]Fig.4 Illustration of preparing quantum dots(QDs)functionalized white-light-emitting silk fibroin films[38]
支架材料作为细胞外基质替代物的生物材料是组织工程研究的基础。由于生物材料与人体组织直接接触,因此其需要具备以下几个特点:良好的生物相容性、生物可降解性,三维多孔结构和高的孔隙率,一定的机械性能,可塑性,抗凝血性。蚕丝具有很好的生物相容性,促进细胞的增殖分化,诱导组织细胞的再生,无抗原作用[40-41],同时蚕丝具有独特的力学性能,可降解,且降解速度与生长速度相匹配,有一定的孔隙率,因此是组织支架的理想材料。蚕丝蛋白作为组织工程支架材料,要使它能够更好地支持细胞,及控制细胞的增殖和分化,主要的关键点是获得蚕丝支架的结构和性质与组织之间的关系。为了解决这个问题,研究者采用光谱技术分析蚕丝分子结构组成[42],用SEM和TEM观察支架的三维结构[41,43]。
近几年,人们利用荧光分子与蚕丝蛋白结合制备荧光蚕丝支架,然后用于培养人结肠成纤维细胞,结果表明,蚕丝支架具有宽领域的激发波长和强度荧光特性,毒性小,能有效地促进细胞的附着与生长,同时还可以用光学成像技术对支架的行为进行观测(如图5所示)[7]。
双光子荧光现象,是由于介质在强激光作用下,同时吸收2个光子,再通过辐射跃迁发射1个荧光光子的过程[44-45]。与传统的单光子荧光技术相比,双光子荧光技术一般具备近红外激发,因此在活体组织成像过程中能降低光损伤和光漂泊,以及具有深度组织穿透力的优点,被认为是生物成像技术发展的里程碑。Lin等[7,46]利用双光子荧光材料获得功能蚕丝纤维。他们利用蚕丝表面的-NH识别相互聚集的具有双光子荧光特性的4NF和8NF,由于聚集的4NF和8NF失去荧光特性,与蚕丝作用时,蚕丝表面的-NH与4NF和8NF的-NO2相互作用,使4NF和8NF解聚集而发出双光子荧光,该技术在蚕丝支架材料生物医学成像上得到了成功应用(如图6)。

图5 NF蚕丝复合支架和3T3成纤维细胞横截面双光子荧光显微照片(a)和NF蚕丝复合支架和3T3成纤维细胞三维双光子荧光显微照片(b)[7]Fig.5 TPFmicroscope image showing a cross-scetional view of NF silk fiber scaffold and 3T3 fibroblast cells(a)and three-dimensional TPF images of NF silk fiber scaffold and 3T3 fibroblast cells(b)[7]
蚕丝具有良好的生物降解性,蚕丝结构中含有周期性的亲疏水区域,使其与蛋白质之间存在很强的相互作用力,可保持蛋白质活性和控制药物释放,因此蚕丝是一种理想的药物控/缓释载体。荧光蚕丝作为药物载体,可根据它的荧光性质,追踪药物输送至靶细胞的过程,确定是否药物能与靶细胞结合,同时还可检测药物的输送时间,药物发挥作用的时间以及载体降解的情况。Wang X[47]等用罗丹明B添加至蚕丝溶液中,检测药物分子的量以及药物的作用时间。
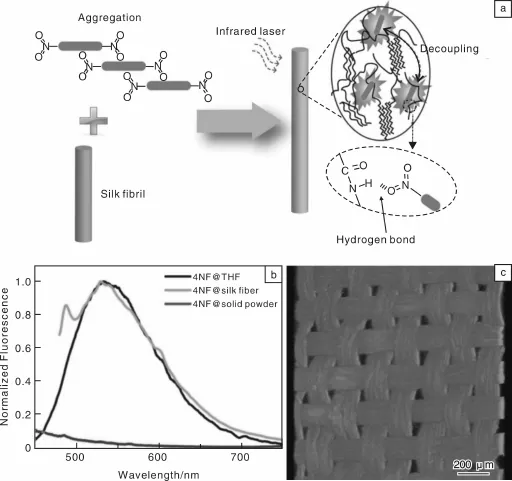
图6 4NF和8NF与蚕丝蛋白耦合作用的示意图(a),4NF与THF溶液、与蚕丝纤维混合物及与4NF固体粉末的荧光光谱图(b),8NF纤维支架三维结构的荧光显微成像(c)[46]Fig.6 Schematic image of silk fibril decoup ling effectby themolecular recognition of4NF and 8NFmolecules(a),the fluorescentspectra of 4NF in THF solution,in silk fibers and in the solid powder form(b)and a two-photo fluorescentmicroscope image showing three-dimensional view of 8NF fabric scaffold(c)[46]
3.2 微纳米光刻蚕丝
蚕丝蛋白是一种稳定的生物大分子,结构设计和功能化后可满足光学元件的要求,如添加荧光物质,可用于生物成像[48]。蚕丝蛋白薄膜是一种理想的光学透明材料,主要原因有以下几点:首先,良好的机械性能促使蚕丝薄膜形成,同时能够控制它的厚度(约20 nm~100μm),透明度高,有利于观察;其次,蚕丝蛋白表面光滑,粗糙度小于5 nm。
Perry[8]等提出一种软光刻技术,在蚕丝蛋白薄膜上利用该技术刻蚀了纳米/微图案(如图7)。Lawrence和Amsden等[49-50]同样利用纳米光刻蚕丝蛋白薄膜,制备了生物医学光学器件。该薄膜是将蚕丝蛋白溶液与血红素混合后,均匀涂布在有机玻璃上,通过纳米光刻在薄膜表面上刻蚀有600 mm的光栅,该技术结合纳米光学、生物聚合以及生物相容性等特点,为光学器件的制造和应用提供一条新的道路。虽然光刻技术是一种有效的制备光学器件的方法,然而蚕丝蛋白溶液在加工过程中需耗时12~36 h,大大减小生产效率,同时蚕丝蛋白的结构容易被破坏,失去它原有的性质。

图7 蚕丝蛋白薄膜3D衍射缩微成像AFM图:大范围的蚕丝衍射图(a),3D衍射缩微详图(b)和高质量的蚕丝蛋白3D衍射微缩图(c)[8]Fig.7 AFM images of a silk fibroin film that has3D diffraction micropatterning:large-scale view of diffraction patterned silk(a),detailed 3D geometry associated with themicropatterning(b)and high-quality projected image from a 3D diffraction pattern made in silk fibroin(c)[8]
3.3 光子晶体结构色蚕丝
自然界中,许多生物体以特殊的物理结构来产生颜色,被称之为结构色[51],如孔雀的羽毛,蝴蝶的翅膀,贝壳的颜色等[52]。结构色是特殊组织结构对光的色散、散射、干涉和衍射等选择性反射的现象产生的视觉效果[53]。结构色可应用在光子晶体、化妆品和图像技术中,其中,光子晶体通过控制光子的传播而产生结构色,具有高亮度、高饱和度、永不退色、虹彩现象等特点,是一种普遍的结构色。仿生光子晶体结构在仿生材料和仿生着色技术等应用越来越广泛。
Diao等[55-56]以蚕丝纤维作为原料,制备了仿生光子晶体结构色。利用简单快捷的自组装技术,形成蚕丝纤维反蛋白石结构。自组装后的蚕丝纤维可呈现光子晶体结构色,随着观察角度的变化,蚕丝纤维的颜色也随之发生明显的变化,颜色跨越紫外、可见、红外光谱范围。通过控制自组装过程中的湿度,可改变蚕丝纤维光子晶体的光子禁带,呈现不同的结构色。蚕丝纤维光子晶体结构色是纺织品着色的新方法,并获得染料着色所不能实现的特殊着色效果(如图8)[54]。
光子晶体结构色可在涂料、印刷、化妆品等领域中应用,同时还可利用其颜色变化机理,制备隐身衣。
3.4 光限幅蚕丝
在生物医学和军事领域中,激光是一个重要的工具,然而激光容易对人体造成损伤[46,57,58]。因此,防激光照射是目前应解决的一大难题。Putthanarat[59]等制备了含绿色荧光蛋白(GFP)的蚕丝薄膜(10~20 mm),测试表明该薄膜具有光限幅性能,第一次实现蚕丝的光限幅性能。
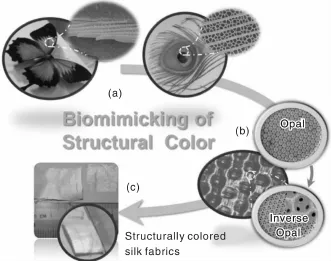
图8 蚕丝纤维仿生结构色:(a)蝴蝶翅膀和孔雀羽毛的结构色,(b)蚕丝纤维的蛋白石和反蛋白石结构的制备和(c)具有结构色的蚕丝纤维[54]Fig.8 Biomimetics of structural colors on silk fabrics:(a)the structure colorsofbutterfly and peacock feather,(b)fabrication of opal and inverse opal on silk fabrics and(c)structurally colored silk fabrics[54]
4 结 语
本文对光学功能化蚕丝的制备和应用进行综述,荧光蚕丝的制备方法,包括基因工程、喂食法、纳米材料结合法以及双光子技术,每种方法各有优缺点。彩色荧光蚕丝不仅可作为纺织材料,还可用于组织支架、药物载体以及光学元件等。光子晶体结构色具有高亮度、高饱和度、永不退色等特点,是仿生材料和仿生着色技术中很有前途的制备方法,在这种方法的基础上通过引入不同先进技术,可制备出各种光控器件、化妆品、印刷材料等。
References
[1] Shao Z,Vollrath F.Materials:Surprising Strength of Silkworm Silk[J].Nature,2002(418):741-742.
[2] Vepari C,Kap lan D L.Silk as a Biomaterial[J].Progress in Polymer Science,2007(32):991-1 007.
[3] Altman G H,Diaz F,Jakuba C,et al.Silk-Based Biomaterials[J].Biomaterials,2003(24):401-416.
[4] HakimiO,Knight D P,Vollrath F,et al.Spider and Mulberry Silkworm Silks as Compatible Biomaterials[J].Composites Part B:Engineering,2007(38):324-337.
[5] Domachuk P,Tsioris K,Omenetto F G,et al.Bio-Microfluidics:Biomaterials and Biomimetic Designs[J].Advanced Materials,2010(22):249-260.
[6] Fiorenzo G O,Kaplan D L.A New Route for Silk[J].Nature Photonics,2008,2(11):641-643.
[7] Lin N B,Toh G Y W,Yan F,et al.Two-Photon Fluorescent Bombyx Mori Silk by Molecular Recognition Functionalization[J].Journal of Materials Chemistry B,2014(2):2 136.
[8] Perry H,Gopinath A,Kap lan D L,et al.Nano-and Micropatterning of Optically Transparent,Mechanically Robust,Biocompatible Silk Fibroin Films[J].Advanced Materials,2008(20):3 070-3 072.
[9] Inoue S,Tanaka K,Arisaka F,et al.Silk Fibroin of Bombyx Mori is Secreted,Assembling A High Molecular Mass Elementary Unit Consisting of H-chain,L-chain,and P25,with a 6:6:1 molar Ratio[J].Journal Biological Chemistry,2000(275):40 517-40 528.
[10] Du N,Yang Z,Liu X Y,et al.Structural Origin of the Strain-Hardening of Spider Silk[J].Advanced Functional Materials,2011(21):772-778.
[11] Ha SW,Gracz H S,Tonelli A E,etal.Structural Study of Irregular Amino Acid Sequences in the Heavy Chain of Bombyx Mori Silk Fibroin[J].Biomacromolecules,2005(6):2 563-2 569.
[12] Shao Z Z,Vollrath F.Surprising strength of silkworm silk[J]. Nature,2002(418):741.
[13] Shi J,Lua S,Du N,et al.Identification,Recombinant Production and Structural Characterization of Four Silk Proteins from the Asiatic Honeybee Apis Cerana[J].Biomaterials,2008(29):2 820-2 828.
[14] Jin Y,Hang Y,Luo J,et al.In Vitro Studies on the Structure and Properties of Silk Fibroin Aqueous Solutions in Silkworm[J].International Journal of Biological Macromolecules,2013(62):162-166.
[15] Wu X,Liu X Y,Du N,et al.Unraveled Mechanism in Silk Engineering:Fast Reeling Induced Silk Toughening[J].Applied Physics Letters,2009(95):093 703.
[16] Du N,Liu X Y,Narayanan J,et al.Design of Superior Spider Silk:from Nanostructure to Mechanical Properties[J].Biophysical Journal,2006(91):4 528-4 535.
[17] Lefevre T,Rousseau M E,Pezolet M.Protein Secondary Structure and Orientation in Silk as Revealed by Raman Spectromicroscopy[J].Biophysical Journal,2007(92):2 885-2 895.
[18] Hu X,Kaplan D,Cebe P.Determining Beta-Sheet Crystallinity in Fibrous Proteins by Thermal Analysis and Infrared Spectroscopy[J].Macromolecules,2006(39):6 161.
[19] Ohgo K,Bagusat F,Asakura T.Investigation of Structural Transition of Regenerated Silk Fibroin Aqueous Solution by Rheo-NMR Spectroscopy[J].Journal of the American Chemical Society,2008(130):4 182.
[20] Asakura T,Ohgo K,Komatsu K,et al.Refinement of Repeatedβ-turn Structure for Silk IConformation of Bombyxmori Silk Fibroin Using 13C Solid-State NMR and X-ray Diffraction Methods[J].Macromolecules,2005(38):7 397.
[21] Teramoto H,Kakazu A,Asakura T.Native Structure and Degradation Pattern of Silk Sericin Studied by13CNMR Spectroscopy[J].Macromolecules,2006(39):6.
[22] Teramoto H,Kakazu A,Yamauchi K,et al.Role of Hydroxyl Side Chains in Bombyxmori Silk Sericin in Stabilizing Its Solid Structure[J].Macromolecules,2007(40):1 562.
[23] Yamao M,Katayama N,Nakazawa H.Gene Targeting in the Silkworm by Use of a Baculovirus[J].Genes&Development,1999(13):511.
[24] Tamura T,Thilbert C,Royer C,etal.Germ line Transformation of the Silkworm Bombyx Mori L.Using A Piggyback Transposon-Derived Vector[J].Nature Biotechnology,2000(18):81.
[25] Cha H J,Dalal N G,Pham M Q.Insect Larval Expression Process isOptimized by Generating Fusionswith Green Fluorescent Protein[J].Bioengineering,1999(65):316.
[26] Royer C,Jalabert A,Rocha M D,et al.Biosynthesis and Cocoon-Export of a Recombinant Globular Protein in Transgenic Silkworms[J].Transgenic Research,2005(14):463-472.
[27] Liu JM,DavidW C,Ip DT,etal.High-Level Expression ofOrange Fluorescent Protein in the Silkworm Larvae by the Bac-to-Bac system[J].Molecular Biology Reports,2009(36):329-335.
[28] Annadural V,Subramanyam G,Gopalkrishne U R,et al. Structure-Property Relation in Varieties of Silk Fibers[J]. Journal of Applied Polymer Science,2001(79):1 979-1 985.
[29] Tansil N C,Koh L D,Han M Y.Functional Silk:Colored and Luminescent[J].Advanced Materials,2012(24):1 388-1 397.
[30] Tansil N C,Li Y,Teng C P,et al.Intrinsically Colored and Luminescent Silk[J].Advanced Materials,2011(23):1 463-1 466.
[31] Tansil N C,Li Y,Koh L D,etal.The Use of Molecular Fluorescent Markers to Monitor Absorption and Distribution of Xenobiotics in a Silkworm Model[J].Biomaterials,2011(32):9 576-9 583.
[32] Su H,Han J,Dong Q,et al.In Situ Bioinspired Synthesis of Silver Chloride Nanocrystals on Silk Fibroin Fibers[J].Applied Physics A,2010(102):429-434.
[33] Dubas S T,Kum langdudsana P,Potiyaraj P.Layer-by-Layer Deposition of Antimicrobial Silver Nanoparticles on Textile Fibers[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006(289):105-109.
[34] Li G,Liu H,Zhao H,et al.Chemical Assembly of TiO2and TiO2@Ag Nanoparticles on Silk Fiber to Produce Multifunctional Fabrics[J].Journal of Colloid and Interface Science,2011(358):307-315.
[35] Chang SQ,Kang B,DaiY D,et al.A Novel Route to Synthesize CdSQuantum Dots on the Surface of Silk Fibers viaγ-Radiation[J].Materials Letters,2008(62):3 447-3 449.
[36] Chu M Q,Liu G J.Fluorescent Silkworm Silk Prepared via Incorporation of Green,Yellow,Red,and Near-Infrared Fluorescent Quantum Dots[J].Nanotechnology,2008(7):308-315.
[37] Parker ST,Domachuk P,Amsden J,etal.Biocompatible Silk Printed Optical Waveguides[J].Advanced Materials,2009(21):2 411-2 415.
[38] Lin N B,Hu F,Sun Y L,etal.Construction ofWhite-Light-E-mitting Silk Protein Hybrid Films by Molecular Recognized Assembly among Hierarchical Structures[J].Advanced Functional Materials,2014(10.1002):1-7.
[39] GulrajaniM L,Gupta D,Periyasamy S,et al.Preparation and Application of Silver Nanoparticles on Silk for Imparting Antimicrobial Properties[J].Journalof Applied Polymer Science,2008(108):614-623.
[40] Wu CY,Tian B Z,Zhu D A,etal.Propertiesand Application ofWound Protective Membranemade from Fibroin[J].Third International Silk Conference,1996(9):34-43.
[41] Kim U J,Park J,Kim H J,etal.Three-Dimensional Aqueous-Derived Biomaterial Scaffolds from Silk Fibroin[J].Biomaterials,2005(26):2 775-2 785.
[42] Zhao C,Yao J,Masuda H,et al.Structural Characterization and Artificial Fiber Formation of Bombyx Mori Silk Fibroin in Hexafluoro-Iso-Propanol Solvent System[J].Biopolymers,2003(69):253.
[43] Altman G H,Horan R L,Lu H H,et al.Silk Matrix for Tissue Engineered Anterior Cruciate Ligaments[J].Biomaterials, 2002(23):4 131.
[44] Albota M,Beljonne D,Bredas J L,et al.Design of Organic Molecules with Large Two-Photon Absorption Cross Sections[J].Science,1998(281):1 653-1 656.
[45] He G S,Tan L S,Zheng Q,et al.Multiphoton Absorbing Materials:Molecular Designs,Characterizations,and Applications[J].Chemical Reviews,2008(108):1 245.
[46] Lin N B,Liu X Y,Diao Y Y,et al.Switching on Fluorescent Emission by Molecular Recognition and Aggregation Dissociation[J].Advanced Functional Materials,2012(22):361-368.
[47] Wang X,Hu X,Daley A,et al.Nanolayer Biomaterial Coatings of Silk Fibroin for Controlled Release[J].Journal of Controlled Release,2007(121):190-199.
[48] Contag C H,Ross B D.It's not just about anatomy:in vivo bioluminescence imaging as an eyepiece into biology[J].Journal of Magnetic Resonance Imaging,2002(16):378-387.
[49] Lawrence BD,Cronin-Golomb M,Georgakoudi I,etal.Bioactive Silk Protein Biomaterial Systems for Optical Devices[J]. Biomacromolecules,2008(9):1 214-1 220.
[50] Amsden J J,Domachuk P,Gopinath A,et al.Rapid Nanoimprinting of Silk Fibroin Films for Biophotonic Applications[J]. Advanced Materials,2010(22):1 746-1 749.
[51] Srinivasarao M.Nano-Optics in the Biological World:Beetles,Butterflies,Birds,and Moths[J].Chemical Reviews,1999(99):1 935-1 961.
[52] Kinoshita S.Structural Colors in the Realm of Nature[M].Singapore:World Scientific Publishing Company,2008.
[53] Levkowitz H.Flat Panel Display Measurements Standard Version 2.0[J].Color Research&Application,2002(27):375-376.
[54] Li JL,Liu X Y.Soft FibrillarMaterials:Fabrication and Applications[M].Weinheim:Wiley-VCH Verlag GmbH,2013:320.
[55] Diao Y Y,Liu X Y,Toh GW,et al.Multiple Structural Coloring of Silk-Fibroin Photonic Crystals and Humidity-Responsive Color Sensing[J].Advanced Functional Materials,2013(23):5 373-5 380.
[56] Diao Y Y,Liu X Y.Controlled Colloidal Assembly:Experimental Modeling of General Crystallization and Biomimicking of Structural Color[J].Advanced Functional Materials,2012(22):1 354-1 375.
[57] Wang JX,Wen YQ,Ge H L,etal.Simple Fabrication of Full Color Colloidal Crystal Films with Tough Mechanical Strength[J].Macromolecular Chemistry and Physics,2006(207):596-604.
[58] Su X,Xu H,Guo Q,et al.Stilbene-Containing Polyactylenes:Molecular Design,Synthesis,and Relationship between Molecular Structure and NLO Properties[J].Journal of Polymer Science Part A:Polymer Chemistry,2008(46):4 529-4 541.
[59] Putthanarat S,Eby R K,Naik R R,et al.Nonlinear Optical Transmission of Silk/Green Fluorescent Protein(GFP)Films[J].Polymer,2004(45):8 451-8 457.
Functionalization of Silkworm Silk M aterials in Optics
CAO Liwei,LIN Naibo,LIU Xiangyang
(Research Institute for SoftMatter and Biomimetics,Xiamen University,Xiamen 361005,China)
As a kind of nature protein,silkworm silk and its derivatives(gels,silk fibroin foams and films)possess the uniquemechanical properties,biocompatibility and biodegradability,which have been app lied to textile and biomedical industry.Recently,there is a growing interest in introducing optical functionalities into silk.Based on the structure of sericin and fibroin,functionalization of silk was summarized in optics,specifically including the important species,preparation and application of fluorescent silk.This paper highlighted that the fluorescent silk can be produced by genetic engineering,feeding,and compositing etc.,which can be applied in scaffold imaging,drug delivery,and optical devices.In addition,this paper reviewed the fabrication of silk fabrics with photonic crystals structure colors using biom imetic techniques,which opens up a new direction of cometic,color dress,various devices and biological optical devices.At last,silk materials can also be applied in nonlinear optics,such as optical limiting and laser protection.
silk;fluorescence;photonic crystal;optical limiting
TS 102.3+3
A
1674-3962(2014)11-0669-08
2014-08-01
厦门大学中组部千人计划项目配套经费
曹丽薇,女,1990年生,硕士研究生
刘向阳,男,1958年生,教授,博士生导师,Email:phyliuxy@gmail.com
10.7502/j.issn.1674-3962.2014.11.04
