mTOR信号通路介导产生XCL1可促进乳腺癌耐药细胞株的增殖
2014-06-01
复旦大学附属肿瘤医院肿瘤研究所,复旦大学乳腺研究所,复旦大学上海医学院肿瘤学系,上海200032
mTOR信号通路介导产生XCL1可促进乳腺癌耐药细胞株的增殖
白玉盘 杨小利 欧周罗
复旦大学附属肿瘤医院肿瘤研究所,复旦大学乳腺研究所,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:统计表明90%以上肿瘤患者的死亡与肿瘤耐药相关,而在乳腺癌中常见PI3K/Akt/ mTOR信号通路的异常激活,以此通路为靶点的药物已成为乳腺癌治疗的研究热点。本研究主要分析C族趋化因子配基1(C chemokine ligand 1,XCL1)对乳腺癌耐药细胞增殖的影响及其产生机制。方法:建立吉西他滨耐药性人乳腺癌细胞系MDA-MB-231/Gem。采用CCK8检测MDA-MB-231和MDA-MB-231/Gem的增殖能力,RT-PCR、ELISA检测2株细胞株XCL1表达差异,Western blot检测mTOR的表达。结果:与MDA-MB-231相比,MDA-MB-231/ Gem的增殖能力增强,XCL1在耐药细胞株表达增强。mTOR在耐药细胞株表达水平及磷酸化水平增强。在MDAMB-231中加入外源性XCL1 24 h后,细胞增殖能力增强。而在MDA-MB-231/Gem中加入抗XCL1抗体后,细胞增殖能力降低。mTOR抑制剂处理MDA-MB-231/Gem后,细胞增殖能力降低,XCL1产生减少。结论:趋化因子XCL1的分泌可促进乳腺癌耐药细胞的增殖并由mTOR信号通路介导产生。
MDA-MB-231/Gem;趋化因子配基1;mTOR;乳腺癌
恶性肿瘤已成为人类的第一杀手,严重危害人类的生命健康。今后20年内全球癌症患者人数还将快速上升。目前,化疗是治疗肿瘤的主要途径之一,然而肿瘤耐药往往造成化疗失败,从而导致患者病情恶化甚至死亡[1-2]。统计数据表明,90%以上肿瘤患者的死亡与肿瘤耐药相关。因此,如何克服肿瘤耐药是成功治疗恶性肿瘤急需解决的关键问题之一[3]。哺乳动物体内的mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,可介导多种蛋白如HIF-1α等的产生。mTOR信号通路与人类多种肿瘤密切相关,其在肿瘤细胞的增殖、存活、凋亡、血管发生和转移以及对放化疗抵抗中发挥重要作用[4-5],乳腺癌中常见PI3K/Akt/mTOR信号通路的异常激活,以此通路为靶点的药物已成为乳腺癌治疗的研究热点[5-6]。本研究应用CCK8、PCR及Western blot等多种实验方法检测了乳腺癌细胞和耐药细胞株中C族趋化因子配基1(C chemokine ligand 1,XCL1)、mTOR的表达,并分析其与细胞增殖的关系及耐药机制,旨在为乳腺癌临床治疗提供新的靶点和理论依据。
1 材料和方法
1.1 细胞及试剂
1.1.1 细胞
化疗抵抗乳腺癌细胞系MDA-MB-231/ Gemcitabine(MDA-MB-231/Gem)由复旦大学附属肿瘤医院乳腺癌研究所建立。MDA-MB-231及MDA-MB-231/Gem细胞用DMEM培养,培养基中添加10%FBS。细胞传代时用0.25%的胰蛋白酶消化,按1∶3的比例传代。
1.1.2 主要试剂
重组蛋白XCL1(购自美国R&D公司),mTOR和磷酸化mTOR抗体及mTOR磷酸化抑制剂(购自美国Cell Signaling Technology公司),ELISA试剂盒(购自美国R&D公司),RIPA裂解液(购自中国碧云天公司),PhosStop(购自瑞士Roche公司),BCA蛋白定量试剂盒(购自美国Thermo Scientific Pierce公司),TRIzol(购自美国Invitrogen公司),凋亡试剂盒(购自美国Invitrogen公司)。
1. 2 主要仪器
Eppendorf 5417R高速冷冻离心机(购自德国Eppendorf公司),精宏电热恒温培养箱(购自上海精宏实验设备有限公司),恒温金属浴振荡器(购自中国博日科技Bioer公司),Bio-Rad恒流恒压电泳仪(购自美国Bio-Rad公司),ATTO AE-6450电泳槽(购自日本ATTO公司),UV-120-02型紫外分光光度仪(购自日本岛津公司),Image quant Las 4000mini凝胶成像仪及Nanoview微量检测仪(购自美国通用电气),ESCO classⅡ生物安全柜(购自新加坡ESCO公司), Biotek ELX-800酶标仪(购自美国Biotek公司)。
1.3 实验方法
1.3.1 细胞总RNA的抽提
将细胞培养基弃去,用预冷的PBS洗1次,加入1 mL TRIzol(以能完全覆盖整个细胞表面为宜),反复吹打细胞然后转移到1.5 mL Eppendorf管(EP管)内,将EP管放入冰盒里静置5 min后,加入200 μL氯仿,振荡15 s后,置于冰盒内静置2 min,随后12 000×g、4 ℃离心15 min,将上清液转移至新的EP管内,并加入500 μL异丙醇,轻轻震荡使管中液体混合均匀,静置10 min,行12 000×g、4 ℃离心10 min,弃上清液。接着,加入1 mL 体积分数为75%乙醇(用DEPC水配制),轻轻洗涤沉淀,行7 500×g、4 ℃离心5 min,弃上清液,沉淀总RNA置室温风干5 min,随后加入100 μL的DEPC水溶解。最后,用多功能酶标仪测定RNA浓度,按照反应体系需要,加入各种试剂,放入金属浴内反应,去除其中的DNA酶。
1.3.2 RT-PCR反应及产物鉴定
1.3.2.1 逆转录反应
反应体系总体积为20 μL,模板为从乳腺癌细胞抽提的总RNA。在EP管中分别加入试剂:4 μL 5×PrimeScriptBuffer PrimeScript,1 μL RT Enzyme Mix Ⅰ,1 μL Oligo dT Primer,1 μL Random 6 mers,2 μL RNA,11 μL DEPC H2O,轻轻震荡使管中液体混合均匀,置于PCR仪(EppendofMastercycler pro S)内,根据相应的反应条件,进行cDNA合成。
反转录反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。
1.3.2.2 PCR反应
反应体系总体积为20 μL。引物由上海生工生物工程有限公司合成。引物XCL1序列正义链:5’-GCTCTCTCACTGCATACATTGT-3’;反义链:5’-AGTCACAGCTGTATTGGTCG-3’。在EP管中分别加入各种反应试剂:2 μL 10×PCR Buffer,1.6 μL dNTP Mix,上下游引物(10 μmol/L)各 0.4 μL,2 μL cDNA,14.5 μL H2O,轻轻震荡使管中液体混合均匀,置于PCR仪内,并根据相应的反应条件,进行PCR反应。
1.3.2.3 产物验证
取1.5 g琼脂糖,加入1×TAE缓冲液150 mL,置于微波炉(Galanz)内加热至完全溶解,倒入装有梳子的电泳模具中凝固,制备成1%琼脂糖凝胶。然后,把凝胶放入电泳槽(Biorad)内,加入1×TE电泳缓冲液,取5 μL的扩增产物,加入1 μL的6×Loading Buffer,与DNA marker一起进行琼脂糖凝胶电泳,120 V电压,30 min电泳。电泳结束后,将琼脂糖凝胶置于EB染色液中染色10 min,之后在清水内清洗10 min,最后利用生物电泳图像分析系统(复日科技,FR-980A)观察并拍照,确认特异性目的条带。
1.3.3 蛋白免疫印迹杂交
取对数生长期细胞用预冷的PBS清洗3遍后,在培养皿中加入适量PBS液,用细胞刮刀收集细胞转入EP管中。然后,200×g,离心半径140 mm离心5 min,弃上清液,细胞沉淀中加入适量细胞裂解液混合均匀,冰上放置10 min,使其充分裂解。接着12 000×g,4 ℃离心5 min,将上清液转入新的EP管中,抽提的总蛋白用BCA法测定浓度,以2 000 μg/mL为标准,稀释各个样品,按照40 μg/孔上样,即每孔的上样量为20 μL的蛋白和5 μL的5×蛋白Loading Buffer。95 ℃加热煮沸5 min,使蛋白变性,12 000×g离心1 min。制备12%分离胶(30%聚丙烯酰胺,pH=8.8 Tris-HCl、10%APS、10%SDS、TEMED)和浓缩胶(30%聚丙烯酰胺,pH=6.8 Tris-HCl、10%APS、10%SDS、TEMED),放入蛋白电泳槽(Bio-rad)中,加入电泳缓冲液(25 mmol/L Tris,250 mmol/ L 甘氨酸,0.1%SDS)。上样,接通电源,浓缩胶在80 V电压条件下,分离胶在120 V电压条件下进行电泳,1.5 h后结束电泳。加入转膜缓冲液,并放入冰袋,整体置于冰盒内,接通电源,在90 V电压下转膜2 h。随后将PVDF膜浸于5%的牛奶中,封闭1 h。根据蛋白marker裁剪PVDF膜,加入用一抗稀释液稀释的抗体,4 ℃摇床温育过夜。隔日,用TBST洗膜3次,每次10 min。室温温育二抗1 h,随后用TBST洗膜3次,每次10 min。最后,化学发光法显色。按照SuperSignal West Dura Extended Duration Substrated的产品说明书配制显色液,加到PVDF膜上,用ImageQuant Las 4000 mini凝胶成像仪检测特异性条带。
1.3.4 细胞增殖实验
将细胞分别以每孔3 000个细胞的密度接种于96孔板,每个时间点做5个平行样本,将培养板在37 ℃、CO2体积分数为5%的条件下培养。分别在0、1、2、3、4、5、6 d上述指定时间向每孔加入10 μL CCK-8溶液,在培养箱内温育2 h。用酶标仪测定在450 nm处的吸光度,计算每5孔的吸光度值的平均值和标准差,绘制细胞生长曲线。
1.3.5 细胞凋亡检测
细胞以每孔2×105密度接种于6孔培养板,将细胞在37 ℃、CO2体积分数为5%的条件下培养24 h后,给予吉西他滨35 μmol/L处理48 h,胰酶消化收集细胞(培养基上清液一起收集),200×g,离心半径140 mm,离心5 min。然后细胞用预冷的PBS洗2遍。用1倍结合缓冲液重悬细胞,调节细胞浓度到1×106/mL。接着,加入5 μL AnnexinV-FITC及1 μL 100 μg/mL的PI工作液,轻轻混匀,避光室温反应15 min。最后,加入1倍结合缓冲液400 μL,轻轻混匀,用流式细胞检测仪器(贝克曼)检测细胞凋亡。CXP 2.1软件分析各个实相的细胞,至少50 000个细胞被检测。
1.3.6 ELISA实验
分别将标本或不同浓度标准品(0 pg/mL孔加试剂稀释液)加入相应孔中(100 μL/孔)用封板胶纸封住反应孔,37 ℃温育90 min。提前准备好抗体工作液,洗板5次,除空白孔外,加入生物素化抗体工作液(100 μL/孔),用封板胶纸封住反应孔,37 ℃温育60 min。提前制备酶结合物工作液,室温避光放置。洗板5次,除空白孔外加入酶结合物液(100 μL/孔),用封板胶纸封住反应孔,37 ℃温育30 min。洗板5次。加入显色底物(包括空白孔)100 μL/孔,37 ℃避光温育15 min。加入终止液100 μL/孔,混匀后即刻测量A450值。
1.4 统计学处理
2 结 果
2.1 耐药细胞株231/Gem的鉴定及特性
将231和相应的231/Gem细胞按2×105接种于6孔板,并在37 ℃、CO2体积分数为5%的培养箱中培养24 h后,给予吉西他滨35 μmol/L处理,72 h后进行凋亡检测,发现231/Gem细胞的凋亡率明显下降,比231细胞下降了28.8%,说明231/Gem耐药性稳定(图 1A)。利用CCK8进行细胞增殖检测发现,与231细胞相比,231/Gem从第4天开始增殖明显加快即随着时间的推移其增殖能力明显增强(图1B)。
2.2 耐药细胞株231/Gem的增殖特性与XCL1的分泌增加相关
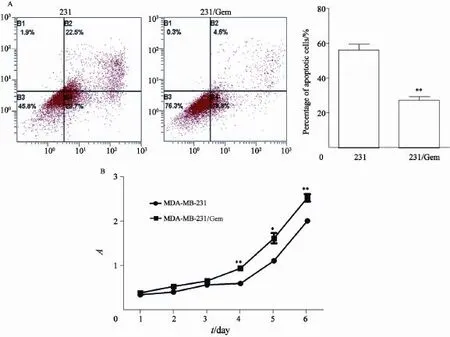
图1 与231相比,231/Gem细胞凋亡减少(A),随时间变化增殖能力明显增强(B)Fig. 1 Apoptosis of 231/Gem was reduced(A) the proliferation of 231/Gem signi fi cantly enhanced over time compare with 231(B)
本实验中,为研究趋化因子与吉西他滨耐药的关系,从亲本细胞231与建立的吉西他滨耐药细胞株231/Gem提取RNA,对趋化因子家族C、CC、CXC、CX3C的代表性趋化因子进行PCR检测,结果发现,与亲本乳腺癌细胞相比,231/Gem细胞株中趋化因子XCL1 mRNA表达水平增高,而其他趋化因子未见分泌增加(图2AB)。ELISA实验证实乳腺癌耐药细胞株中XCL1蛋白水平显著增高(图2C)。为了验证231/Gem的增殖能力与XCL1相关,我们在亲本231细胞株中加入外源性XCL1的重组蛋白,在231/Gem 细胞株中加入抗XCL1的抗体,24 h后发现培液中含XCL1细胞因子的231细胞株增殖能力增强(图2D)。而加入抗XCL1抗体的耐药细胞较231/Gem增殖速度减低(图3A)。这些结果提示,耐药细胞株增殖能力与XCL1的分泌增加相关。
2.3 mTOR信号通路的激活促进XCL1的分泌
Western检测发现,在耐药细胞株中mTOR总蛋白表达水平、mTOR磷酸化水平以及下游蛋白P70S6K的磷酸化水平均比对照组显著增强(图3B),提示耐药细胞株中mTOR信号通路的激活可能与XCL1的分泌增加相关,为了验证这一设想,我们在耐药细胞株中加入mTOR的磷酸化抑制剂(100 nmol/L)——雷帕霉素(Rapamycin),其能抑制mTOR的磷酸化,进而抑制下游效应分子70-KDaS6激酶(P70S6K)的活性,与我们猜测相同的是,耐药细胞株中mTOR磷酸化水平以及下游蛋白P70S6K的磷酸化水平均被抑制(图3C)ELASIA实验证实耐药细胞XCL1分泌下降(图3D)。这些结果提示mTOR信号通路的磷酸化促使XCL1的分泌增多,从而使耐药细胞株的增殖能力增强。
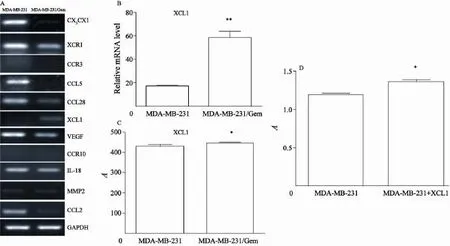
图2 与231相比,231/Gem中XCL1 mRNA表达(A,B)和蛋白质水平(C)均升高,231中加重组XCL1可促细胞增殖(D)Fig. 2 Comparad to 231, mRNA expression(A, B) and protein level(C) of XCL1 in 231/Gem increased. Recombinant XCL1 promoted 231 proliferation (D)
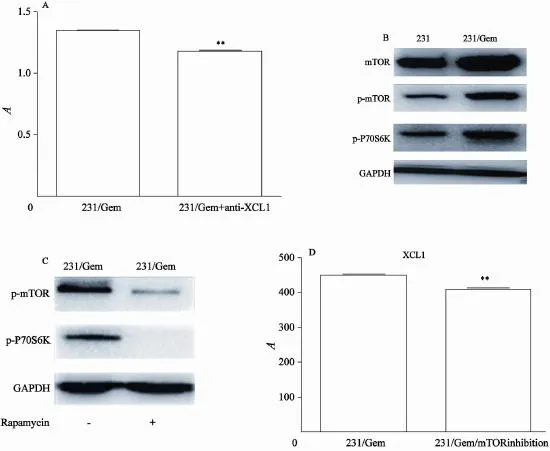
图3 231/Gem中加入抗XCL1抗体可拆抑制细胞增值(A),231/Gem中mTOR及磷酸化P70S6K水平升高(B),mTOR抑制剂rapamycin可逆转之(C),伴XCL1下调(D)Fig. 3 Anti-XCL1 reduced 231/Gem proliferation(A). mTOR and p-P70S6K were higher in 231/Gem(B), mTOR inhibitor rapamycin can invert them(C), and down-regulate XCL1(D)
3 讨 论
乳腺癌是女性发病率最高的恶性肿瘤。近10年来,中国主要城市乳腺癌发病率增加了37%,全国则以3%~4%的水平呈逐年上升趋势[7]。但是,乳腺癌治疗中存在的耐药问题大大影响了化疗药物的临床疗效,是导致乳腺癌临床治疗失败的主要原因之一。因此针对这些问题,我们选用业已建立的耐吉西他滨的乳腺癌细胞株和亲本细胞株作为研究对象,探讨乳腺癌耐药细胞株的增殖特性及其相关的机制。
我们的实验结果显示与亲本乳腺癌细胞株相比,乳腺癌耐吉西他滨细胞株的增殖能力明显增强,这一现象与趋化因子XCL1的表达密不可分。趋化因子是能引起细胞定向迁移的细胞因子,对机体的免疫系统非常重要[8]。XCL1亦称Lymphotactin(Ltn)是C族趋化因子家族的一员,其受体XCR1与XCL1相互作用参与抗原呈递、激活T淋巴细胞和NK细胞,发挥机体的细胞免疫功能,能够调节免疫系统平衡,增强黏膜免疫、抗肿瘤免疫,在感染性疾病过程中诱发炎性反应等[8-10]。本次实验首次发现XCL1可以促进肿瘤细胞尤其是耐药细胞株的增殖,在乳腺癌耐药细胞株中,我们检测到XCL1的表达显著增高,给予XCL1抗体后耐药细胞株的增殖能力明显下降,说明耐药细胞株中XCL1的上调导致其增殖能力增强。
TOR基因是 1991年在酵母中作为雷帕霉素的靶蛋白而被发现的,与酵母 TOR结构和功能相应的哺乳动物的TOR称为mTOR。mTOR被认为是磷脂酰肌醇3-激酶相关激酶蛋白质家族成员[11],它的主要功能是调控蛋白质的合成,调节细胞的生长和增殖[12]。mTOR激酶主要通过2种信号通路调控细胞的生长和增殖:①PI3K/Akt /mTOR通路,Akt可直接磷酸化mTOR的Ser 2448位点,激活mTOR和下游途径,控制细胞增殖和转化所需的特殊蛋白质的翻译[13]。②Akt/TSC1-TSC2/mTOR/S6K通路,结节性脑硬化复合物(TSC)是肿瘤抑制因子,当基因发生突变或缺失时引起细胞黏附、生长和迁移,可导致大脑及肾脏的结节性硬化性损坏。在哺乳动物细胞中,TSC1-TSC2复合物是mTOR的抑制因子,因此在TSC1-TSC2复合物异常的细胞中,mTOR及下游的效应分子被激活,使细胞无限增殖[12-14]。mTOR的激活可以参与体内多条信号通路,影响转录及蛋白质合成。本实验中我们检测到耐药细胞株中mTOR及其活性形式p-mTOR表达增高,推测可能是mTOR信号通路的激活促使耐药细胞株中分泌XCL1增多,从而促进耐药细胞株的增殖。在耐药细胞株中加入mTOR抑制剂后,观察到XCL1的表达显著下降,进一步验证了我们的推测。
虽然目前对于肿瘤耐药机制尤其细胞信号转导通路的认识有限,但有关研究已经或正在为肿瘤治疗带来新的契机。借助肿瘤分子靶向治疗,人们已经开始尝试通过阻断细胞中某些信号转导通路来抑制肿瘤的生长、代谢以及肿瘤血管的生成[15-16]。本研究证实mTOR信号转导通路介导产生XCL1可促进乳腺癌耐药细胞株的增殖,提示趋化因子参与肿瘤耐药,这将为乳腺癌临床治疗提供新的吧点。
[1] LI X, LEWIS M T, HUANG J, et al. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy[J]. J Natl Cancer Inst, 2008, 100(9): 672-679.
[2] RIVERA E, GOMEZ H. Chemotherapy resistance in metastatic breast cancer: the evolving role of ixabepilone[J]. Breast Cancer Res, 2010, 12 Suppl 2: S2.
[3] ZHANG M L, HUANG Z Z, ZHENG Y. Estimates and prediction on incidence, mortality and prevalence of breast cancer in China, 2008[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2012, 33(10): 1049-1051.
[4] WULLSCHLEGER S, LOEWITH R, HALL M N. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3): 471-484.
[5] PORSTMANN T, SANTOS C R, GRIFFITHS B, et al. SREBP activity is regulated by mTORC1 and contributes to Aktdependent cell growth[J]. Cell Metab, 2008, 8(3): 224-236.
[6] SANTEN R J, SONG R X, ZHANG Z, et al. Adaptive hypersensitivity to estrogen: mechanisms and clinical relevance to aromatase inhibitor therapy in breast cancer treatment[J]. J Steroid Biochem Mol Biol, 2005, 95(1-5): 155-165.
[7] SCHERER L D, UBEL P A, MCCLURE J, et al. Belief in numbers: When and why women disbelieve tailored breast cancer risk statistics[J]. Patient Educ Couns, 2013, 92(2): 253-259.
[8] KENNEDY J, KELNER G S, KLEYENSTEUBER S, et al. Molecular cloning and functional characterization of human lymphotactin[J]. J Immunol, 1995, 155(1): 203-209.
[9] KIM M, ROOPER L, XIE J, et al. The lymphotactin receptor is expressed in epithelial ovarian carcinoma and contributes to cell migration and proliferation[J]. Mol Cancer Res, 2012, 10(11): 1419-1429.
[10] BEYER M, KARBACH J, MALLMANN M R, et al. Cancer vaccine enhanced, non-tumor-reactive CD8(+) T cells exhibit a distinct molecular program associated with “division arrest anergy”[J]. Cancer Res, 2009, 69(10): 4346-4354.
[11] HELLIWELL S B, WAGNER P, KUNZ J, et al. TOR1 and TOR2 are structurally and functionally similar but not identical phosphatidylinositol kinase homologues in yeast[J]. Mol Biol Cell, 1994, 5(1): 105-118.
[12] POTTER C J, PEDRAZA L G, XU T. Akt regulates growth by directly phosphorylating Tsc2[J]. Nat Cell Biol, 2002, 4(9): 658-665.
[13] ROBERTSON G P. Functional and therapeutic significance of Akt deregulation in malignant melanoma[J]. Cancer Metastasis Rev, 2005, 24(2): 273-285.
[14] ZHANG H, BAJRASZEWSKI N, WU E, et al. PDGFRs are critical for PI3K/Akt activation and negatively regulated by mTOR[J]. J Clin Invest, 2007, 117(3): 730-738.
[15] GALOIAN K A, TEMPLE T H, GALOYAN A. Cytostatic effect of novel mTOR inhibitor, PRP-1 (galarmin) in MDA 231 (ER-) breast carcinoma cell line. PRP-1 inhibits mesenchymal tumors[J]. Tumour Biol, 2011, 32(4): 745-751.
[16] YUNOKAWA M, KOIZUMI F, KITAMURA Y, et al. Efficacy of everolimus, a novel mTOR inhibitor, against basal-like triple-negative breast cancer cells[J]. Cancer Sci, 2012, 103(9): 1665-1671.
XCL1 mediated by activation of mTOR pathway can promote the proliferation of drug-resistant breast cancer cell
BAI Yu-pan, YANG Xiao-li, OU Zhou-luo
(Breast Cancer Institute, Fudan University
Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
OU Zhou-luo E-mail: ouzhouluo@163.com
Background and purpose: More than 90% of cancer patients are incurable because of drug resistance. Activation of PI3K/Akt/mTOR signaling pathway in breast cancer, as a target for chemotherapy drugs has become a hot topic of breast cancer treatment. This study aimed to investigate the effect and mechanism of XCL1 on the proliferation of drug-resistant breast cancer cell, whether is related with the mTOR signaling pathway. Methods: Established gemcitabine-resistant breast cancer cell lines (MDA-MB-231/Gem). CCK8 to detect the proliferation of MDA-MB-231 and MDA-MB-231/Gem, RT-PCR and ELISA to determine the XCL1 expression level of the two cell lines, Western blot to detect the expression of mTOR. Results: Compared with MDA-MB-231, MDA-MB-231/Gem showed an enhanced proliferative capacity. The expression of XCL1 was increased in the resistant cell lines. Both of protein level and phosphorylation level of mTOR increased in drug-resistant cell lines. The MDA-MB-231 added exogenous XCL1 for 24 h, showed an enhanced cell proliferation. Adding anti-XCL1 antibodies in MDA-MB-231/ Gem could reduce cell proliferation and treating MDA-MB-231/Gem with the mTOR inhibitor could also reduce cell proliferation, as well as the XCL1 expression level. Conclusion: XCL1 promotes the proliferation of drug-resistant breast cancer cells mediated by activation of the mTOR pathway.
MDA-MB-231/Gem; C chemokine ligand 1; mTOR; Breast cancer
10.3969/j.issn.1007-3969.2014.10.010
R737.9
A
1007-3639(2014)10-0770-07
2014-03-24
2014-05-08)
国家自然科学基金资助项目(No:81172506);上海市乳腺肿瘤重点实验室资助项目(No:12DZ2260100)。
欧周罗 E-mail:ouzhouluo@163.com
