多学科综合诊治1例乳腺癌患者分析
2014-06-01
复旦大学附属中山医院普外科,上海 200032
多学科综合诊治1例乳腺癌患者分析
胡光富 王红 朱玮 杨为戈 杨子昂 刘娟 亓发芝 金文 张宏伟
复旦大学附属中山医院普外科,上海 200032
个体化治疗;多学科团队;全程管理;乳腺癌
乳腺癌患者病期较长,综合治疗手段较多,多学科医师共同参与其诊疗过程已成为趋势。因此,遵循国内外诊治指南,实现乳腺癌患者的个体化全程管理显得非常重要。现就复旦大学附属中山医院1例典型乳腺癌患者,结合国内外最新进展、诊治指南,对个体化全程管理诊治过程中的经验进行实例分析。
1 患者资料
患者为女性,30岁,因体检发现左乳肿块2 d于2012年11月19日就诊。13岁初潮、月经规律、未婚育,既往史、家族史无特殊。体格检查:左乳外上及内上象限触及一直径约7 cm×3 cm肿块,质硬,边界欠清,活动度小,无压痛。左腋窝触及数枚肿大淋巴结,活动度好。右腋窝及双锁骨上区未触及淋巴结。彩超显示左乳65 mm×30 mm低回声团块,形态不规则,考虑乳腺恶性肿瘤。胸部X线片、内脏彩超等检查无异常。左乳肿块空心针穿刺活检(core needle biopsy,CNB),病理诊断为浸润性导管癌(invasive ductal carcinoma,IDC),Ⅱ级,免疫组化检测结果显示ER(+),PR(+),HER-2(+++)(图1A),Ki-67(+)30%。分子分型为Luminal B型,分期为cT3N1M0(ⅢA期)。经多学科团队讨论后,2012年11月27日起开始新辅助化疗,方案为FEC→TH,具体为第1天表多柔比星(E) 90 mg/m2,静脉滴注,环磷酰胺(C)600 mg/m2,静脉滴注,5-FU(F)600 mg/m2,静脉滴注,21 d为1个周期,随共3个周期,序贯以第1天多西他赛(T)75 mg/m2,静脉滴注,曲妥珠单抗(H)首剂8 mg/kg,静脉滴注(第2次起改为6 mg/kg),21 d为1个周期,共3个周期,随后第1天曲妥珠单抗6 mg/kg,静脉滴注,28 d为1个周期,用满1年。2013年2月1日行空心针穿刺组织免疫荧光原位杂交( fl uorescence in situ hybridization,FISH)检测:HER-2基因拷贝数2~6,平均2.7,CEP17值1~4,平均1.7,HER-2/CEP17信号比值为1.6,提示HER-2基因无扩增,FISH结果为阴性(图1B)。
多学科团队讨论后建议暂时停用曲妥珠单抗,曲妥珠单抗仅在2013年1月19日第4个疗程化疗时使用1次。2013年1月30日新辅助化疗疗效评估病情达部分缓解(partial response,PR),彩超显示左乳肿块缩小至36 mm× 27 mm。2013年3月12日完成第6个疗程化疗。2013年3月27日新辅助化疗疗效评估病情仍为PR,彩超显示左乳肿块缩小至21 mm×17 mm,癌胚抗原(CEA)40.0 ng/mL(参考值<5 ng/mL)。再次进行多学科团队讨论,决定行手术治疗。2013年3月28日联合整形外科行保留皮肤的左乳癌改良根治+即刻背阔肌肌瓣转移+假体植入I期乳房重建术。术后病理示肿块3 cm×2 cm,IDC,Ⅱ级,部分区见黏液癌成分(约10%),乳头纤维间质内见癌组织浸润,个别脉管内见癌栓,检出淋巴结21枚,其中10枚(10/21)见癌转移,免疫组化检测结果显示ER(++),PR(-),HER-2(++)(图1C),Ki-67(+)5%。进一步行FISH检测:HER-2基因拷贝数1~6,平均2.3,CEP17值1~6,平均2.3,HER-2/CEP17信号比值为1.0,提示HER-2基因无扩增,FISH结果为阴性(图1D)。放疗科及肿瘤内科等多学科团队讨论后,2013年5月9日—7月2日行左胸壁加左腋窝加左锁骨上区三维适形放疗,剂量为50 Gy/25次,5周,2013年7月16日—12月30日行内分泌治疗,方案为他莫昔芬(tamoxifen,TAM)10 mg(每日2次)联合戈舍瑞林3.6 mg(每28 d一次腹前壁皮下注射)。2013年12月17日随访胸部X片示右下肺第5、6肋间可疑结节(图2A),CEA 18.2 ng/mL,其他检查无异常。进一步行CT检查示右肺多发散在类圆形小结节影,边界清晰,右上肺为主,转移性肿瘤可能性大(图2B)。胸外科及影像科等多学科团队讨论后,考虑病灶较小,但由于肺转移不能除外,更改内分泌方案为来曲唑2.5 mg每日1次,联合戈舍瑞林3.6 mg(每28 d一次腹前壁皮下注射),每3个月随访。2014年3月11随访CT检查示两肺多发微小结节,肝右叶见结节影,增强后边缘强化(图2C)。CEA 14.1 ng/mL,其他检查无特殊。2014年3月29日行肝脏MRI平扫加增强示肝右后下叶包膜下见一类圆形异常信号灶,边界欠清,直径约14 mm,T1WI偏低信号,T2WI偏高信号,增强延迟期呈环形强化(图2D),肝转移可能。
肝肿瘤外科等多学科团队讨论后,建议行手术活检。2014年4月10日行腹腔镜肝右叶部分切除术,病理示肝右叶局灶结节性增生(focal nodular hyperplasia,FNH)。术后患者恢复好,继续维持原内分泌方案治疗。随访至2014年6月,与3月相比,肺小结节无改变,肝脏钙化灶,CEA稍回落为11.3 ng/mL。
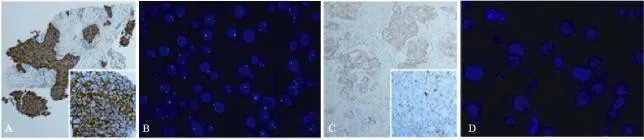
图1 空心针穿刺及术后组织免疫组化及FISH检查Fig. 1 Examination of immunohistochemistry of the tissue by CNB and surgery
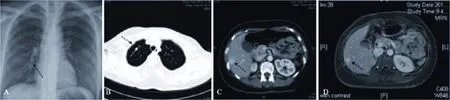
图2 肺及肝脏影像学检查Fig. 2 Imaging examination of the lung and the liver
2 讨 论
乳腺癌的新辅助治疗(neo-adjuvant therapy)又称为初始(系统性)治疗(primary systemic therapy)。其中,乳腺癌的新辅助化疗是乳腺癌新辅助治疗中最重要的内容之一。2013年St Gallen专家共识[1]和2014年美国国立癌症网络(The National Comprehensive Cancer Network, NCCN)乳腺癌临床实践指南[2]对乳腺癌新辅助治疗的个体化方案选择及疗效预测方法等方面作了更新。对于不同分子分型的乳腺癌,应考虑不同方案的新辅助治疗,使患者最大获益[3]。双重HER-2靶点的抑制,可进一步提高病理完全缓解(pathological complete response,pCR)率[4-5]。对于绝经后受体阳性的患者,可考虑单用新辅助内分泌治疗而不用化疗[6]。研究表明70基因较好预后特征、PAM50复发风险评分低、21基因复发分数低的患者相应的pCR率也较低[7-9]。本例患者为年轻女性,IDC,Ⅱ级,临床分期cT3N1M0(ⅢA期)。除肿瘤大小外,患者其他条件均符合保乳手术标准,且希望进行保乳手术。根据指南,考虑给予新辅助化疗基本无争议。基于NSABP B27试验[10]和NOAH试验[11]等循征医学证据,指南推荐新辅助化疗首选紫杉类和蒽环类的化疗方案,并且对HER-2阳性患者,新辅助化疗加用曲妥珠单抗可提高客观缓解率(objective response rate,ORR)和pCR率。本例患者乳腺癌分子分型为Luminal B型,HER-2(+++),为此我们考虑给予患者新辅助化疗方案为FEC→TH。新辅助化疗结束后患者疗效虽未达pCR,但肿块体积缩小超过一半,并且由Ki-67(+)30%变化为Ki-67(+)5%。虽未保乳成功,但成功得实施了Ⅰ期乳房重建术,术后乳房外观满意。
乳腺癌的分子靶向治疗,改善了HER-2阳性乳腺癌患者的预后,影响了乳腺癌的诊治模式。几年来,HER-2检测不断得到标准化、规法化普及提高,HER-2阳性乳腺癌治疗的发展不断更新完善。中国抗癌协会乳腺癌诊治指南与规范2013版[12],指出一般情况下,HER-2的免疫组化检测结果(+)或(+++)时,不需要进一步用FISH来核实HER-2状态。这样也就避免了免疫组化和FISH结果不一致所带来的困扰。但在我国的临床实践中,考虑到花费与获益的权衡时,医师不会反对患者进一步行FISH检查。并且,医师会以FISH检测结果为最终判断标准,本例患者即为此种情况。本例患者为浸润性乳腺癌,穿刺乳腺病理组织免疫组化结果显示HER-2(+++),原发肿块直径>10 mm,符合NCCN指南HER-2阳性判断标准,也符合其推荐的抗HER-2靶向治疗原则。但患者进一步行FISH检测,HER-2基因拷贝数2~6,平均2.7,CEP17值1~4,平均1.7,HER-2/CEP17信号比值为 1.6,提示HER-2基因无扩增,FISH结果为阴性。术后乳腺病理组织免疫组化结果显示HER-2(++),进一步行 FISH检测,HER-2基因拷贝数1~6,平均2.3,CEP17值1~6,平均2.3,HER-2/CEP17信号比值为1.0,提示HER-2基因无扩增,FISH结果为阴性。需要指出的是,因为细胞分子机制的复杂性以及病理技术的局限性,同一标本HER-2的免疫组化与FISH检测并非简单的对应。本例患者两次HER-2的免疫组化染色都比较均匀,而两次的FISH检测HER-2基因拷贝数都有异质性。总之,既要遵循指南又要联系实际,才能真正更好的体现个体化治疗理念的本质。
乳腺癌复发转移是导致乳腺癌患者死亡的主要原因。然而与早期乳腺癌相比,针对进展期乳腺癌(advanced breast cancer,ABC)没有公认的治疗标准,较为全面细致的是2011年欧洲肿瘤学校(European School of Oncology,ESO)国际ABC专责小组确定的进展期乳腺癌国际共识指南(1stInternational Consensus Guidelines for Advanced Breast Cancer,ABC1)[13]。2013年8月30日首届中国进展期乳腺癌会议暨“复发转移乳腺癌的管理和综合治疗进展学习班”在北京召开,起草了中国进展期乳腺癌共识指南(草案)(1stChinese Consensus Guidelines for Advanced Breast Cancer,CABC1)[14]。以上两份指南均建议进行转移病灶的活检以提供组织学检查,特别是首次出现转移的乳腺癌患者。在没有内分泌耐药的证据或需要快速减轻肿瘤负荷的情况下,则内分泌治疗是受体阳性[ER(+)和(或)PR(+)]而HER-2阴性ABC患者的首选治疗[15-16]。对于绝经前乳腺癌患者,内分泌治疗应该联合卵巢抑制和(或)去势,药物选择应为TAM,如果TAM耐药,完全卵巢抑制和(或)去势后可选择芳香化酶抑制剂(aromatase inhibitor,AI)。结合上述两份指南,本例患者两肺多发转移待排时,考虑肺内病灶较小难以活检,我们更换了符合指南推荐的内分泌治疗方案,患者定期随访至今病情平稳。而怀疑肝脏单个病灶转移时,我们进行了腔镜下肝脏病灶整块切除活检,手术属微创。不仅取得了病理标本及时明确了病灶性质,也一次性达到了病灶完全切除的目的,利于进一步的病情评估和治疗,因此也不失为最佳诊治选择。病理结果出乎意料,为FNH,与影像学检查结果不一致。需要指出的是,典型的FNH T1WI、T2WI信号呈等信号,此患者影像学表现不典型,主要是T1WI信号偏低,T2WI信号偏高。且患者肝结节增强延迟期呈环形强化,类似于“牛眼征”。而实际上此环形强化为FNH中央区瘢痕强化。但无论如何,如未行活检而根据影像学检查结果更改治疗方案,患者则会遭受错误的治疗。
乳腺癌全程管理理念建立在乳腺癌个体化、规范化诊疗的基础上,强调将多学科团队模式贯穿于疾病诊断到康复的全过程,主张从系统性长期的角度看待乳腺癌诊治。多学科团队模式以多学科门诊和多学科会议等形式为主,如今已在世界范围被广泛接受。多学科团队模式整合了各相关领域的专家为患者提供一站式服务,对乳腺癌全程管理水平的提高大有裨益[17]。本例患者自确诊为乳腺癌起,至今经历了5次多学科团队讨论,涉及科室包括乳腺外科、肿瘤内科、病理科、影像科、放疗科、胸外科、肝肿瘤外科和整形外科等。每次多学科团队讨论均由患者及家属参与,根据讨论意见及时做出相应的诊治策略,并给予必要的心理疏导与支持。患者在此过程中得到了系统、及时、规范化的治疗,体现了乳腺癌个体化全程管理的诊治理念。
单个典型患者的分析仅是乳腺癌博大精深诊治领域的冰山一角,真正实现乳腺癌的个体化全程管理任重而道远。
致谢 感谢本院病理科侯英勇医师对病理资料撰写提供了细致解答以及影像科叶芳医师对肝脏影像图片误诊原因进行了具体分析。
[1] GOLDHIRSCH A, WINER E P, COATES A S, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J]. Ann Oncol, 2013, 24(9): 2206-2223.
[2] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Breast Cancer Version 3.2014[S/LO]. http:// www.nccn.org/professionals/physican_gls/pdf/breast.pdf
[3] VON MINCKWITZ G, FONTANELLA C. Selecting the neoadjuvant treatment by molecular subtype: how to maximize the benefit? [J]. Breast, 2013, 22 (Suppl 2): 149-151.
[4] BASELGA J, BRADBURY I, EIDTMANN H, et al. Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): a randomised, open-lab el, multicentre, phase 3 trial [J]. Lancet, 2012, 379(9816): 633-640.
[5] GIANNI L, PIENKOWSKI T, IM Y H, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, openlabel, phase 2 trial [J]. Lancet Oncol, 2012, 13(1) : 25-32.
[6] MATHEW J, AGRAWAL A, ASGEIRSSON K S, et al. Primary endocrine therapy in locally advanced breast cancersthe Nottingham experience [J]. Breast Cancer Res Treat, 2009, 113(2): 403-407.
[7] STRAVER M E, GLAS A M, HANNEMANN J, et al. The 70-gene signature as a response predictor for neoadjuvant chemotherapy in breast cancer [J]. Breast Cancer Res Treat, 2010,119(3): 551-558.
[8] PARKER J S, MULLINS M, CHEANG M C, et al. Supervised risk predictor of breast cancer based on intrinsic subtypes[J]. J Clin Oncol, 2009, 27(8): 1160-1167.
[9] GIANNI L, ZAMBETTI M, CLARK K, et al. Gene expression profiles in paraffin-embedded core biopsy tissue predict response to chemotherapy in women with locally advanced breast cancer [J]. J Clin Oncol, 2005, 23(29): 7265-7277.
[10] RASTOGI P, ANDERSON S J, BEAR H D, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27 [J]. J Clin Oncol, 2008, 26(5): 778-785.
[11] GIANNI L, EIERMANN W, SEMIGLAZOV V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort [J]. Lancet, 2010, 375(9712): 377-384.
[12] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2013版)[J]. 中国癌症杂志, 2013, 23(8): 637-693.
[13] CARDOSO F, COSTA A, NORTON L, et al. 1st International consensus guidelines for advanced breast cancer (ABC 1)[J]. Breast, 2012, 21(3): 242-252.
[14] 李惠平, HOPE S, 等. 首届中国进展期乳腺癌共识指南(草案)[J]. 癌症进展, 2013(6): 500-505.
[15] NABHOLTZ J M, BUZDAR A, POLLAK M, et al. Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. Arimidex Study Group[J]. J Clin Oncol, 2000, 18(22): 3758-3767.
[16] BONNETERRE J, THURLIMANN B, ROBERTSON J F, et al. Anastrozole versus tamoxifen as first-line therapy for advanced breast cancer in 668 postmenopausal women: results of the Tamoxifen or Arimidex Randomized Group Efficacy and Tolerability study [J]. J Clin Oncol, 2000, 18(22): 3748-3757.
[17] MUNSHI A, SENGAR M. Multidisciplinary care in oncology: Are we united? [J]. Acta Oncol, 2011, 50(2): 314-316.
10.3969/j.issn.1007-3969.2014.09.012
R737.9
A
1007-3639(2014)09-0713-04
2014-05-17
2014-08-04)
张宏伟 E-mail:zhang·hongwei@zs-hospital.sh.cn
