互花米草入侵对西门岛潮滩底栖食物网的影响
2014-05-30温作柱廖忠鹭
温作柱,廖忠鹭,李 平,商 栩
(温州医科大学,浙江 温州 325000)
作为海陆过渡带,人类活动对湿地的影响较为剧烈,使其生态环境脆弱,自然灾害频繁,是全球变化的敏感区域[1]。基于海岸防护、保滩促淤的目的,我国于1972年从原产地美国引入互花米草(Spartina alterniflora),目前已分布到我国沿海的大部分淤泥质滩涂上,北从天津,南至广西都形成面积大小不等的互花米草潮滩湿地[2]。由于互花米草适应范围广繁殖能力强,其种群已对我国潮滩湿地生态系统构成严重威胁,成为入侵我国沿海潮滩影响最严重的外来植物[3]。
近几十年来,生态学家试图阐明互花米草入侵的生态后果,包括植物的竞争、当地生物多样性的改变、生境的退化和生物地球化学过程的改变等[4-7]。其中互花米草对底栖生态群落的影响受到广泛关注。沈永明等[6]认为,江苏省海岸的互花米草使滩面淤高,在侵蚀型岸段,互花米草的入侵会使泥螺、四角蛤蜊、文蛤等滩涂贝类的生存场所消失;但也有人认为,互花米草入侵后可能提高原有底栖群落物种丰度和多样性。然而,关注这种外来植物入侵对盐沼湿地营养功能和基础影响的研究相对较少[8-9],加之对本土潮滩湿地底栖食物网结构认识的不足,为深入探讨入侵生物可能导致的危害造成了瓶颈。此外,不管是土著植物还是入侵植物,都会因其高生物量而习惯性地被认为是此处食物网的营养基础。大量研究表明,微型藻类才是潮滩食物网的能量来源。鉴于微型藻类和植物碎屑之间能量基础的争论以及目前不同初级生产者对底栖食物网贡献大小认识不足,本研究通过估算不同初级生产者对底栖食物网中各消费者的优势种类的相对营养贡献大小,评价互花米草在潮滩湿地底栖食物网的地位和作用,从底栖动物营养来源的角度阐述互花米草入侵后对潮滩湿地生态系统及滩涂养殖业的影响。
1 材料与方法
1.1 样品采集
西门岛潮滩湿地原本是温州典型的红树林湿地,互花米草入侵后,迅速扩张,红树林湿地很快被互花米草覆盖,成为入侵严重的典型区域。
分别于2011年3-4月在乐清湾西门岛潮滩湿地采集底栖微藻 (MPB)、土著红树植物秋茄(Kandelia candel)、入侵植物互花米草等初级生产者样品,以及小型和大型底栖动物、游泳动物等消费者类群的代表种类样品。其中底栖微藻采用Blanchard等[10]的方法收集后,过滤到 Whatman 0.45 μm GF/F滤膜上,于-20℃下避光冷冻保存。悬浮颗粒物 (POM)则直接过滤到GF/F模上,于-20℃下避光冷冻保存。秋茄和互花米草叶片从采样点不同簇个体中手工摘取,于现场潮沟水中洗净后冷冻保存。
浮游动物样品于潮沟中用孔径160 μm的浮游生物采集网在水体表层进行水平拖网采集获得,活体带回实验室后于XTL-3400体视显微镜下挑出优势种类个体。包含小型底栖动物的沉积物样品,经上层1mm,下层50 μm的套筛淘洗后,将留于50 μm筛网上的线虫 (Nematoda)和猛水蚤 (Harpacticoid spp.)于体视显微镜下分别挑出。以上小型消费者均活体于过滤后的现场海水中过夜,以排空肠道,在-20℃下避光冷冻保存。优势腹足类短拟沼螺 (Assiminea brevicula)、织纹螺(Nassariidae),优势双壳类缢蛏(Sinonovacula constricta)、菲律宾帘蛤 (Ruditapes philippinarum),优势底栖鱼类大弹涂鱼(Periophthalmini)的样品均为手工从潮滩、潮沟表面采集。优势短尾类甲壳动物谭氏泥蟹(Ilyoplax deschampsi)、招潮蟹 (Uca)以及沙蚕(Nereis)和纽虫 (Nemertina)用小刀从中潮滩和潮沟边滩沉积物中挖出。优势双壳类、寡毛类则用孔径为1mm的筛网淘洗潮沟底部沉积物获得,并于-20℃下避光冷冻保存。
1.2 样品处理
所有植物样品经自来水冲洗干净后,再用Milli-Q水清洗,以去除其附着物,在60℃烘箱内干燥48 h,然后用不锈钢粉碎机进行粉碎。滤有底栖微藻的GF/F滤膜在60℃下烘干24 h。因浮游动物和小型底栖动物的单个个体不足以提供足够的生物量用于稳定同位素测定,所以根据其个体大小选取10~100只合并为1个样品,用Milli-Q水清洗后于60℃下烘干24 h。对个体较大的大型底栖动物和游泳动物则分别分离其腹足部分 (腹足类和双壳类)、大螯 (蟹)和背部 (鱼)的肌肉,用Milli-Q水漂洗后于60℃下烘干24 h,并研为粉末。所有样品烘干前均在体视显微镜下将混杂的贝壳、骨骼及碎屑等挑出。由于酸洗过程被认为对δ13C值的影响显著,并可能明显改变δ15N值,且酸洗可能造成平行样品间所测得δ13C和δ15N的值差异增大,由此所有动物和植物样品均未作酸化处理[11-12]。
1.3 稳定同位素测定及数据分析
稳定同位素的测定通过同位素质谱仪 (Delta plus XP Finnigan)完成,其中用于δ13C测定所需要的干重样品量0.2~0.3mg,δ15N测定所需要的干重样品量0.5~1.0mg。同位素丰度计算方法:
δX/% = [(Rstandard/Rstandard)-1]× 103。
式中,X=13C或15N,R=13C/12C或15N/14N,标准采用的是PDB国际通用标准 (Pee Dee Belelmnite标准)。δ13C的分析精度为 ±0.01%,δ15N的分析精度为±0.02%。
测得的碳、氮稳定同位素用 IsoSource(http://www. epa. gov/wed/pages/models/stableIsotopes/isotopes.htm)对各初级生产者的营养贡献进行分析。IsoSource方法是将各种源的组成比例之和定为100%,首先以预先定制的增量(Source increment,通常设为1%)把所有可能的组合计算出来,然后用基于质量守恒方程基础上的线性混合模型计算各种组合中得到的混合物的预期稳定同位素值。将计算得到的混合物稳定同位素值与实际测定值进行比较,则在一定容差范围 (如0.01%)内,所有符合实际稳定同位素值的计算所得组合就反映了各种源在混合物中所占比例。当实际应用于食物网研究时,由于δ13C和δ15N在摄食过程中存在逐营养级分馏现象,因此在进行IsoSource分析时需根据不同消费者及其送测组织的稳定同位素分馏特征扣除富集值。
本文使用的δ13C逐营养级富集为0.1%,δ15N则为0.34%。分别把互花米草、秋茄、悬浮颗粒有机物和底栖硅藻等4个源作为主要有机质食物源。参考Benstead等[13]研究方法,计算中将增量设为1%,容差初始设为0.01%,但如果混合物的同位素值超出了计算阈值,即超出了由食物网中的若干个源所组成的多边形[14],则将容差最多增加到0.05%。
2 结果与分析
2.1 各主要初级生产者的δ13C和δ15N值
碳、氮稳定同位素测定结果显示 (表1),各初级生产者的 δ13C值范围较广 (-2.6% ~-1.3%),且新鲜植株和枯萎植株的δ13C值差异不大。外来C4植物互花米草比土著C3植物秋茄有显著富集的δ13C值 (-1.34%)。
底栖微藻 (MPB)和悬浮有机颗粒 (POM)的δ13C值均介于C3和C4植物间且差异不大。6种初级生产者δ15N值均在0.27% ~0.58%,相比δ13C,各初级生产者间 δ15N差异不明显(表2)。
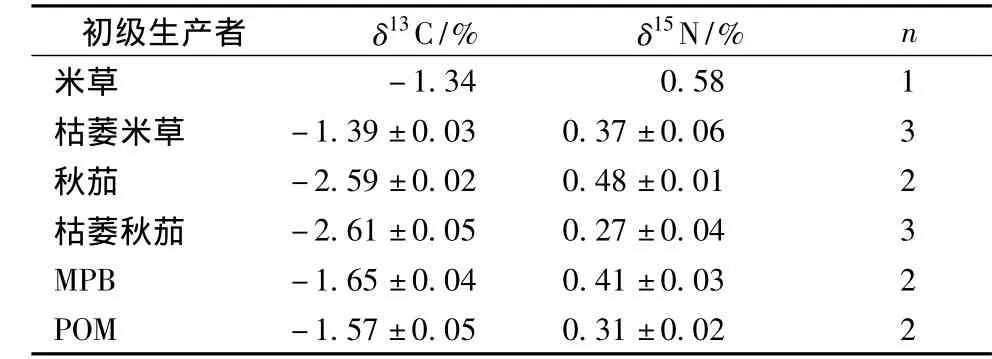
表1 各初级生产者碳、氮稳定同位素值
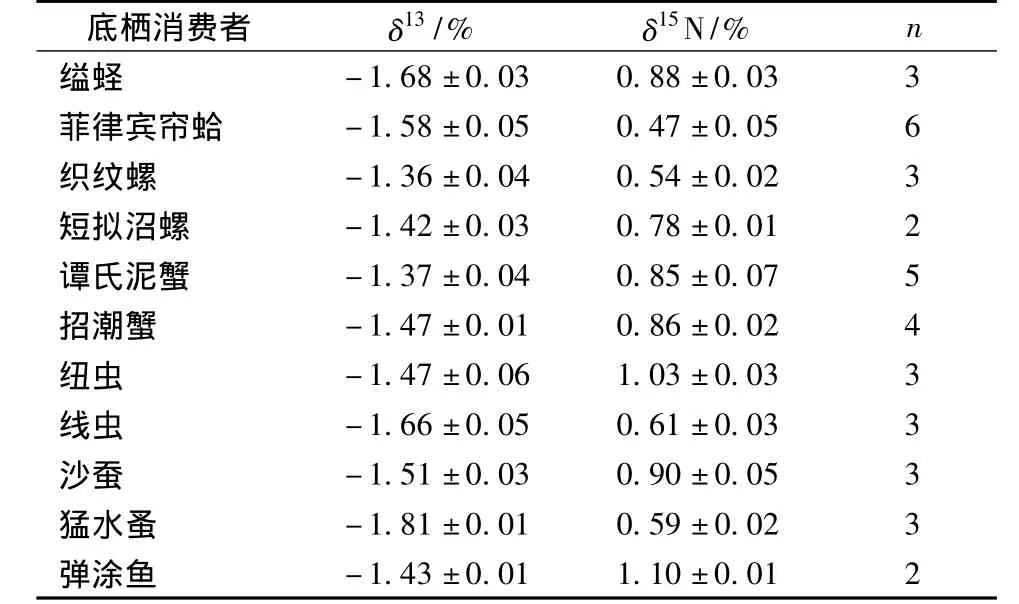
表2 各底栖消费者碳、氮稳定同位素值
2.2 各主要底栖消费者的δ13C和δ15N值
表2显示,各底栖动物间δ13C值差异不大(-1.8%~-1.3%)。其中小型底栖动物猛水蚤具有最贫δ13C值 (-1.81±0.01)%,此外小型底栖动物线虫δ13C值为 (-1.66±0.05)%。大型底栖动物中织纹螺具有最富 δ13C值 (-1.36±0.04)%,几乎与米草δ13C值重叠 (图1)。其他大型底栖动物的δ13C值分布各异,基本上介于MPB和米草之间 (图1)。西门岛潮滩湿地主要底栖消费者的δ15N值介于0.47% ~1.10%,显示该食物网中可能存在多个营养级,弹涂鱼是本研究涉及生物中营养级最高的。
2.3 西门岛滩涂湿地主要生产者和底栖消费者δ13 C和δ15N的关系
从西门岛潮滩湿地食物网各主要生产者和底栖消费者的碳、氮稳定同位素特征图 (图1)可以看出,大部分底栖动物的δ13C值均处于MPB和C4植物米草之间,表明δ13C值稍贫的MPB必然存在于这些底栖动物的食谱中。而POM的δ13C值与MPB非常接近,也可能是一些底栖动物的食物来源。而小型底栖动物猛水蚤的δ13C值略高于MPB,落在秋茄和MPB之间,表明δ13C值最贫的C3植物秋茄也可能对其有一定的营养贡献。
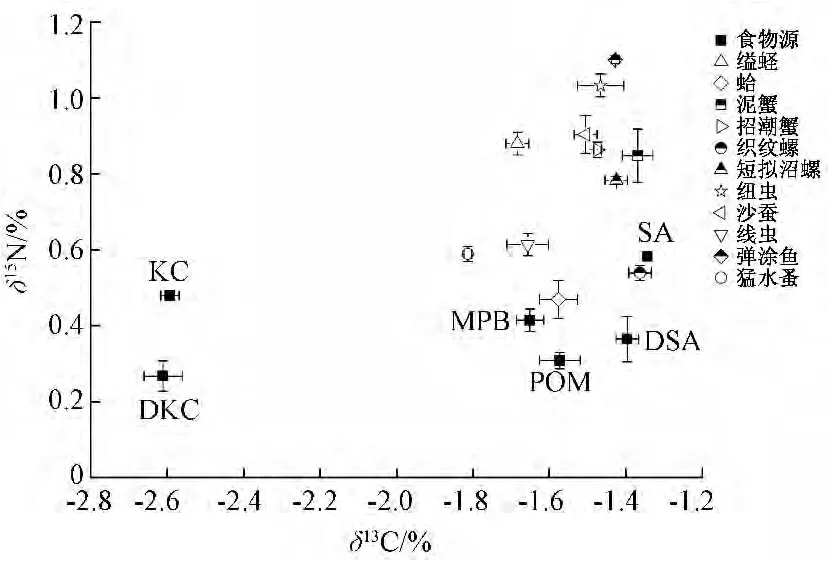
图1 西门潮滩沼湿地各主要初级生产和优势底栖消费者δ13C和δ15N的关系
为了更加清晰地看出各生产者和底栖消费者之间的营养特征,绘制出扣除营养富集值后的碳、氮稳定同位素特征校正图 (图2)。
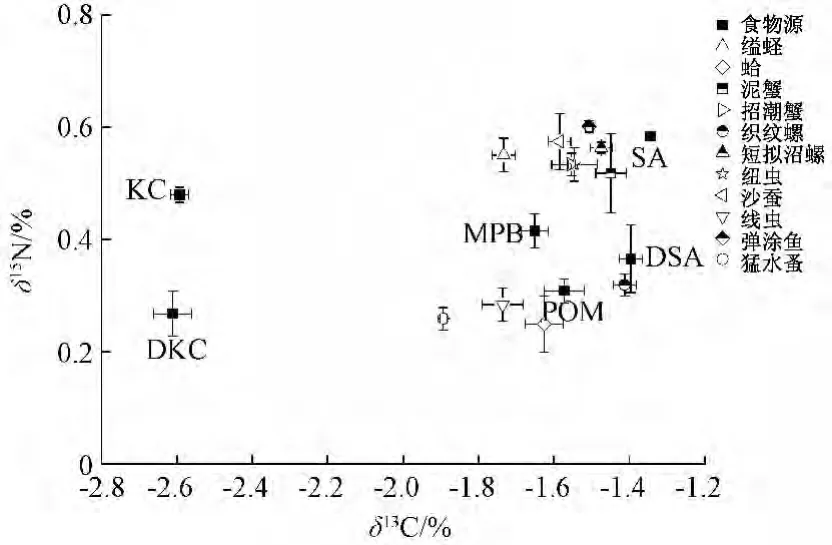
图2 西门岛潮滩湿地各主要初级生产和优势底栖消费者δ13C和δ15N的关系 (校正后)
图2显示,大部分大型底栖消费者的碳、氮稳定同位素特征分布非常接近米草,表明C4植物互花米草很可能是这些大型底栖消费者重要的营养来源;与其他大型底栖动物不同,菲律宾帘蛤和小型底栖动物猛水蚤、线虫的稳定同位素特征更靠近POM,表明这些底栖消费者更多从POM(或者浮游植物)获取营养支持。相反,C3植物秋茄的δ13C值远低于这些底栖消费者 (差值≥0.8%),不大可能成为其营养来源。MPB在整个生产者和底栖消费者的稳定同位素特征分布中处于居中的位置,不能排除其对整个底栖食物网的营养贡献。
2.4 Isosource计算所得各初级生产者对消费者的可能营养贡献
图3显示了6种初级生产者对11中底栖消费者营养贡献的可能范围。从图可以看出,C4植物互花米草新鲜植株对7种大型底栖动物 (弹涂鱼、短泥沼螺、谭氏泥蟹、缢蛏、纽虫、沙蚕、招潮蟹)各自的平均营养贡献在66.2%以上,其中对谭氏泥蟹的最小贡献最低,但也高达58%,反映出入侵C4植物互花米草对这些大型底栖动物较为重要的营养地位。新鲜互花米草对其他4种底栖动物各自最大贡献可能都很低 (<12%),且其最小贡献可能均为0,表现出较为不重要的营养地位。但是计算所得枯萎米草对织纹螺的贡献可能为47%~100%,营养地位明确;虽然枯萎米草对蛤有着相对高的最大贡献可能 (52%),但其为0的最小贡献可能,使得营养地位无法确定。与C4植物互花米草相比,不管是新鲜或者枯萎的秋茄,虽然其对一些底栖动物 (例如沙蚕、缢蛏和猛水蚤)有着较为明确的营养贡献 (分别为14% ~20%,26% ~32%,22% ~40%),但总体上C3植物秋茄对整个底栖食物网的营养贡献偏低,反映其较低的营养重要性。底栖微藻 (MPB)对所有底栖动物的最大贡献均不高 (最大为37%),且最小贡献可能均为零,反映其较为有限的营养贡献。POM对2种小型底栖动物 (猛水蚤和线虫)的营养地位较为明确 (营养贡献可能分别为31% ~73%,53%~87%);而对蛤的贡献可能为27% ~100%,可能有一定的营养地位,但其较大的贡献分布跨度增大了POM对这种底栖动物营养地位的不确定性。
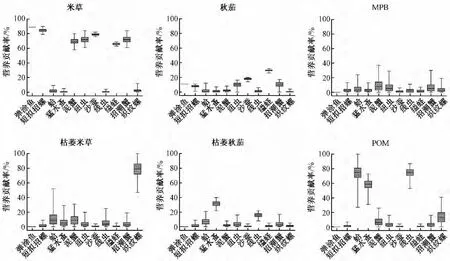
图3 西门岛盐沼湿地各初级生产者对底栖消费者的营养贡献
3 小结和讨论
3.1 不同初级生产者的相对营养贡献
维管植物和微型藻类对潮滩湿地食物网的相对重要性目前仍有争论[15-18]。相比维管植物纤维质的细胞壁,主要由硅藻组成的底栖微藻的外壳是较易被消化的硅质薄壳,单细胞的底栖微藻更容易被底栖消费者摄取。由此长久以来湿地研究者就推测底栖微藻对盐沼消费者有着更高的营养价值[15]。然而本研究结果显示,在西门岛潮滩湿地底栖食物网中,互花米草可能是大型底栖动物更为重要的营养来源,而底栖微藻的营养贡献则非常有限。这可能是由于在该处潮间带区域高密度的互花米草覆盖了滩涂表面,使得互花米草丛中的底栖微藻难以获得足够的光照而无法提供较高的生产力和生物量。此外也有研究指出,互花米草入侵可能改变原有食物网的能量基础,由入侵前以藻类为主转变为以有机碎屑为主要食源[19]。这种食物网能量基础的改变至少部分被上行效应所调控,即底栖微藻生物量的降低和植物碎屑数量的增加改变了盐沼湿地消费者的食源构成[19],驱动大型底栖动物同化更多的互花米草有机碎屑,甚至其营养比重超过底栖微藻。
浮游植物细胞 (直径2~15 μm)通常较小,除悬浮物取食者 (双壳类)外,潮滩湿地上的沉积物取食者 (如螺类和蟹类)并不能有效滤食水体中的浮游藻类[20]。另外,由于较短的潮淹时间,生活于高、中潮区的大型无脊椎动物很少能够有效地利用水体中的浮游植物初级生产。本研究结果显示,POM与MPB一样,对绝大多数大型底栖动物(除蛤外)的营养贡献非常有限;然而,对小型底栖动物 (猛水蚤和线虫)的营养比重却截然不同:浮游植物可能是这2种小型底栖动物最主要的食物来源。尽管沉积食性动物摄取浮游植物的效率比滤食性动物低,但沉积到潮滩上的浮游植物仍可能在底栖猛水蚤的食谱中占有一定比重[21],而自由生活的线虫同样可能利用这些沉积下来的易分解的有机碳[22]。
尽管有人认为C3植物和米草共同出现在同一潮滩湿地时,C3植物的营养贡献可能超过米草[23],相比米草难以分解的木质素组成,其有机产出更容易通过细菌途径被利用[24]。但是,IsoSource计算结果显示,土著C3植物对整个底栖食物网的营养贡献并非如想象的重要,仅对一些底栖动物 (缢蛏、沙蚕、猛水蚤、线虫)有着相对明确的营养贡献 (图3),但与米草和POM相比,C3植物更可能是作为补充性的食物来源。
3.2 互花米草入侵对盐沼底栖食物网的影响
米草入侵后改变当地原有的底栖动物组成和数量的事例众多,也有学者预测其可能改变食物网结构[25-26]。但近期才有少数研究关注到米草入侵后对原有营养结构造成的影响,并证明盐沼生态系统中存在着由营养基础自下而上对底栖动物群落结构的控制[19]。虽本研究并未调查原有土著C3植物群落中底栖动物的生物组成和营养结构,但调查中发现,土著红树植物秋茄的分布非常稀疏,互花米草已占据绝大部分滩面。互花米草强大的竞争优势及其快速扩张显著压缩了原有C3植物和底栖微藻的生长空间,进而可能改变生活在该湿地内许多土著动物的食物基础。
对西门岛潮滩湿地中主要生产者和消费者的稳定同位素分析显示,入侵种互花米草是这一区域底栖食物网最重要的食物来源之一。优势种中仅有2种小型底栖动物 (猛水蚤和线虫)和1种双壳类 (蛤)未表现出对互花米草的明显摄取,互花米草对西门岛盐沼湿地中的营养地位与其原产地相似。这一结果表明,对于绝大多数的大型底栖动物来说,外来种互花米草已成为其重要的食物源,因此对于这些大型底栖动物的生存可能暂时未受到威胁。但与Levin等[19]在旧金山海湾盐沼湿地的发现类似,西门岛潮滩湿地中一些重要的次级生产者 (蛤、猛水蚤、线虫)并没有或者很少摄入入侵植物 (互花米草)的有机碳,这可能会导致一些关键物种的消失,并进而影响其他物种乃至整个生态系统结构和功能,引起滨海养殖业的经济创伤。
[1]Hassen M B.Spatial and temporal variability in nutrients and suspended material processing in the Fier d'Ars Bay(France)[J].Estuarine,Coastal and Shelf Science,2001,52(4):457-469.
[2]徐国万,卓荣宗.我国引种互花米草的初步研究.南京大学学报 (米草研究的进展:22年来的研究成果论文集)[M].南京:南京大学出版社,1985:212-225.
[3]郭云文,陈莉丽,卢百灵,等.我国对互花米草的研究进展[J].草业与畜牧,2007(9):1-6.
[4]Fell P E.Does invasion of oligohaline tidal marshes by reed grass,Phragmites australis(Cav.)Trin.ex Steud.,affect the availability of prey resources for the mummichog,Fundulus heteroclitus L? [J].Journal of Experimental Marine Biology and Ecology,1998,222(2):59-77.
[5]Wei J S,Weis P.Is the invasion of the common reed,Phragmites australis,into tidal marshes of the eastern US an ecological disaster?[J].Marine Pollution Bulletin,2003,46(7):816-820.
[6]沈永明,刘咏梅,陈全站.互花米草盐沼土壤有机质分布特征 [J].海洋通报,2003,22(6):43-48.
[7]Netto S A,Lana P C.The role of above-and below-ground components of Spartina alterniflora (Loisel)and detritus biomass in structuring macrobenthic associations of Paranaguá Bay (SE, Brazil)[J]. Hydrobiologia, 1999, 400:167-177.
[8]商栩,管卫兵,张国森,等.互花米草入侵对河口盐沼湿地食物网的影响 [J].海洋学报,2009,31(1):132-141.
[9]全为民.长江口盐沼湿地食物网的初步研究:稳定同位素分析[D].上海:复旦大学,2007.
[10]Blanchard G F,Guarini J M,Dang C,et al.Characterizing and quantifying photoinhibition in intertidal microphytobenthos[J].Journal of Phycology,2004,40(4):692-696.
[11]Bunn S E,Loneragan N R,Kempster M A.Effects of acid washing on stable isotope ratios of C and N in penaeid shrimp and seagrass:Implications for food-web studies using multiple stable isotopes[J].Limnology and Oceanography,1995,40(3):622-625.
[12]Bosley K L,Wainright S C.Effects of preservatives and acidification on the stable isotope ratios(15N:14N13C:12C)of two species of marine animals [J].Canadian Journal of Fishery Aquatic Science,1999,56(11):2181-2185.
[13]Benstead J P,March J G,Fry B,et al.Testing IsoSource:stable isotope analysis of a trophical fishery with diverse organic matter sources[J].Ecology,2006,87(2):326-333.
[14]Phillips D L,Gregg J W.Source partitioning using stable isotopes:coping with too many sources [J].Oecologia,2003,136(2):261-269.
[15]Teal J M.Energy flow in the salt marsh ecosystem of Georgia[J].Ecology,1962,43(4):614-624.
[16]Haines E B.The origins of detritus in Georgia salt marsh estuaries[J].Oikos,1977,29(2):254-260.
[17]Paterson A W,Whitfield A K.A stable carbon isotope study of the food-web in a freshwater-deprived South African estuary,with particular emphasis on the ichthyofauna [J].Estuarine Coastal and Shelf Science,1997,45(6):705-715.
[18]Bouillon S,Koedam N,Raman A V,et al.Primary producers sustaining macro-invertebrate communities in intertidal mangrove forests[J].Oecologia,2002,130(3):441-448.
[19]Levin L A,Neira C,Grosholz E D.Invasive cordgrass modifies wetland trophic function [J].Ecology,2006,87(2):419-432.
[20]Kreeger D A,Newell R I E.Trophic complexity between producers and invertebrate consumers in salt marshes[C] //Weinstein M P,Kreeger D A.Concepts and Controversies in Tidal Marsh Ecology.Dordrecht:Kluwer Academic Publishers,2000:187-220.
[21]Buffan-Dubau E,Carman K R.Diel feeding behavior of meiofauna and their relationships with microalgal resources[J].Limnol Oceanogr,2000,45(2):381-395.
[22]Moens T,Luyten C,Middelburg J J,et al.Tracing organic matter sources of estuarine tidal flat nematodes with stable carbon isotopes [J].MarEcolProgSer,2002,234:127-137.
[23]Wainright SC, WeinsteinM P, AbleK W.Relative importance ofbenthic microalgae,phytoplankton and the detritus of smooth cordgrass Spartina alterniflora and the common reed Phragmites australis to brackish-mash food webs[J].Marine Ecology Progress Series,2000,200:77-91.
[24]Boschker H T S,de Brouwer J F C,Cappenberg T E.The contribution of macrophyto-derived organic matter to microbial biomass in salt-marsh sediments:Stable carbon isotope analysis of microbial biomarkers [J].Limnol Oceanogr,1999,44:309-319.
[25]Hedge P,Kriwoken L K.Evidence for the effects of Spartina anglica invasion on benthic macrofauna in Little Swanport estuary,Tasmania [J].AustEcol, 2000, 25(2):150-159.
[26]Simenstad C A,Thorn R M.Spartina alterniflora(smooth cordgrass)as an invasive halophyte in Pacific Northwest Estuaries [J].Hortus Northwest:A Pacific Northwest Native Plant Directory & Journal,1995(6):9-12.
