山茱萸叶片DNA提取方法及ISSR反应体系构建
2014-05-29董博文管少花董卉卉赵志浩李继东
董博文,管少花,董卉卉,赵志浩,李继东
山茱萸叶片DNA提取方法及ISSR反应体系构建
董博文1,管少花1,董卉卉2,赵志浩1,李继东1
(1.河南农业大学,郑州 450002;2.信阳市林业科学研究所,河南 464031)
山茱萸成熟叶片中多糖及多酚类物质含量较高,传统CTAB法提取其叶片DNA效果较差,该研究在传统的CTAB提取法的基础上进行了改良,经DNA原液电泳检测及PCR产物的电泳检测表明,该法适用于提取硅胶快速干燥保存的山茱萸叶片的DNA。在此基础上,对山茱萸ISSR反应体系中的退火温度、引物浓度及模板用量进行了筛选,结果表明,在25μL的反应体系中,引物UBC847的最佳退火温度为55.2℃,引物最佳浓度为0.8μmol/L,模板最佳用量为70 ng,初步构建了山茱萸ISSR反应体系。
山茱萸;DNA提取;ISSR
山茱萸,山茱萸科()山茱萸属,又名枣皮、山萸肉等,以果实入药,是我国传统名贵中药材[1]。其药用功效在《神农本草经》、《吴普本草》等典籍中均有记载[2]。近几年,山茱萸由于其药用价值,带来了较高的经济效益,其种质资源较为丰富但良莠不齐,利用DNA分子标记,为分子水平上进行山茱萸的品种选育奠定基础,而进一步提高山茱萸的经济效益成为了亟待解决的问题。
山茱萸成熟叶片中有较高含量的多糖、多酚类等杂质,对其DNA提取造成了一定困难,本实验在对传统的CTAB法提取过程中出现的问题以及提取后的产物进行分析后,对该方法做出了改良,最终建立了适用于山茱萸成熟叶片的DNA提取方法。
ISSR是近年来在微卫星技术上发展起来的一种新型的分子标记技术,其以多态性高、操作简单、可重复性强、成本低等特点,被广泛应用于种质资源鉴定[3]、遗传作图[4]、遗传多样性[5]等方面的研究。研究以山茱萸成熟叶片基因组DNA为模板,哥伦比亚大学公布的引物序列UBC847对山茱萸ISSR反应体系进行构建,以期对其做分子评价奠定基础。
1 材料与方法
1.1 材料
试验所用山茱萸材料采自河南伏牛山山茱萸主产区西峡县太平镇,所采叶片迅速放入保鲜袋,加变色硅胶后封口保存。
1.2 试剂
实验所用的引物、PCR Master Mix、DNA marker(DL2000)均购自上海生工生物工程技术服务有限公司
1.3 DNA提取方法
参考李继东[6]的方法并改进。
研磨样品(0.1 mg),研磨时加入少量PVP,装入2 mL离心管。加入700μL预处理液(2%β-巯基乙醇,2%PVP,100 mmol/L EDTA,pH 8.0),离心10 min(10 000 r/m),弃去上清。加入700μL 65℃预热2%CTAB裂解液,充分混合后65℃水浴60 min,10 min混匀1次。水浴结束后加入700μL酚︰氯仿︰异戊醇(25︰24︰1),充分混合后离心10 min(12 000 r/m),取上清。加入2倍体积-20℃无水乙醇,-20℃放置30 min,离心,弃上清。风干后加入700μL无菌水溶解,加入700μL氯仿︰异戊醇(24︰1),充分混合后取上清。再次加入2倍体积-20℃无水乙醇,-20℃放置30 min,离心,弃上清,用75%的乙醇漂洗3次,风干后加入150~200 v无菌水溶解,保存在-20℃冰箱备用。
1.4 DNA电泳检测
DNA浓度和纯度用NanoDrop 2000超微量分光光度计检测,并稀释至50 ng/L,检测OD260nm/280nm;2%琼脂糖凝胶检测DNA分子量和降解程度。
1.5 ISSR-PCR反应体系设计
实验采用的PCR Master Mix可直接使用,故实验中只对退火温度、引物浓度以及模板用量进行筛选,退火温度设置了54.2℃、54.7℃、55.2℃、55.7℃、56.2℃、56.7℃共6个梯度,引物浓度设置了0.4μmol/L、0.6μmol/L、0.8μmol/L、1.0 μmol/L,模板用量设置了50 ng、60 ng、70 ng、80 ng,PCR Master Mix10μL,用无菌水补至反应体系为25μL。
1.6 ISSR-PCR扩增程序
在PTC-200基因扩增仪上进行反应,扩增程序为:94℃预变性10 min;94℃变性30 s,55.2℃复性1 min,72℃延伸1 min,40个循环;72℃延伸10 min;4℃保存[7]。2%琼脂糖凝胶电泳检测扩增产物。
2 结果与分析
2.1 DNA浓度与纯度检测
在表1中可以看出改进的CTAB法无论在浓度与纯度上比较,效果都远远超出了传统的CTAB法,这可能是因为前期磨样和预处理液中加的PVP较好的除去了多酚类杂质。

表1 改良CTAB 与常规CTAB 法提取效果
2.2 琼脂糖凝胶电泳检测DNA样品

图1 山茱萸叶片DNA琼脂糖凝胶电泳
M为IIIDNA marker; 第1~4泳道为改良CTAB法;第5~8泳道为常规CTAB法
由图1能够看出改良的CTAB法提取的DNA在电泳中的条带明亮、清晰,而常规CTAB法提取的DNA样品条带模糊不清,这可能是由于蛋白质、多糖、多酚类污染严重所导致的。
2.3 退火温度的优化
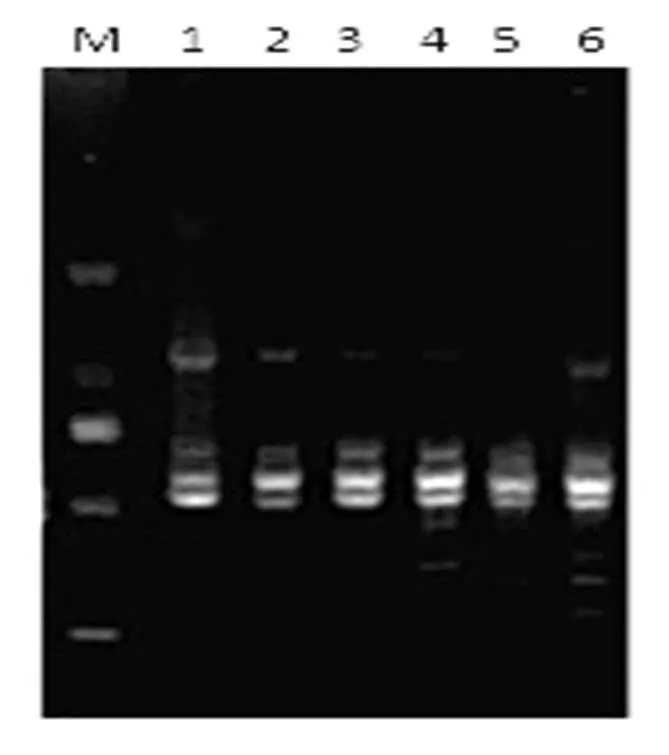
图2 ISSR-PCR反应体系中不同退火温度的扩增结果
M. Marker (D2000);1-6. 54.2℃、54.7℃、55.2℃、55.7℃、56.2℃、56.7℃,primer 847
退火温度是影响PCR产物的重要因素,过高会导致多态性低,而过低则会导致特异性差,主带不明显,由图2中可以看出退火温度为55.2℃和55.7℃时条带清晰且有特异性条带,低于55.2℃时条带特异性差,且主带有弥散现象,而高于55.7℃时条带不清晰,且多态性差。
2.4 模板用量的优化
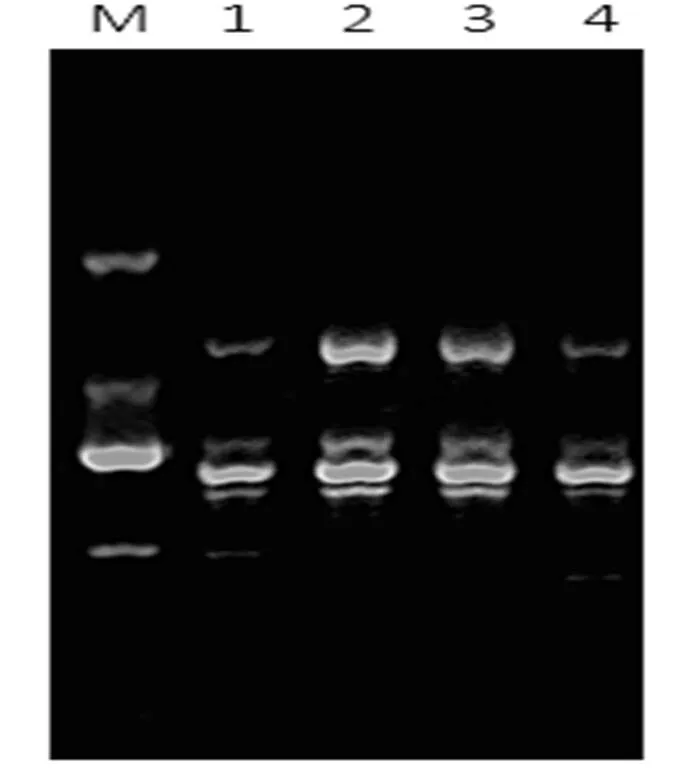
图3 ISSR-PCR反应体系中不同模板DNA浓度的扩增结果
M. Marker (D2000);1-4. 80 ng、70 ng、60 ng、50 ng,primer 847
模板用量是制约产物得率和特异性的重要因素,由图3可以看出,50~80 ng的模板用量都能扩增出条带,但用量为50 ng时,条带不清晰,而用量为80 ng时,出现了非特异性产物,这可能是由于用量过低时分子碰撞的概率低,而用量过高时会出现错误的复制。模板为60 ng时比70 ng的条带清晰,故模板用量60 ng为最佳。
2.5 引物浓度的优化

图4 ISSR-PCR反应体系中不同引物浓度的扩增结果
M. Marker (D2000);0.4μmol/L、0.6μmol/L、0.8μmol/L、1.0μmol/L,primer 847
引物浓度影响ISSR-PCR的产量和特异性,浓度过低会导致无法测出所有ISSR位点[8],而浓度过高则会出现错误的复制[9],且会增加引物之间形成二聚体的几率。由图4可以看出引物浓度在0.8时条带最清晰且有多态性,故确定引物最佳浓度为0.8μmol/L。
3 结论与讨论
DNA的提取是研究分子生物学的基本手段,目前提取DNA的方法有CTAB法、SDS法、SLS法等,而山茱萸基因组DNA的提取方法多为CTAB法,由于山茱萸成熟叶片中有较高含量的多糖和多酚类以及次生代谢物,所以常规的CTAB法在提取山茱萸成熟叶片DNA时,会导致多糖及多酚类去除不彻底,而且多酚类物质会导致褐化、抑制多种酶的活性。实验中的改良CTAB法采取了在磨样时加入PVP、预处理液中加入PVP、β-巯基乙醇的措施,这样可以有效的防止多酚类的褐化,并且能够较好的除去多糖、多酚类物质,而EDTA可以螯合二价金属离子,抑制DNase的活性,防止DNA降解,从而获得较高质量的DNA。
由于山茱萸经济效益高,尽快选育其优良品种成为了一种亟待解决的问题,而ISSR分子标记技术由于其多态性高、操作简单等种种优点,可以用于更好的对山茱萸进行选育,而ISSR体系中的因素如退火温度、模板用量、引物浓度都对PCR有着很大影响[10]。实验通过设置梯度对各个因素进行了筛选,最终建立了山茱萸ISSR-PCR反应体系,即60 ng DNA模板、0.8μmol/L的引物、10μLPCR Master Mix,用无菌水补至25μL。该体系可以为以后的山茱萸良种选育奠定基础。
[1]方文培,胡文光.中国植物志[M].北京:科学出版社.1990.
[2]陈延惠,冯建灿,郑先波,等.山茱萸研究现状与展望[J].经济林研究,2012,30(1):143-150.
[3] Moreno,Martin J P,Oritiz J M.Inter-simple sequences repeat PCR for characterization of closely related Grapevine germplasm [J].Euphytica,1998(101):117-125.
[4] M Venkateswarlu,SI eUrs,BSurendraNath,et a1.A first genetic linkage map of mulberry(Morus spp.)using RAPD, ISSR and SSR markers and pseudotestcross ma pping strategy[J].Tree Genetics& Ge nomes,2006(3):15-24.
[5] Li H Sh,Chen G Zh.Ge netic diversity of Sonneratiaalba in China detected by inter-simple sequence repeats (ISSR) analysis[J].Acta Botanica Sinica,2004,46(5):515-521.
[6]李继东,李海涛,李振山,等. 灰枣成熟叶片DNA提取及ISSR反应体系构建[C]. 2007年全国分子生物学技术在果树上应用学术研讨会论文集. 2007:150-154.
[7]关锰.山茱萸种质资源调查、评价与遗传多样性研究[D].西安:陕西师范大学,2008.
[8]李海生,陈桂珠.红树植物海桑简单重复序列区间(ISSR)条件的优化[J].广东教育学院学报,2004,24(2):80-83.
[9]邹喻苹,葛颂,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001.
[10]王建波.ISSR分子标记及其在植物遗传学研究中的应用[J].遗传,2002,24(5):613—616.
A Method for Extracting DNA from Mature Leaves ofand ISSR Reacting System Construction
DONG Bo-wen1,GUAN Shao-hua1,DONG Hui-hui2,ZHAO Zhi-hao1,LI Ji-dong1
(1. Henan Agricultural University, Zhengzhou 450002, China; 2. Xinyang Forestry Science Research Institute, Henan 464031, China)
is a kind of medicinal plants with polysaccharide and polyphenol . Conventional CTAB method is useless for extracting DNA of.This study improved extraction method based on the Conventional CTAB method,and the result of the spectrophotometry,agarose gel electrophoresis and PCR indicated the improved CTAB method is suitable for the extracting DNA ofleaf stored in silica gel.Based on this, the annealing temperature,the concentration of primer and the dosage of DNA template is screened.All our results suggest that the 0.8μmol/L primer, 70ng DNA template and10μL Taq PCR Master Mix in a total volume of 20μL were suitable for ISSR—PCR amplification system of Comus officinalis. The optimal annealing temperature for primer UBC847 is 55.2℃ .
Comus officinalis;DNA extraction;ISSR
S662.1
A
1003-2630(2014)01-0001-04
2014-03-15
国家林业公益性行业科研专项项目(201104047)
董博文(1989-),男,安徽阜阳人,硕士研究生,主要从事经济林种质资源收集与评价方面的研究。
李继东(1976-),男,河南南阳人。博士,副教授,主要从事经济林栽培生理与良种选育方面的研究。E-mail :13903868540@139.com
(责任编辑:王文彬)
