太湖夏季浮游细菌群落多样性的空间格局
2014-05-27庞兴红吕丽媛袁希功陈文捷
庞兴红 吕丽媛 牛 远 沈 宏 袁希功,2 陈文捷 陈 隽 谢 平
太湖夏季浮游细菌群落多样性的空间格局
庞兴红1, 2吕丽媛3牛 远4沈 宏1袁希功1,2陈文捷3陈 隽1谢 平1
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 华中农业大学, 430070; 4. 中国环境科学研究院湖泊生态环境创新基地, 北京 100012)
为了研究太湖夏季浮游细菌群落多样性与水体营养盐的关系, 在太湖全湖范围内开展了一次大规模浮游细菌采样调查, 分析了太湖不同湖区浮游细菌丰度和多样性组成。研究发现, 浮游细菌丰度在不同湖区中存在明显的空间差异, 从北部和西部湖区沿湖流向东南方向至湖心和南部沿岸再到东部湖区呈下降趋势, 这与太湖水体营养水平从高到低变化趋势一致。浮游细菌丰度与营养盐浓度回归分析结果显示, 总磷(TP)与细菌丰度存在较好的正相关(2=0.6392,=29,<0.01), 而总氮(TN)与细菌丰度无显著相关(2=0.0663,=29,>0.05)。因此, 磷是太湖夏季浮游细菌生长的限制因子。不同湖区营养盐与浮游细菌群落多样性也具有显著的正相关, 随着营养水平的升高, 浮游细菌多样性增加。此外, 细菌群落的组成在不同湖区间亦具有明显的空间异质性, 与不同湖区营养水平空间变化一致。研究结果将有助于人们更好地理解淡水湖泊中微生物循环和生态系统功能。
太湖; 浮游细菌群落; 丰度; 多样性; 空间格局; 氮; 磷
太湖位于长江三角洲南端坦荡的太湖平原上, 是我国第三大淡水湖, 面积约2238 km2, 南北长68.5 km, 东西平均宽34 km, 平均水深1.9 m, 最大水深2.6 m, 是一个典型的浅水湖泊[1]。近二三十年来, 太湖水体富营养化程度明显加剧, 每年都会出现蓝藻水华, 且面积有逐年增加的趋势, 严重威胁了该地区饮用水质量和安全[2, 3], 并形成了具有草型、藻型、较贫营养和极端富营养化的很有代表性的不同类型湖区[4]。已有研究表明, 微生物在水质调控中起着重要作用[5, 6]。浮游细菌在水域生态系统中作用的研究正日益受到重视, 许多学者对湖泊浮游细菌的生态分布也进行了一系列的研究, 并取得了很大进展[7, 8]。然而, 已有太湖的浮游细菌的相关研究大多停留在北部湖区(藻型湖区), 缺乏对全湖范围内尤其是夏季微囊藻水华时期全湖浮游细菌群落组成的研究。为此, 本文运用GPS定位系统在太湖全湖范围内设置了29个采样点, 进行了一次大规模采样调查, 研究了太湖夏季微囊藻水华时期浮游细菌丰度和多样性的空间分布及其与营养盐的关系, 以期揭示太湖微囊藻水华时期浮游细菌群落结构的空间格局, 为探讨浮游细菌群落空间格局与太湖不同类型湖区水质之间的内在关系提供依据。
1 材料与方法
1.1 采样点和样品采集
运用GPS定位系统在太湖全湖范围内设置了29个采样点(图1), 根据其地理位置, 采样点分为6个区域, 为北部湾(竺山湾区(1#、2#、3#)、梅梁湾区(4#、5#、6#、7#)、贡湖湾区(8#、9#、10#、11#))、西部沿岸区(12#、13#)、湖心区(14#、15#、16#、17#、18#、19#、20#)、东部沿岸区(21#、22#、23#、24#)、南部沿岸区(25#、26#)及东太湖区(27#、28#、29#), 其中北部湾(竺山湾、梅梁湾、贡湖湾)自20世纪90年代起, 每年5至10月均发生蓝藻水华, 水体富营养化严重; 西部沿岸区水体N、P水平高于北部湾; 湖心区远离岸边, 受外界干扰相对较小, 营养水平相对较低; 南部岸区N、P水平与湖心相差不大; 东部沿岸区和东太湖是水草丰富区, 营养水平最低。于2010年8月进行了一次大规模采样调查, 持续了7d, 期间气候条件相差不大。各采样区域分别缩略为: 北部湾(NB)、竺山湾(ZS)、梅梁湾(ML)、贡湖湾(GH)、西部沿岸(WC)、湖心(LC)、东部沿岸(EC)、南部沿岸(SC)、东太湖(ET)。

图1 太湖采样点分布图
水样通过5 L的采水器采自水体表层, 用于细菌计数的水样(50 mL)注入预先灭菌的玻璃瓶中, 加入2%戊二醛固定。用于基因组DNA提取的水样(200—300 mL)先用5 μm孔径滤膜过滤, 然后获得的滤液过滤收集到0.2 μm孔径的聚碳酸酯膜(Whatmann, UK)上, 滤膜保存在–80℃冰箱直至分析。用于氮磷分析的水样用洗净的塑料瓶采集[9]。
1.2 样品分析
氮磷化学分析总氮(TN)、总磷(TP)采用标准方法测定[10]。
浮游细菌计数采用表面荧光直接计数方法对水样浮游细菌进行计数分析, 具体方法如下: 取2 mL用2%戊二醛固定的水样, 用1 μg/mL DAPI染料染色15min, 然后过滤到0.2 μm孔径的聚碳酸酯黑膜(Whatmann, UK)上, 于落射荧光显微镜(Zeiss Axioshop 20)下观察计数, 每个样品至少观测十个视野或1000个细胞, 然后转换为浮游细菌丰度, 即每毫升实际的细菌细胞数(cells/mL)。
细菌群落分析样品总DNA提取及纯化: 细菌基因组DNA提取采用细菌DNA提取试剂盒(Omega, USA), 后续纯化采用DNA纯化试剂盒(Qiagen, USA)。
16S rDNA V3区PCR扩增: 使用通用引物R518 (5¢-CCTACGGGAGGCAGCAG-3¢)和5¢端带40 bp GC夹的细菌特异性引物F341(5¢-ATTACCGCGGCT GCTGG-3¢)[11]扩增基因组DNA。采用50 μL PCR体系, 降落PCR的方法, 程序如下: 94℃预变性5min; 94℃变性1min, 65℃退火1min, 然后每个循环降低 1℃进行10个循环; 72℃延伸1min; 55℃退火进行 20 个循环; 72℃延伸10min。用1.5%的琼脂糖凝胶电泳检测PCR 产物量及扩增特异性。
变性梯度凝胶电泳(DGGE): 基因组DNA扩增产物通过DGGE (Dcode system, BioRad)进行变性梯度凝胶电泳, 分析微生物群落多样性。所选聚丙烯酰胺的变性梯度范围为40%—55%, 缓冲液为1×TAE, 电泳参数为: 150V, 7h。电泳结束后用GelRed (用1×TAE 进行1︰10000稀释)染色30min, 然后用UV成像系统(基因公司)成像、拍照。所有样品的DGGE于三块胶上完成, 第三块胶上分别有第一、第二块胶的对照样品(8#、22#)。
1.3 统计分析
环境变量统计分析 环境变量的统计分析均在SPSS软件(版本13.0)上进行, 显著水平设定为0.05; 图表绘制均在OriginPro 8.0中进行。
聚类分析 DGGE图谱各样品的聚类通过NTsys软件(2.10e)进行。方法如下: 通过Quantity One软件(BioRad)得出每个样品每个条带有无(1、0)的二元矩阵。样本之间的相似系数用公式:D=(2AB)/(A+B), 其中AB代表样本A 和B 的公共条带数,A和B分别代表样本A 和B的条带数。使用得到的相似系数, 利用非加权组平均法(UPGMA)构建系统树图(SHAN 法则)。
2 结果
2.1 太湖各湖区夏季营养水平
太湖夏季各湖区域TN、TP如表1, 可以看出营养水平在不同区域之间相差较大, 其中北部湾和西部沿岸营养水平为最高, TN均值分别为3.46和3.91 mg/L, TP均值分别为0.09和0.12 mg/L; 东太湖和东部沿岸营养水平为最低, TN均值分别为1.75和2.23 mg/L, TP均值分别为0.02和0.02 mg/L。根据富营养化评价标准[12], 6个区域均处于中富营养至严重富营养状态。
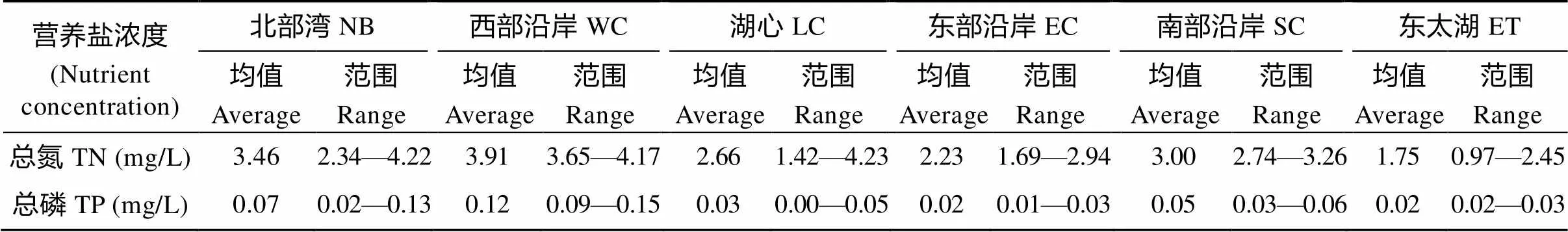
表1 太湖各区域夏季氮磷水平
2.2 太湖各湖区夏季浮游细菌丰度的分布
浮游细菌数量在不同营养水平湖区中存在明显的水平分布情况(图2)。营养水平最高的西部沿岸和北部湾水体中浮游细菌数量显著高于营养水平最低的东部沿岸和东太湖及营养水平居中湖心和南部沿岸(<0.05), 西部沿岸湾浮游细菌平均丰度为7.68×107cells/mL, 北部湾浮游细菌平均丰度为4.52× 107cells/mL, 湖心浮游细菌均值为2.84×107cells/mL, 南部沿岸浮游细菌均值为2.91×107cells/mL, 东部沿岸浮游细菌均值为1.86×107cells/mL, 东太湖浮游细菌均值为1.53×107cells/mL。其中位于营养水平较高的7#、12#采样点的细菌数量分别达到9.05×107和9.98×107cells/mL; 位于营养水平较低的23#、27#采样点的细菌数量则分别为1.10×107、1.28×107cells/mL。而营养水平居中的湖心区和南部沿岸区细菌丰度与东太湖和东部沿岸区细菌数量无显著差异(>0.05)。总的说来, 浮游细菌丰度在太湖各不同营养水平湖区中存在较大空间异质性。另外, 浮游细菌丰度回归分析结果显示(图3), TP浓度与细菌丰度存在较好的线性回归关系(2=0.6392,=29,<0.01), 而TN浓度与浮游细菌丰度无显著相关(2=0.0663,=29,>0.05)。这表明磷盐成为限制太湖夏季浮游细菌生长的重要因子, 而氮盐浓度对其生长无显著作用, 水体中的氮盐完全可以满足其生长。
2.3 太湖各湖区夏季浮游细菌群落多样性分析
电泳条带的亮度代表该物种所占比例, 条带越亮, 所占比例越大; 条带的数量及各条带所占比例的均一程度可以反映浮游细菌群落的多样性, 条带越多, 均一程度越高, 代表多样性越高。因此, DGGE图谱中可以看出(图4), 不同湖区浮游细菌群落组成具有明显的空间异质性, 西部沿岸的12#浮游细菌多样性最高, 北部湾的浮游细菌多样性次之, 其他采样点水体细菌多样性则相对较低。
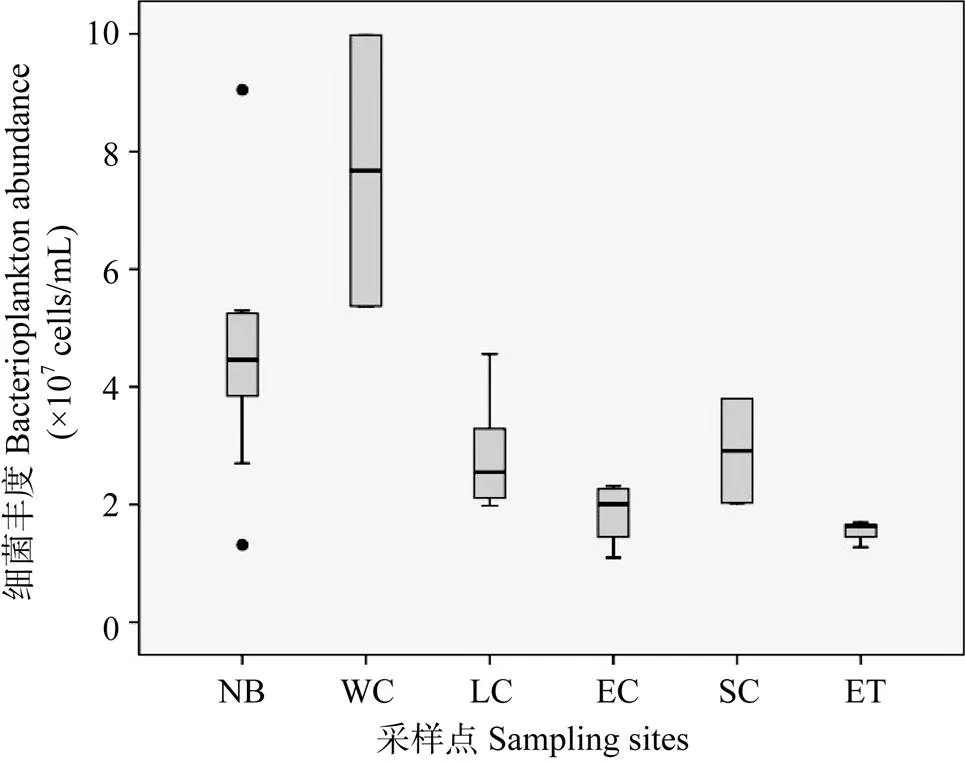
图2 太湖各采样点浮游细菌丰度
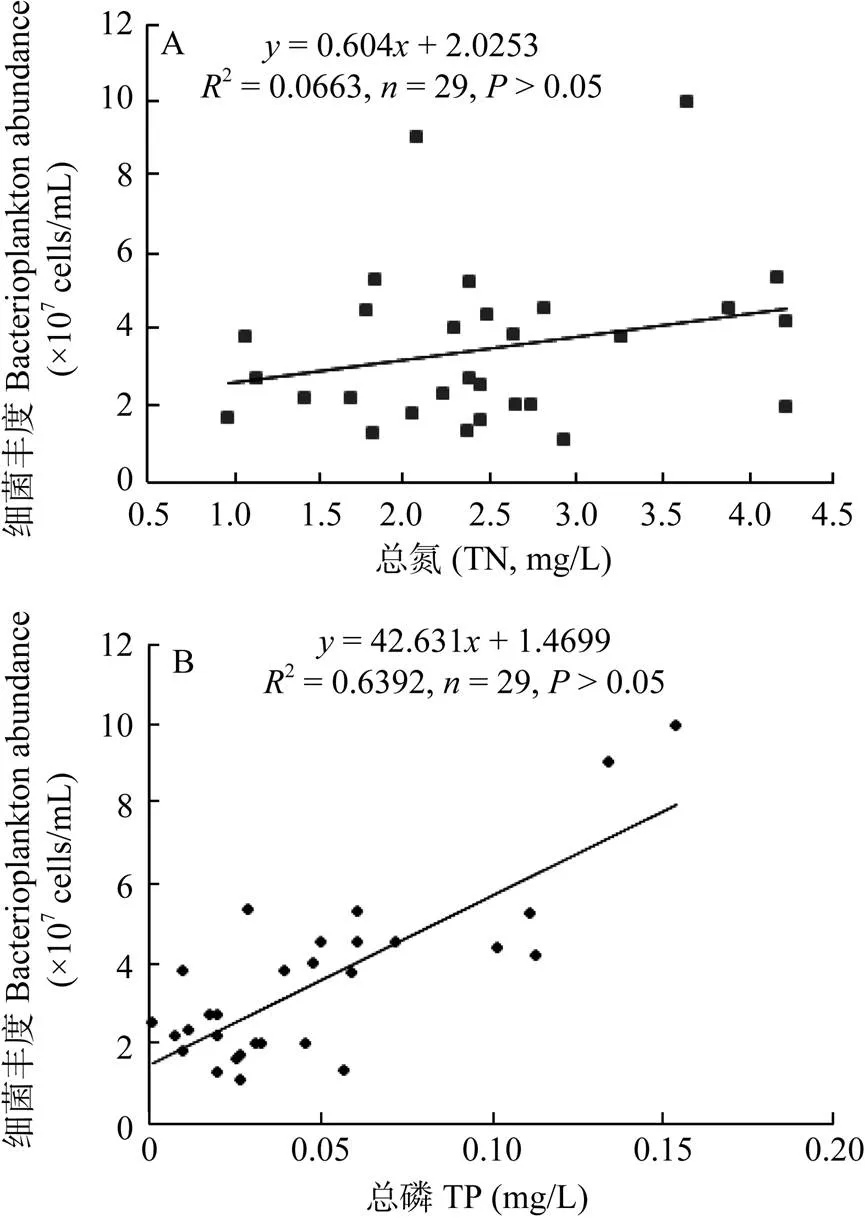
图3 TN、TP与细菌丰度的线性回归分析 (A. 总氮; B. 总磷)
聚类分析结果(图5)也显示了太湖浮游细菌空间异质性。所有样品总共可聚成8大类, 第一类包括几乎所有北部湾的样品(11#除外)加湖心区临近梅梁湾的14#样品, 第二类包括东太湖的3个样品, 第三类包括东部沿岸的所有样品加湖心的17#, 第四类包括湖心的15#、16#加贡湖湾的11#, 第五类包括湖心的19#、20#加南部沿岸的26#, 第六类包括西部沿岸的13#和湖心临近13#的18#, 第七类和第八类分别为西部沿岸的12#和南部沿岸的25#。

图4 太湖各采样点水体细菌群落组成的DGGE图谱
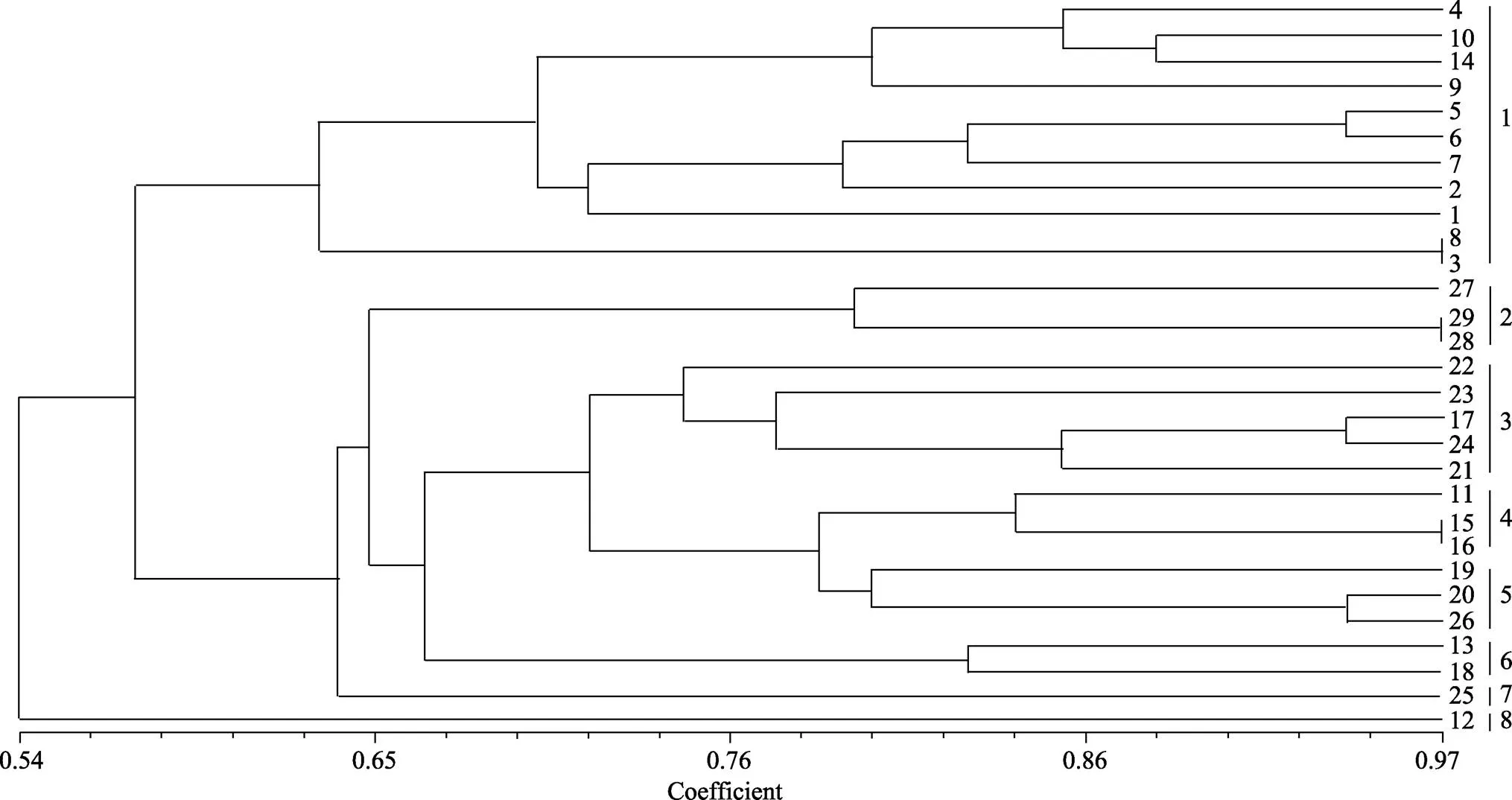
图5 基于DGGE的浮游细菌群落聚类分析
3 讨论
3.1 太湖夏季各湖区浮游细菌丰度及其影响因子
最近几年, 太湖的富营养化程序明显加剧, 蓝藻水华(主要是微囊藻水华)的暴发频率和面积逐渐增大, 从晚春到夏季北部和西部湖区都会发生严重的水华[13], 而东部湖区为草型湖区, 被沉水植物覆盖[14]。已有研究表明, 从梅梁湾到湖心区细菌数量显著下降[15], 而我们的研究发现, 微囊藻水华时期, 细菌数量不仅从北部湾到湖心区呈下降趋势, 且从湖心区到草型东部湖区也呈下降趋势, 即细菌数量从北部和西部湖区沿湖流向东南方向至湖心和南部沿岸再到东部湖区呈下降趋势, 这与太湖各湖区营养水平从高到低的变化趋势一致。太湖北部湾和西部沿岸区由于入湖河流众多, 导致大量营养物质输入, 产生蓝藻水华[1]。蓝藻及其次生代谢产物较容易被微生物分解转化成溶解性有机物, 进一步矿化成营养盐供浮游植物利用, 进一步促进蓝藻水华[15]; 同时, 细菌又可吸收溶解性有机物合成自身成分, 促进自身的生长和细菌数量的增加, 形成互利互惠的情形[15, 16]。另外, 藻类的大量生长为水体中浮游动物提供了充足的饵料, 从而降低了浮游动物对细菌的牧食压力, 因此北部湾和西部沿岸区浮游细菌较丰富。太湖湖心区由于远离岸边, 受入湖河流的影响较小, 营养水平较低, 藻类数量相对较少[1, 17, 18], 而浮游动物相对较多[18, 19], 因此, 浮游动物对细菌的捕食压力较大, 加上营养物质较少造成了湖心区细菌丰度相对于北部湾和西部沿岸区细菌丰度较小的结果, 这与冯胜等[14]研究结果细菌数量呈现随水体营养水平增加而上升的趋势一致(主要涉及北部湾和湖心的北部区域)。然而由于湖流作用湖心区出现了一些采样位点水体细菌丰度比较大的情况, 如18#采样点细菌丰度(4.56×107cells/mL)达到了北部湾细菌丰度的均值, 这可能是由湖流和风浪的作用所致。太湖东部湖区是被大型水生植物(主要是眼子菜)所覆盖, 由于大型水生植物通过竞争营养盐及遮光作用能够限制浮游植物的生长[19], 从而增加了浮游动物对细菌的捕食压力; 另外, 大型水生植物分泌、释放的有机物与藻类代谢产生的有机物性质不同, 多是一些难降解、不易被细菌利用的维管束植物起源的木质纤维素和木质素起源的芳香族化合物[20—22], 因此在一定程度上限制了东部湖区细菌的数量。
3.2 太湖夏季浮游细菌群落空间多样性及其影响因子
有研究表明, 随着营养水平的升高、营养物质等生存条件的改变, 细菌多样性会增加[23]; 然而也有研究表明细菌群落多样性随水体营养水平的增加而呈现显著下降的趋势[19]。本文对太湖微囊藻水华时期不同湖区水体细菌DGGE的研究表明, 北部湾和西部沿岸细菌多样性相对较高, 其他湖区细菌多样性相对较低, 即水体营养水平越高, 其细菌多样性越高。这可能由于在营养水平高的湖区藻类大量生长, 会分泌、释放多达25%的所固定有机物到水体中, 这些有机物易降解且容易被大部分细菌吸收利用[24, 25]; 另外, 入湖河流也会携带大量外源性有机物进入水体, 一般来讲, 这些外源性有机物相对于内源性有机物不易降解, 只能被少数细菌所利用[26]。因此, 营养水平较高的北部湾和西部沿岸区含有不同类型的有机物及其特异性细菌, 因此细菌多样性较高。其他湖区由于营养水平较低, 产生的内源性有机物较少, 另外东部湖区大型水生植物分泌、释放的有机物往往是不易被降解的芳香族化合物, 仅能被少数细菌利用[20], 因此这些湖区的细菌多样性较低。
本研究的聚类结果显示细菌群落组成在微囊藻水华时期不同湖区间具有明显的空间异质性, 基本呈现了与营养水平空间差异一致的特征。北部湾、东部沿岸、东太湖几乎所有样品分别各自聚成一类, 西部沿岸的12#和南部沿岸的25#各自单独聚成一类, 另外, 湖心各采样点水体细菌群落组成分别与周围不同营养水平湖区细菌聚为4类。Wu,.[14]的研究也表明东太湖的各点细菌组成相似, 与本文结论一致。湖心区各采样点水体细菌组成相差较大, 可能是由于水体面积较大, 营养水平有一定差别, 加上湖流作用和风浪影响而造成[15]与周围湖区水体营养水平相似。比利时学者研究表明随湖泊营养水平的不同, 水体中细菌群落组成将发生显著变化[27], 这与本研究结论微囊藻水华时期太湖浮游细菌群落结构呈显著的空间异质性不谋而合。
另外, 从本研究及历史数据[1]中可知, 营养水平较低的湖心和东部湖区是目前太湖水质最好的区域, 南部沿岸水质次之, 而北部湾和西部沿岸是受污染最严重的区域。与太湖微囊藻水华时期不同湖区浮游细菌群落结构的空间异质性基本一致。因此, 太湖浮游细菌丰度和多样性指数, 在一定程度上可以指示水体营养状态。已有研究表明, 细菌在水质调控中起着重要作用[5]。找出不同湖区细菌群落组成的差异所在, 可以帮助我们更好地理解富营养化湖泊中生态系统的微生物循环, 进一步得知浮游细菌群落空间格局与不同类型湖区之间的内在关系。对浮游细菌群落的序列组成以及细菌特殊功能值得进一步研究。
4 结论
(1) 浮游细菌丰度在不同湖区中存在明显的空间差异, 与太湖水体营养水平从高到低变化趋势一致。总磷(TP)与细菌丰度存在较好的正相关, 成为太湖夏季浮游细菌生长的限制因子。(2) 不同湖区浮游细菌群落多样性也具有显著的正相关, 随着营养水平的升高, 浮游细菌多样性增加。(3) 细菌群落的组成在不同湖区间亦具有明显的空间异质性, 与不同湖区营养水平空间变化一致。(4) 本文的研究结果将有助于人们更好的理解淡水湖泊中微生物循环和生态系统功能, 对浮游细菌群落的序列组成以及细菌特殊功能值得进一步研究。
[1] Qin B Q, Hu W P, Chen W M. Succession of Ecological Environment and its Mechanism in Lake Taihu [M]. Beijing: China Science Press. 2004, 19—28 [秦伯强, 胡维平, 陈伟民.太湖水环境演化过程与机理.北京: 科学出版社. 2004, 19—28]
[2] Xie P. Historical Development of Cyanobacteria with Bloom Disaster in Lake Taihu [M]. Beijing: Science Press. 2008, 1—33 [谢平. 太湖蓝藻的历史发展与水华灾害. 北京: 科学出版社. 2008, 1—33]
[3] O’Neil J M, Davis T W, Burford M A,. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change [J]., 2012, 14: 313—334
[4] Chen Y W, Qin B Q, Teubner K,. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in LakeTaihu, a large shallow lake in China [J]., 2003, 25: 445—453
[5] Hahn M W. The microbial diversity of inland waters [J]., 2006, 17: 256—261
[6] Zhou C, Song C L, Cao X Y,. Responses of extracellular alkaline phosphatase activity in different organic phosphorus mineralizing bacteria strains isolated from Lake Taihu to the cyanobacterium detritus [J]., 2012, 36(1): 119—125 [周纯, 宋春雷, 曹秀云, 等. 太湖不同解有机磷菌株胞外碱性磷酸酶活性对蓝藻碎屑的响应. 水生生物学报, 2012, 36(1): 119—125]
[7] Dufour P, Torreton J P, Colon M.Advantages of distinguishing the active fraction in baeterioplankton assemblages: some examples [J]., 1996, 207: 295—301
[8] Tian C, Tan J, Wu X,. Spatiotemporal transition of bacterioplankton diversity in a large shallow hypertrophic freshwater lake, as determined by denaturing gradient gel electrophoresis [J]., 2009, 31: 885—897
[9] Niu Y, Shen H, Chen J,Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China [J]., 2011, 45: 4169 —4182
[10] Jin X C, Tu Q Y. The Standard Methods for Observation and Analysis of Lake Eutrophication [M]. Beijing: China Environmental Science Press. 1990, 160—185 [金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社. 1990, 160—185]
[11] Muyzer G, De Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction amplified genes coding for 16S rRNA [J]., 1993, 59: 695—700
[12] Zhong C H. A study on the eutrophication of the Three Gorges Reservoir [D]. Sichuan University, Chengdu. 2004 [钟成华. 三峡库区水体富营养化研究. 四川大学, 成都. 2004]
[13] Xu H, Paerl H W, Qin B Q,. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China [J]., 2010, 55: 420—432
[14] Wu Q L, Zwart G, Wu J F,. Submersed macrophytes play a key role in structuring bacterioplankton community composition in the large shallow subtropical Taihu Lake China [J]., 2007, 9: 2765—2774
[15] Feng S, Qin B Q, Gao G. Response of bacterial communities to eutrophic water in Lake Taihu [J]., 2007, 27(11): 1823—1829 [冯胜, 秦伯强, 高光.细菌群落结构对水体富营养化的响应.环境科学学报, 2007, 27(11): 1823—1829]
[16] Baines S B, Pace M L. The production of dissolved organic matter by phytoplankton and its importance to bacteria-patterns across marine and fresh-water systems [J]., 1991, 36: 1078—1090
[17] Tao M, Xie P, Chen J,. Use of generalized additive model to investigate key abiotic factors affecting microcystin cellular quotas in heavy bloom areas of Lake Taihu [J]., 2012, 7: e32020
[18] Sun X X, Tao M, Qin B Q,. Large-scale field evidence on the enhancement of small-sized cladocerans byblooms in Lake Taihu, China [J]., 2012, 34: 853—863
[19] Sand-Jensen K, Borum J. Interactions among phytoplankton, periphytonand macrophytes in temperate freshwaters and estuaries [J]., 1991, 41: 137—175
[20] González J M, WhitmanW B, Hodson R E,. Identifying numerically abundant culturable bacteria from complex communities: an example from a lignin enrichment culture [J]., 1996, 62: 4433—4440
[21] Benner R. Chemical Composition and Reactivity [M]. In: Hansell D A, Carlson C A (Eds.), Biogeochemistry of Marine Dissolved Organic Matter. Academic Press. 2002, 59—90
[22] Benner R. Molecular Indicators of Bioavailability of Dissolved Organic Matter [M]. In: Findlay S E G, Sinsabaugh R L (Eds.), Aquatic Ecosystems: Interactivity of Dissolved Organic Matter. Academic Press. 2003, 121—137
[23] Chrzanowski T H, Sterner R W, Elser J J. Nutrient enrichment and nutrient regeneration stimulate bacterioplankton growth [J]., 1995, 29: 221— 230
[24] Doucette G J. Interactions between bacteria and harmful algae: A review [J]., 1995, 3: 65—74
[25] Li H B, Xing P, Chen M J,. Short-term bacterial community composition dynamics in response to accumulation and breakdown of Microcystis blooms [J]., 2011, 45: 1702—1710
[26] Geller A. Degradability of dissolved organic lake water compounds in cultures of natural bacterial communities [J]., 1983, 99: 60—79
[27] Katleen V G, Tom V, Nele V. Characterization of bacterial communities in four freshwater lakes difering in nutrient load and food web structure [J]., 2005, 53: 205—220
The spatial pattern of bacterioplankton community composition in Lake Taihu in summer
PANG Xing-Hong1, 2, Lü Li-Yuan3, NIU Yuan4, SHEN Hong1, YUAN Xi-Gong1, 2, CHEN Wen-Jie3, CHEN Jun1and XIE Ping1
(1. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Huazhong Agricultural University, Wuhan 430070, China; 4. Research Center For Lake Ecology and Environment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China)
The present study was designed to determine the spatial pattern of bacterioplankton community composition (BCC) in Lake Taihu in summer and to evaluate the relationship between trophic level and bacterial diversity. According to the survey conducted during August 2010, the bacterioplankton abundance significantly declined from the north and west of lake to the center and south, then to the east of the lake; and the changes were similar to the decline of the trophic levels in lake regions. In addition, Total phosphorus (TP) concentration but not total nitrogen (TN) was positively correlated with bacterioplankton abundance (2=0.6392,=29,<0.01;2=0.0663,=29,>0.05; respectively). Thus, P is a limiting factor for the growth of bacterioplankton in summer in Lake Taihu. A positive correlation between trophic level and bacterioplankton diversity in different lake regions was also observed in present study. Moreover, distinct spatial heterogeneity of BCC was observed in summer in Lake Taihu, which is mainly in accordance with the changes in trophic levels in various lake regions. Our study may contribute to better understanding of microbial loop and their ecological function in freshwater lakes.
Lake Taihu; Bacterioplankton communities composition; Abundance; Diversity; Spatial pattern; N; P
2012-12-25;
2013-10-07
国家科技重大专项(编号: 2012ZX07101-010)资助
庞兴红(1986—), 女, 河北沧州人; 硕士; 研究方向为微生物生态学。E-mail:xinghong_pang@126.com
谢平, E-mail: xieping@ihb.ac.cn
Q145+.1
A
1000-3207(2014)02-0335-07
10.7541/2014.48
