中心组合设计法优化载基因壳聚糖纳米粒的最佳转染制备区域
2014-05-25邵帅,崔光华,周旭等
·论著·
中心组合设计法优化载基因壳聚糖纳米粒的最佳转染制备区域
目的采用中心组合设计法优化载基因壳聚糖纳米粒的最佳转染制备区域。方法采用复凝聚法制备载质粒基因的壳聚糖纳米粒,选择壳聚糖浓度和质粒基因浓度作为实验考察因素,应用两因素五水平中心组合设计优化最佳转染制备区域,优化指标选择平均粒径和基因转染率。通过透射电镜观察纳米粒的形态;通过动态光散射和电泳光散射技术分别测量纳米粒的粒径和Zeta电位;通过凝胶电泳分析考察质粒在纳米粒制备过程中的稳定性;通过倒置荧光显微镜观察质粒基因在细胞内的表达;通过流式细胞技术测定纳米粒的转染效率。结果 成功优化了载基因壳聚糖纳米粒的最佳转染制备区域。优选条件下制备的纳米粒大多呈球形,纳米粒平均粒径为217.6 nm,粒径多分散系数为0.241,表明粒径分布较窄。纳米粒zeta电位为+22.4mV,表明纳米粒表面带有正电荷,可以增加纳米粒混悬液的稳定性。凝胶电泳分析结果表明质粒基因在纳米粒制备过程中没有遭到破坏。纳米粒的细胞转染效率比较高,能够高效地将绿色荧光蛋白质粒基因递送到细胞内,并且基因表达产生绿色荧光蛋白。结论本研究建立的数学模型具有良好的预测性。在优化的制备区域内制备的载基因壳聚糖纳米粒的转染性能比较理想。
纳米粒;质粒基因;中心组合设计;壳聚糖;转染效率
基因治疗是一种富有前景的疾病治疗方法。目前制备纳米粒基因递送系统选用的材料主要有壳聚糖[1-5]、聚乳酸-乙醇酸共聚物(PLGA)[6]和明胶[7]等,制备工艺主要有凝聚法[1-5,7]和乳化挥发法[6]等。壳聚糖(chitosan)是甲壳素N-脱乙酰基的衍生物,是一种生物可降解多糖,具有良好的组织相容性。壳聚糖高分子链上有许多游离氨基,在酸性条件下游离氨基可以发生质子化而使壳聚糖分子带正电荷,而质粒基因分子链上有很多磷酸基团,其分子上的H+解离导致DNA分子链带负电荷,DNA和壳聚糖分子混合后通过静电络合,两者压缩在一起形成转染复合物或纳米粒等[8,9]。利用这一特点,可以使用复凝聚法制备载基因壳聚糖纳米粒[1-5]。该方法较乳化挥发法制备工艺简单,不使用有机溶剂,制备条件温和,也不会破坏质粒基因的结构和功能[10]。
由于基因递送系统的转染能力从根本上反映基因递送系统的效率,所以大都采用基因转染实验来评价基因递送系统的性能。在基因转染实验中多采用绿色荧光蛋白(pEGFP)、萤火虫荧光素酶等报告基因来评价转染性能,因为这些基因的表达产物易于检测。中心组合设计(central composite design,CCD)是近年来国内外应用较多的一种优化方法,可用非线性数学模型拟合,复相关系数较高,模型预测性比较好[11,12]。
过去众多学者研究制备了载基因壳聚糖纳米粒,但是还未见对最佳转染制备区域进行优化的报道。在前期研究基础上,本研究选择绿色荧光蛋白质粒报告基因为模型基因药物,通过复凝聚法制备载基因壳聚糖纳米粒,采用CCD设计比较系统地优化壳聚糖纳米粒基因递送系统的最佳转染制备区域,并系统考察载基因壳聚糖纳米粒的基本理化性质,为研究者制备和拓展使用载基因壳聚糖纳米粒提供方法借鉴和技术参考,推动载基因壳聚糖纳米粒的应用和发展。
1 材料与仪器
1.1 材料PROTASANTMCL 113壳聚糖(Pronova Biomedical,Norway,MW 110 000,脱乙酰度87%); DMEM培养基(GIBCO BRL®,USA);Lipofectamine脂质体转染试剂(GIBCO BRL®,USA);pEGFP绿色荧光蛋白质粒基因(clontech,实验室扩增和提取);HEK293人胚胎肾细胞(北京大学医学部提供);各种细胞培养用试剂;其他试剂均为分析纯;实验用水均为双蒸水。
1.2 仪器CM120透射电子显微镜(Pillips,Netherlands);QL-901旋涡混合器(江苏海门麒麟医用仪器厂);Finnpipette移液器(Labsystems,Finland); Zetasizer 3000HS纳米粒度分析仪(Malvern Instruments,UK);IX70倒置荧光显微镜(Olympus,Japan);CO2恒温培养箱(Sanyo,Japan);TLL-C台式高速冷冻离心机(北京四环科学仪器厂);普通光学显微镜(Olympus,Japan);超净工作台(北京半导体设备一厂)。
2 方法与结果
2.1 载基因壳聚糖纳米粒的制备采用复凝聚法制备载基因壳聚糖纳米粒。将一定浓度的壳聚糖溶液和200μl一定浓度的绿色荧光蛋白质粒基因溶液分别置于55℃水浴恒温20 min。精密吸取壳聚糖溶液200μl加到质粒基因溶液中,迅速在旋涡混合器上混合30 s,即得载基因壳聚糖纳米粒混悬液。
2.2 纳米粒形态、粒径与Zeta电位的测定吸取少量纳米粒混悬液滴至铺有碳膜的铜网上,静置2 min,用滤纸吸干混悬液,再滴加2%(W/V)磷钨酸染色,晾干后,于透射电子显微镜下观察纳米粒形态。另取纳米粒混悬液适量,通过动态光散射(DLS)和电泳光散射(ELS)技术,使用马尔文纳米粒度及zeta电位分析仪测定平均粒径、多分散系数及其zeta电位。
2.3 基因转染将HEK293细胞按3×104/孔分别接种于24孔细胞培养板中,培养24 h后进行基因转染实验,设立样品孔、阳性对照孔和阴性对照孔。将200 μl纳米粒混悬液铺加到样品孔中,每个样品平行做3孔;同时,将200μl脂质体-pDNA复合物加到阳性对照孔中;阴性对照孔不加纳米粒或只加裸质粒基因。孵育3 h后吸去转染物,加入1ml含10%胎牛血清的DMEM培养基,继续培养,每隔48 h换加1ml新鲜培养基。在转染24 h后,用倒置荧光显微镜对细胞进行定时观察。
2.4 基因转染效率的测定在设定时间吸弃孔中旧培养基,用PBS洗一遍,加入0.25%胰蛋白酶消化液,室温放置3~5min。向孔中加入PBS,制备单个细胞悬液。将细胞悬液于1 200 r/min离心10 min,弃去PBS,加入2%多聚甲醛固定液0.5 ml,将细胞沉淀吹打散开再制成细胞悬液,用流式细胞技术测定转染效率。
2.5 处方优化
2.5.1 中心组合实验设计在预实验基础上,选取对纳米粒制备和性质影响较显著的2个因素:壳聚糖浓度(X1)和质粒基因浓度(X2)作为实验设计因素,并确定2个因素的考察范围。根据CCD设计原理,每个因素设5个水平考察,各因素及水平见表1,实验安排见表2。各处方点的考察指标平均粒径和基因转染效率测定结果见表3。

表1 各因素水平代码及实验操作值
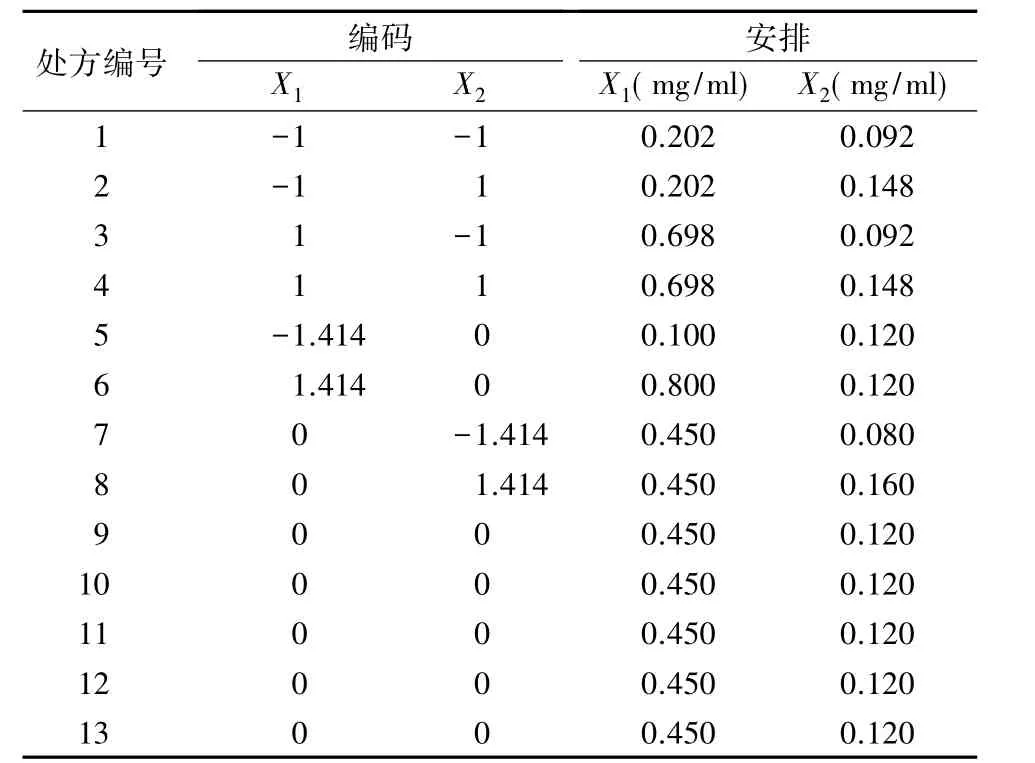
表2 实验安排(n=2)
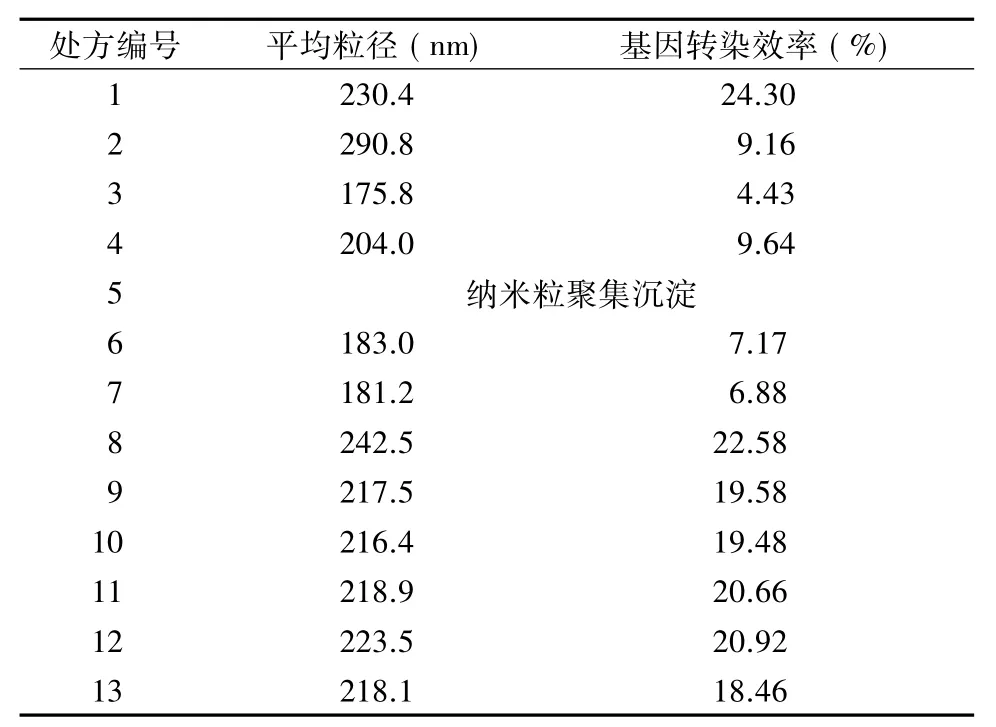
表3 考察指标平均粒径和基因转染效率测定结果
2.5.2 模型拟合以平均粒径和基因转染率作为指标(因变量),分别对各因素(自变量)进行多元线性回归和多元非线性回归拟合。模型如下:
多元线性回归:Y=B0+B1X1+B2X2
对拟合方程进行方差分析,舍去P>0.05的各拟合项,再进行拟合,求得简化方程。根据拟合的回归方程绘制各指标随自变量变化的三维效应面(response surface),由效应面选取优化工艺条件,按优化的工艺条件制备基因壳聚糖纳米粒,并进行预测分析。
拟合多元线性回归方程如下:

以上结果表明:平均粒径各因素呈良好的线性关系,线性检验F值均较大,P值<0.05,表明有显著性差异;而基因转染率多元线性回归方程相关性均不好,P值>0.05,表明线性关系不显著。
多元非线性回归二项式拟合结果如下:

以方程的回归系数r最大且P最小为原则,结果表明多元非线性回归二项式拟合效果最好。
2.5.3 效应面优化根据上述优化的各指标(因变量)多元非线性回归二项式拟合方程,使用Origin统计软件绘制了因变量随自变量变化的效应面图(图1、2)。从各指标的因变量效应面上优选出较佳的制备区域(表4),并综合分析得出公共优化区域:X1为0.40~0.55 mg/ml,X2为0.11~0.14 mg/ml。

表4 因变量效应面上最佳制备区域
各因变量随自变量X1和X2变化的三维效应面及相应等高线图如下:
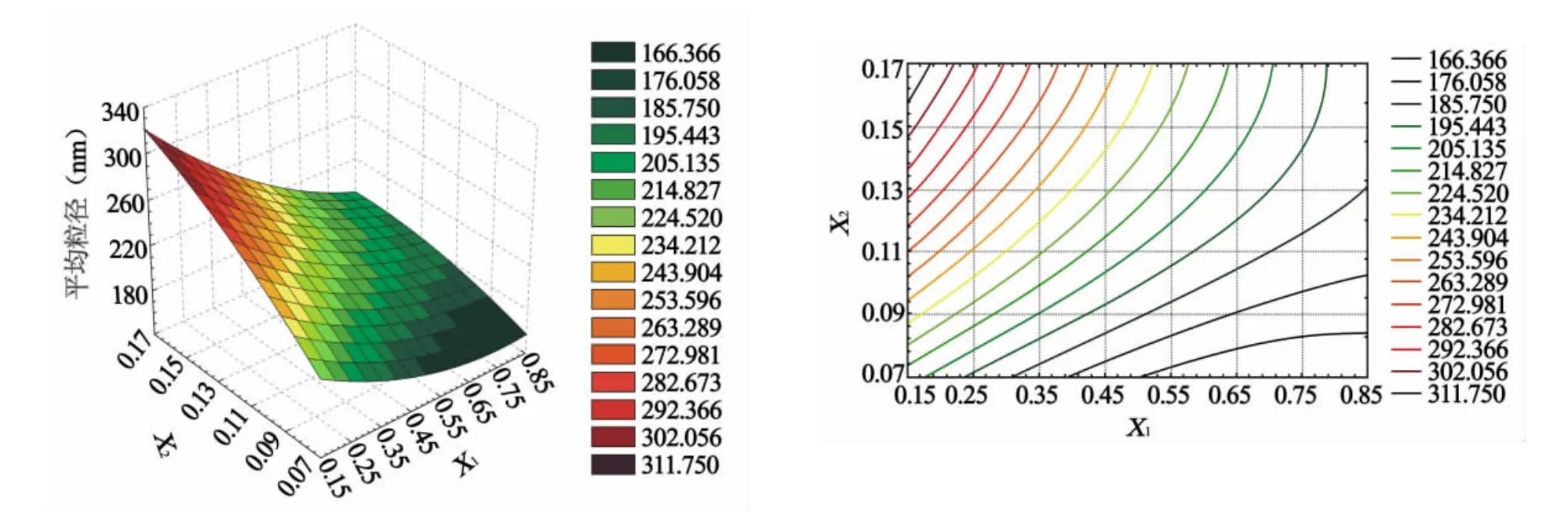
图1 平均粒径效应面和对应的等高线图
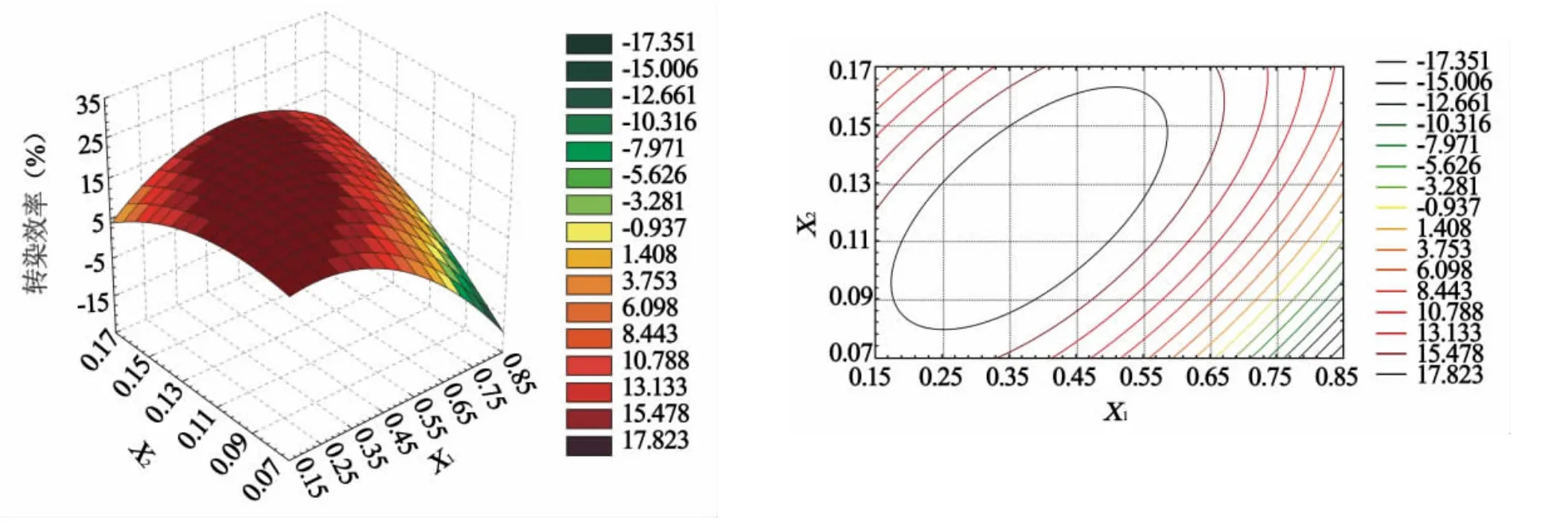
图2 基因转染效率效应面和对应的等高线图
在优选区域内选取较优条件(X1=0.45mg/ml,X2=0.12 mg/ml)制备基因壳聚糖纳米粒,测定了平均粒径和基因转染效率,然后与模型预测值进行比较,以上各指标的偏差分别为0.64%和-5.01%(表5),表明各因变量的预测值与观测值的偏差均较小,证明本研究所建立的数学模型具有良好的预测性,可用来预测载基因壳聚糖纳米粒的平均粒径和基因转染效率。

表5 预测值与实测值比较
2.6 质粒基因在纳米粒制备过程中的稳定性在不加入壳聚糖的情况下,将经过不同制备工艺参数处理的质粒基因进行0.8%(W/V)琼脂糖凝胶电泳实验,同未经处理的质粒对照比较,观察质粒电泳条带的变化,考察质粒基因在各种制备条件下的稳定性。结果表明(图3),质粒基因在不同工艺参数条件下的电泳条带和对照质粒相比都几乎没有变化,说明质粒基因在纳米粒制备过程中没有遭到破坏,不仅证明了复凝聚法制备载基因壳聚糖纳米粒的工艺合理性,也为质粒基因被纳米粒递送进入细胞后保持基因表达活性提供了保障。
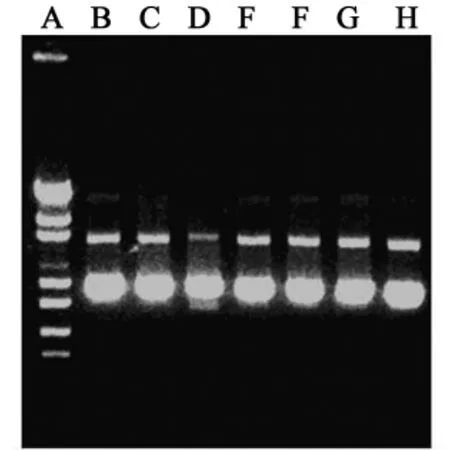
图3 不同制备工艺参数条件对质粒基因稳定性的影响
A.λ-EcoT14Ⅰ相对分子质量对照;B.未处理质粒(对照);C.未加Na2SO4,涡旋混合,室温;D.未加Na2SO4,涡旋混合,55℃;E.加Na2SO4,未涡旋混合,室温;F.加Na2SO4,涡旋混合,室温;G.加Na2SO4,涡旋混合,55℃;H.加Na2SO4,未涡旋混合,55℃
2.7 优化条件下纳米粒的形态、粒径及分布通过透射电镜观察结果表明,优选条件下制备的载基因壳聚糖纳米粒呈现良好的分散状态,形态比较规则,大多呈球形(图4)。经纳米粒度分析测定,结果表明,纳米粒平均粒径为217.6 nm,粒径多分散系数为0.241,表明粒径分布较窄,纳米粒大小比较均匀。
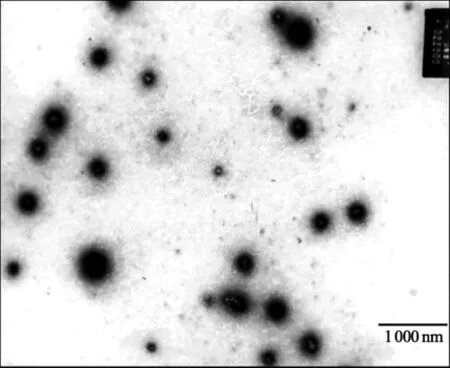
图4 载基因壳聚糖纳米粒透射电镜图(×22 000)
2.8 载基因壳聚糖纳米粒表面的zeta电位纳米粒子表面的电荷性质对于纳米制剂的体系稳定性至关重要。本研究对中心组合设计不同实验点制备的载基因壳聚糖纳米粒的zeta电位进行测定。其中,5号实验点由于纳米粒制备后发生团聚沉淀而未做测定。结果表明,各实验点制备的纳米粒表面都带有一定强度的正电荷(表6),这使得纳米粒凭借同种电荷相互排斥作用而不易聚集,可增加纳米粒混悬液的体系稳定性。另外,通过中心组合设计优选条件制备的纳米粒zeta电位测定结果为+22.4mV(图5)。

图5 载基因壳聚糖纳米粒Zeta电位分布
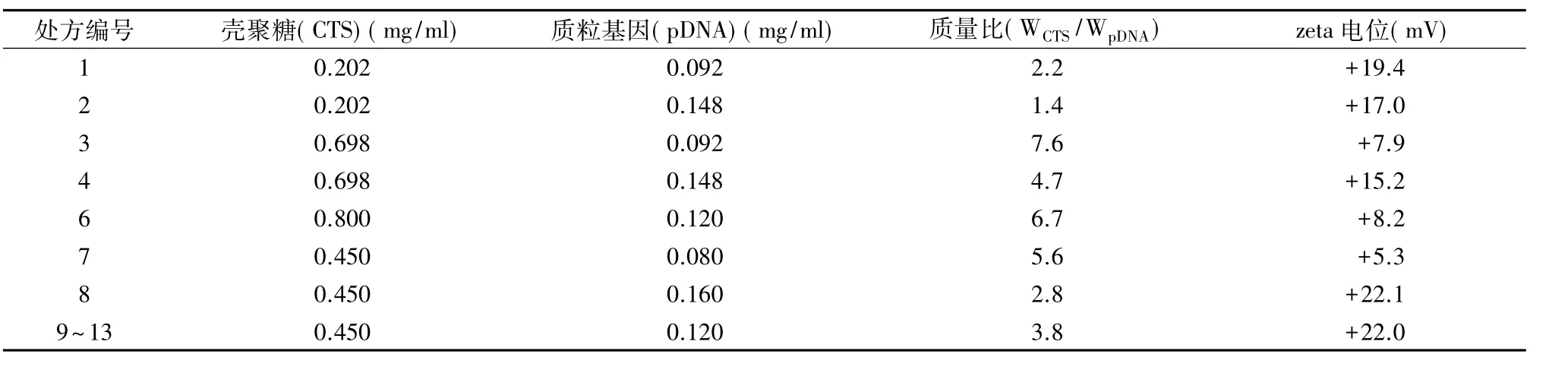
表6 中心组合设计不同实验点制备的载基因壳聚糖纳米粒的zeta电位
2.9 倒置荧光显微镜观察结果使用优选条件制备的载基因纳米粒转染HEK293细胞。通过倒置荧光显微镜进行动态观察,转染第1天后发现在纳米粒组能够观察到零星的绿色荧光点,而在阴性对照组和裸质粒组却观察不到,说明在纳米粒组细胞内有绿色荧光蛋白表达生成,证明壳聚糖纳米粒能够将绿色荧光蛋白质粒基因递送到了细胞内,并且基因表达产生了绿色荧光蛋白。图6是第3天的基因转染效果照片,可以看出在较优条件下制备的载pEGFP质粒基因壳聚糖纳米粒转染HEK293细胞转染效率很高,表达效果比较理想。
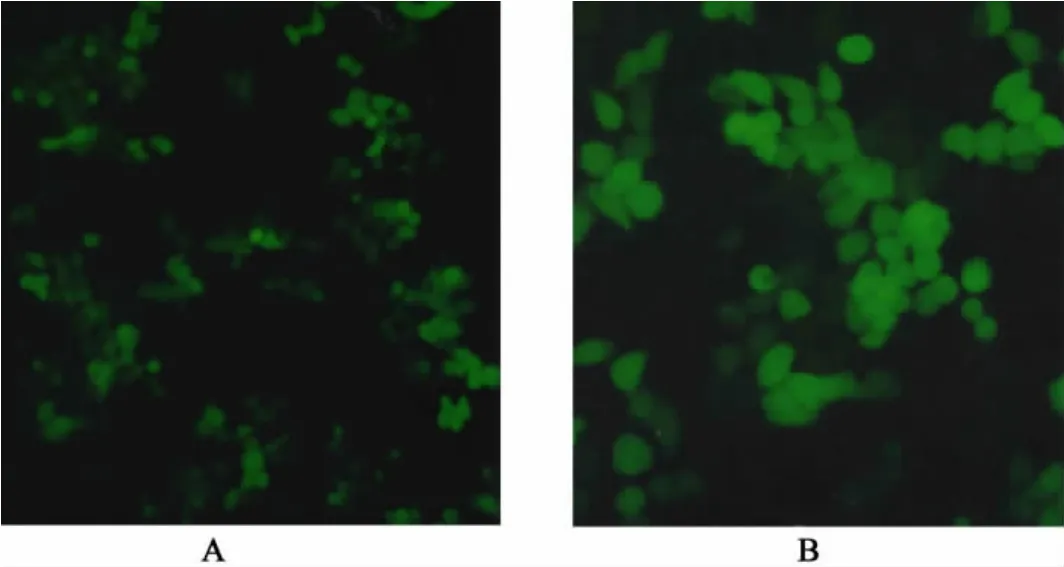
图6 载pEGFP基因壳聚糖纳米粒转染HEK 293细胞后绿色荧光蛋白的表达(A.×100;B.×200)
3 讨论
制剂工艺优化普遍采用正交设计或均匀设计,实验次数少,数据处理较为方便。但上述方法均为基于线性模型的实验设计,如果因素与效应间为非线性关系,特别是各因素间存在相互作用时,那么得出的最优工艺可能与实际情况存在较大偏离。目前,中心组合设计在制剂工艺优化中被广泛采用,该设计充分考虑了因素与效应间的非线性可能和各因素间的交互作用,可克服正交设计和均匀设计精度低、预测性差等不足。中心组合设计法优化制剂处方工艺,方法简便,可对多因素和多指标的实验进行综合优化筛选,实验结果预测较为准确。因此,中心组合设计是进行多因素及多指标处方和制备工艺优化筛选的较佳方法。
在一些发表的论文中,有研究者使用N/P比作为影响因素来考察材料与基因的比例对转染效率的影响。N/P比的定义是基因载体中能够质子化的氨基的摩尔数与基因中能够解离的磷酸根的摩尔数的比值。首先,从定义来看,N/P比这个概念只适用于含有氨基的聚阳离子基因载体,覆盖面显得有点窄,因为有的基因递送载体本身不含氨基,例如PLGA。其次,N/P比的数值不是很准确,一方面,因为聚合物本身不是分子量均一的物质,其分子量有一个分布,在计算载体的氨基摩尔数时只能使用聚合物平均分子量这个指标,这样得出的氨基摩尔数可以说并不十分精确;另一方面,组成基因(DNA)的4种脱氧核糖核苷酸(每个核苷酸含有一分子磷酸)的分子量不同,相互间略有差别,在计算解离磷酸根摩尔数时只能使用核苷酸平均分子量这个指标,由此得出的磷酸根摩尔数也不精确,进而导致最终计算的N/P比的数值不精确。所以,本研究没有使用N/P比作为指标因素来考察材料与基因的比例对转染效率的影响。
此外,本研究发现在中心组合设计中质量比(也可理解为N/P比)较高的处方点(例如3、6、7)对应的转染效率反而较低(表3)。为了解释该现象,本研究对中心组合设计不同实验点制备的载基因壳聚糖纳米粒的zeta电位进行了测定(表6)。结果表明,质量比较高的处方点(例如3、6、7)对应的zeta电位较低。众所周知,细胞膜表面带有一定密度负电荷,这样表面带有正电荷的纳米粒子可以通过电性作用黏附于细胞膜表面,有利于荷正电纳米粒的细胞摄取。因此可以推断:对于上述质量比较高的处方点制备的纳米粒,其具有较低的zeta电位,在一定程度上降低了纳米粒和细胞膜的黏附效率,减少了纳米粒入胞数量,进而导致转染效率较低。
综上所述,本研究采用复凝聚法制备载pEGFP质粒基因的壳聚糖纳米粒,并采用中心组合设计成功对载基因壳聚糖纳米粒基因递送系统的最佳转染制备区域进行了优化,建立的数学模型具有良好的预测性。本研究在优化条件下制备的基因壳聚糖纳米粒大多呈球形,粒径大小分布均匀,纳米粒的转染性能比较理想。壳聚糖本身没有细胞毒性,其在体内可生物降解,具有良好的组织相容性,壳聚糖纳米粒用作基因递送载体是安全的。虽然优化的转染效率仍然比不上一些商业转染试剂(如Lipofectamine 2000),但是壳聚糖纳米粒在体内应用中具有独特的优势(例如口服基因递送效果理想[5]),是一种很有前景的体内基因递送载体。笔者旨在为研究者制备和拓展应用载基因壳聚糖纳米粒提供一定参考和借鉴。
[1]Li XW,Lee DK,Chan AS,et al.Sustained expression inmammalian cellswith DNA complexed with chitosan nanoparticles[J]. Biochim Biophys Acta,2003,1630(1):7-18.
[2]Cui Z,Mumper RJ.Chitosan-based nanoparticles for topical genetic immunization[J].JControl Release,2001,75(3):409-419.
[3]Mao HQ,Roy K,Troung-Le VL,etal.Chitosan-DNA nanoparticles as gene carriers:synthesis,characterization and transfection efficiency[J].JControl Release,2001,70(3):399-421.
[4]蒋挺大.壳聚糖[M].北京:化学工业出版社,2001:8-12.
[5]Roy K,Mao HQ,Huang SK,etal.Oralgene delivery with chitosan-DNA nanoparticles generates immunologic protection in a murine model of peanut allergy[J].Nat Med,1999,5(4):387-391.
[6]Hirosue S,Müller BG,Mulligan RC,et al.Pasmid DNA encapsulation and released from solvent diffusion nanospheres[J].J Control Release,2001,70(1-2):231-242.
[7]Truong-Le VL,August JT,Leong KW.Controlled gene delivery by DNA-gelatin nanospheres[J].Hum Gene Ther,1998,9 (12):1709-1717.
[8]Mao S,Sun W,Kissel T.Chitosan-based formulations for delivery of DNA and siRNA[J].Adv Drug Deliv Rev,2010,62(1): 12-27.
[9]Strand SP,Lelu S,Reitan NK,et al.Molecular design of chitosan gene delivery systems with an optimized balance between polyplex stability and polyplex unpacking[J].Biomaterials,2010,31(5):975-987.
[10]马丽杰,赵静.壳聚糖/木质素磺酸钠复凝聚法制备生物农药微胶囊[J].北京化工大学学报(自然科学版),2006,33(6):51-56.
[11]吴伟,崔光华.星点设计——效应面优化法及其在药学中的应用[J].国外医学(药学分册),2000,27(5):292-298.
[12]Hassan EE,Parish RC,Gallo JM.Optimized formulation ofmagnetic chitosan microspheres containing the anticancer agent,oxantrazole[J].Pharm Res,1992,9(3):390-397.
Optimized preparation of DNA-chitosan nanoparticles with high transfection efficency through a central com position design
SHAO Shuai1,4,CUIGuanghua2,ZHOU Xu3,GAO Zhonggao1,HUANGWei1(1.Department of Pharmaceutics,Institute of Materia Medica,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100050,China;2.Department of Pharmaceutics,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China;3.302Military Hospital of China,Beijing 100039,China;4.Department of Pharmaceutics,Yanbian University,Yanji133000,China)
Objective This study aimed to optimize the preparation condition of DNA-chitosan nanoparticleswith high transfection efficency through a central composition design.Methods The DNA-chitosan nanoparticleswere prepared by complex coacervation between pEGFP and chitosan.We selected the concentrations of chitosan and plasmid as two experimental factors,and a central composite design with two factors and five levelswas used to optimize the preparation condition of DNA-chitosan nanoparticles for high transfection efficency.The concentrations of chitosan and plasmid were selected as the independent variables,respectively.The dependent variables included average particle size and transfection efficiency.Themorphology of DNA-chitosan nanoparticles was observed using a transmission electronmicroscope.The size and zeta potential of nanoparticlesweremeasured by dynamic light scattering(DLS)and electrophoretic light scattering(ELS),respectively.The stability of plasmids in the process of nanoparticles preparation was investigated through the agrose gel electrophoresis.The expression of plasmids delivered by nanoparticleswas observed under an inverted fluorescencemicroscope. The transfection efficiency of DNA-chitosan nanoparticleswas assayed by flow cytometry.ResultsThe preparation condition of DNA-chitosan nanoparticleswith high transfection efficency was optimized successfully.Under the optimum preparative conditions,the DNA-chitosan nanoparticles were almost spherical.The average size of nanoparticles was 217.6nm,and distributed in a narrow range with a polydispersity index of0.241.The zeta potentialwas+22.4mV,which suggested thata den-sity of positive charge existonto the surface of nanoparticles and consequently enhanced the stability of nanoparticles suspension.The results ofgelelectrophoresis showed thatplasmidswere not destroyed in the process of nanoparticles preparation.The cell transfection of nanoparticleswas very highly efficient.Thenanoparticles could effectively deliver the pEGFP plasmids into cells to express the green fluorescent protein ata high level. Conclusion邵帅1,4,崔光华2,周旭3,高钟镐1,黄伟1(1.中国医学科学院、北京协和医学院药物研究所药物制剂研究室,北京 100050;2.军事医学科学院毒物药物研究所药物制剂研究室,北京 100850;3.中国人民解放军302医院,北京 100039;4.延边大学药学院药剂学教研室,吉林延吉 133000)The established mathematic models have the good predictive function.Under the optimum preparative conditions,the DNA-chitosan nanoparticles have the high potential of cell transfection.
nanoparticles;plasmid DNA;central composition design;chitosan;transfection efficency
Q343 [文献标志码]A [文章编号]1006-0111(2014)06-0419-06
10.3969/j.issn.1006-0111.2014.06.006
2013-12-15
2014-06-13
[本文编辑]李睿旻
北京市自然科学基金资助项目(7142114);中央级公益性科研院所基本科研业务费专项基金(2014ZD02);协和青年科研基金(2012G07).
邵帅,硕士研究生.Tel:(010)63026505,E-mail:shaohuai1481@126.com.
黄伟,副研究员,硕士研究生导师.Tel:(010)63026505,E-mail:huangwei@imm.ac.cn.
