神经节苷脂-1与康复训练对缺血缺氧性脑损伤大鼠神经功能的影响①
2014-05-25王珂杨会娟马俊候梅
王珂,杨会娟,马俊,候梅
神经节苷脂-1与康复训练对缺血缺氧性脑损伤大鼠神经功能的影响①
王珂1,杨会娟2,马俊1,候梅1
目的探讨神经节苷脂-1(GM1)和康复训练对大鼠缺血缺氧性脑损伤(HIBD)后功能恢复的影响及可能机制。方法48只Sprague-Dawley幼鼠建立HIBD模型,分为对照组、GM1组、康复训练(R)组、GM1+康复训练(GM1+R)组及假手术组。各组大鼠采用悬吊试验、斜坡试验和水迷宫试验进行评定。免疫组化法检测海马、额叶皮质神经元活化型caspase-3表达。结果各组间悬吊试验、斜坡试验结果有非常高度显著性差异(P<0.001),从高到低依次为假手术组、GM1+R组、R组、GM1组和对照组(P<0.05)。各组间寻找平台潜伏期有非常显著性差异(P<0.01),对照组和GM1组较假手术组长(P<0.05)。GM1组和R组的海马、额叶皮质活化型caspase-3水平与假手术组有显著性差异(P<0.05),GM1组、R组及GM1+R组海马活化型caspase-3与对照组有显著性差异(P<0.05),R组和GM1+R组额叶皮质活化型caspase-3与对照组有显著性差异(P<0.05)。海马、额皮质活化型caspase-3的表达与悬吊试验、斜坡试验结果正相关(P<0.05),与水迷宫试验无明显相关(P>0.05)。结论早期康复训练及应用GM1对HIBD神经功能恢复有一定疗效,联合应用存在协同效应。其机制可能与神经元末梢突触后存在大量活化型caspase-3有关。
缺血缺氧性脑损伤;神经节苷脂-1;康复;caspase-3;大鼠
[本文著录格式]王珂,杨会娟,马俊,等.神经节苷脂-1与康复训练对缺血缺氧性脑损伤大鼠神经功能的影响[J].中国康复理论与实践,2014,20(1):34-36.
缺血缺氧性脑损伤(hypoxic-ischemic brain damage,HIBD)给许多早产儿及低体重儿留下了严重后遗症,包括脑性瘫痪、认知障碍、视听障碍、癫痫等,严重影响患儿的生活质量,给社会和家庭带来了沉重的负担。神经节苷脂-1(ganglioside-1,GM1)是目前临床较常用于治疗HIBD的神经营养药物,能够保护受损神经元,促进其轴突的发芽、生长、分化等。康复训练是改善HIBD后遗症患儿躯体功能最主要的治疗方式。caspases是半胱氨酸天冬氨酸家族的特殊蛋白酶,广泛存在于多细胞生物,在凋亡调节时起着枢纽作用。此家族中的caspase-3常被认为是神经细胞凋亡过程中的关键。近来的研究发现,caspase-3也是神经生长和突触活动的调节因子,学习和记忆的分子机制中都有caspase-3的参与。本研究从行为和分子生物学角度探讨GM1和康复训练对HIBD后功能恢复的影响及可能的机制。
1 对象与方法
1.1 对象
清洁级健康孕17 d的Sprague-Dawley大鼠8只,由青岛市药物检测管理局实验动物中心提供。至妊娠23 d分娩,共娩出73只幼鼠。
1.2 方法
将能够正常进乳的48只幼鼠分入各实验组,包括对照组11只,GM1组9只,康复训练组(R组)13只,GM1+R组7只,假手术组8只。2日龄时,前4组予结扎左侧颈总动脉的远端及近端,假手术组只分离不结扎。
GM1组及GM1+R组4日龄起予2 mg/ml单唾液酸神经节苷脂10 ml/kg腹腔注射,其余组给予生理盐水10 ml/kg腹腔注射,每天1次,共7 d。
R组及GM1+R组15日龄起进行康复训练。①感觉促进训练:用硬毛刷刷右侧上下肢,沿肢体长轴方向,由近端至远端,加压快速刷4个8拍,每天1次。②肢体协调性及肌力训练:大鼠睁眼后,放置于转笼里活动,每天15 min,必要时给予夹尾刺激,使其转笼。③游泳训练:放置于深约30 cm的温水槽(80×50× 55 cm)中,水面离槽口20 cm左右,用木棒驱赶大鼠在水中游泳10~15 min。共14 d。
1.3 评定方法
各组大鼠在30日龄时进行神经行为学检测。测试前1 d,让所有大鼠熟悉测试工具及环境30 min。测试选在暗室内进行。
1.3.1 悬吊试验 大鼠前爪抓住一根水平拴着的自制尼龙绳(长50 cm,直径约0.4 cm)离开桌面75 cm。记录大鼠停留在绳上时间。评分标准:1分,<10 s;2分,10~30 s;3分,0.5~2 min;4分,2~5 min;5分,>5 min;当大鼠出现双上肢沿绳横走,或屈曲躯干试图使下肢抓绳时,每项加0.5分。
1.3.2 斜坡试验 将大鼠头向下倒置于45°斜面上,记录转头向上>135°所需要的时间。
1.3.3 水迷宫试验 记录每只大鼠找到平台的潜伏期。
1.3.4 活化型caspase-3检测 行为学测试结束后,用灌流固定法处死大鼠,开颅取脑。根据大鼠立体定位图谱,取新鲜海马和额叶皮质组织,冠状断面,厚2 cm,置于10%~15%(质量浓度)甲醛中固定过夜,石蜡包埋,行连续冠状切片,片厚4µm,脱蜡水化。以caspase-3p20(L-18)羊多克隆抗体为一抗,按照链霉素抗生物素蛋白-过氧化物酶(SP)免疫组化试剂盒说明操作,于光学显微学下计数活化型caspase-3表达情况。
1.4 统计学分析
应用SPSS 13.0统计软件进行处理。各组间悬吊试验、斜坡试验、水迷宫试验比较采用单因素方差分析(One-Way ANOVA分析);活化型caspase-3表达因数据服从Possion分布,故对各组每100个神经元中阳性细胞(DAB染色呈棕色)数的平方根取反正弦函数,再进行单因素方差分析;活化型caspase-3的表达与悬吊试验、斜坡试验及水迷宫空间分辨能力测试结果的关系采用相关分析。显著性水平α=0.05。
2 结果
2.1 悬吊试验
各组悬吊试验评分有非常高度显著性差异(P<0.001),其中对照组最低(P<0.05),假手术组最高(P<0.05),GM1+R组高于GM1组(P<0.05)。见表1。
2.2 斜坡试验
各组斜坡试验有非常高度显著性差异(P<0.001),其中对照组最高(P<0.05),GM1+R组与假手术组无显著性差异(P>0.05),其余各组均高于假手术组(P<0.05);GM1+R组和R组均高于GM1组(P<0.05)。见表1。
2.3 水迷宫试验
各组潜伏期之间有非常显著性差异(P<0.01),R组和GM1+R组与假手术组间无显著性差异(P>0.05),对照组和GM1组高于假手术组(P<0.05)。见表1。
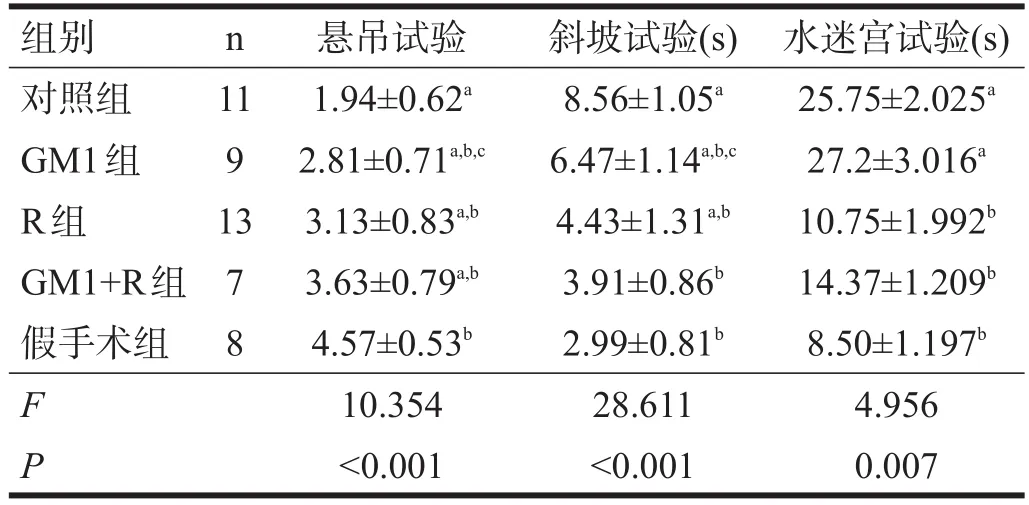
表1 各组大鼠行为学能力测试
2.4 活化型caspase-3表达
GM1组和R组的海马、额叶皮质神经元活化型caspase-3与假手术组相比有显著性差异(P<0.05),GM1+R组与假手术组比较无显著性差异(P>0.05);GM1组、R组及GM1+R组的海马活化型caspase-3与对照组有显著性差异(P<0.05);R组和GM1+R组额叶皮质活化型caspase-3与对照组比较有显著性差异(P<0.05),GM1组与对照组无显著性差异(P>0.05)。见表2。
2.5 活化型caspase-3表达与行为测试的相关性
海马、额皮质活化型caspase-3的表达均与悬吊试验、斜坡试验相关(P<0.05),而与水迷宫试验无明显相关性(P>0.05)。见表3。
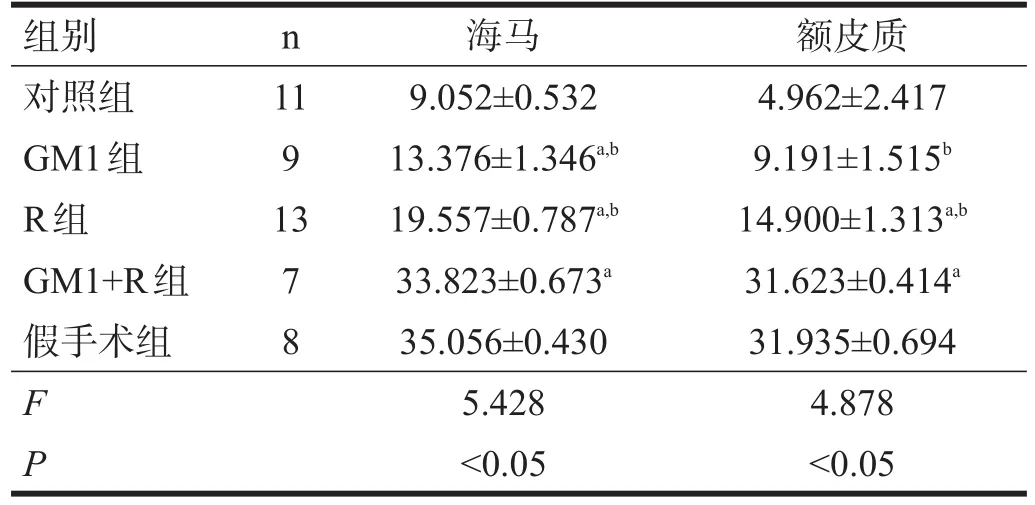
表2 大鼠海马、额叶皮质神经元活化型caspase-3表达
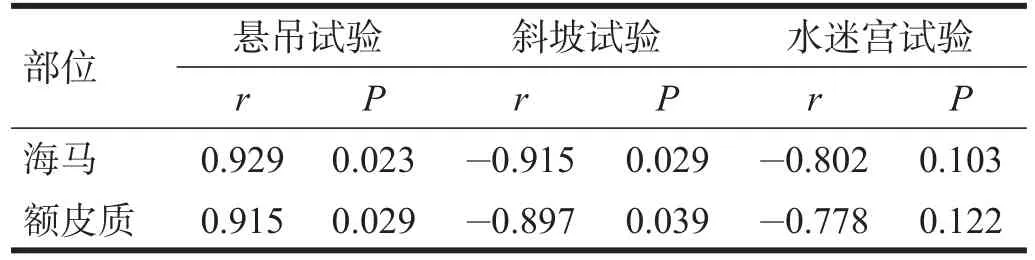
表3 活化型caspase-3表达与行为测试的相关性
3 讨论
未成熟脑缺氧缺血性损伤是造成神经系统致残性疾病的主要原因,其发病机制、预防和干预治疗等方面的研究成为近年来热点课题。2日龄大鼠的脑组织处于少突胶质细胞前体细胞的发育时期,相当于人类24~32周孕龄胎儿的发育时期[1]。此阶段出生的活产儿中,脑室周围白质软化性病变的发生率约为2‰~4‰,且随着出生胎龄的降低而升高[2]。
本研究采用2日龄幼鼠建立早产儿HIBD模型。研究显示,模型大鼠的上肢肌力和随意运动能力,以及躯体协调和平衡功能下降,与多数学者从病理学方面探讨其神经功能受损的结果一致。
中枢神经系统具有高度可塑性(plasticity),主要表现为突触的形成、结构及功能的调节,即突触形态的改变、新突触连接的形成和传递功能的建立,以及由突触的反复活动而导致的突触传递效率的增加或降低[3]。中枢神经系统受损后,早期给予丰富环境、各种感觉运动刺激、神经营养因子等均能够增强神经可塑性。
GM是组成细胞膜结构和维持膜功能的基本物质,广泛存在于中枢神经系统。作为唯一可透过血脑屏障的GM,GM1通过激活神经营养因子受体Trk,与神经元的分化、轴突的生长及突触的形成等密切相关,对中枢神经系统的发育具有重要作用。本研究显示,GM1治疗能明显提高模型动物的肌力、随意运动能力、躯体的平衡和协调功能。
Fang等发现,大鼠前肢感觉运动功能皮质损伤后,复杂综合的运动技能训练要比简单重复的运动更能刺激大脑皮质突触发生的增强,能更好地促进大鼠运动功能的恢复[4]。康复训练能够增强感觉输入,改善神经元的微环境,分泌多种神经营养因子,从而促进损伤修复,诱导神经前体细胞分裂和增殖;康复训练还能够通过抑制细胞外Ca2+内流、钙蛋白激酶的激活、细胞骨架的崩解,稳定内环境,达到保护神经元免受缺血再灌注损伤,刺激和促进神经元树突分支、轴突再生,从而引起突触重塑、神经细胞功能的恢复与代偿[5];此外,康复训练还可能促进缺血坏死区周围某些保护性神经因子的分泌,以及改变中枢神经系统某些蛋白、基因的表达,促进轴突发芽、突触重建等,从而有利于运动功能的恢复。
本研究显示,康复训练与GM1均能提高实验动物的肌力、随意运动功能、躯体的平衡和协调功能,以及空间分辨能力,二者联合应用有协同作用。
既往认为,caspases在凋亡调节过程中的起着枢纽作用,caspase-3则被认为是其中的关键[6]。近来的研究发现,神经元内caspase-3表达并非意味着细胞凋亡,也是神经生长和突触活动的调节因子。另外,学习和记忆的分子机制中都有caspase-3的参与[7]。本研究显示,应用GM1和康复训练能增加模型大鼠海马神经元内活性caspase-3表达,对额叶内caspase-3表达,GM1干预意义较小。提示单一给予GM1干预对HIBD后功能恢复的影响较小,最好结合康复训练。海马、额皮质活化型caspase-3表达与动物的运动功能相关,而与空间分辨能力无明显相关。与既往报道不尽相同。可能与本研究样本数量、质量和实验条件等方面的局限有关。
[1]French HM,Reid M,Mamontov P,et al.Oxidative stress disrupts oligodendrocyte maturation[J].Neurosci Res,2009,87(14):3076-3087.
[2]Volpe JJ,Kinney HC,Jensen FE,et al.The developing oligodendrocyte:key cellular target in brain injury in the premature infant[J].Dev Neurosci,2011,29(4):423-440.
[3]Small SL,Buccino G,Solodkin A.The mirror neuron system and treatment of stroke[J].Dev Psychobiol,2012,54(3):293-310.
[4]Fang PC,Barbay S,Plautz EJ,et al.Combination of NEP1-40 treatment and motor training enhances behavioral recovery after a focal cortical infarct in rats[J].Stroke,2010,41(3):544-549.
[5]Clarke J,Mala H,Windle V,et al.The effects of repeated rehabilitation "tune-ups"on functional recovery after focal ischemia in rats[J].Neurorehabil Neural Repair,2009,23(9):886-894.
[6]Blagonravov ML,Azova MM,Onufriev MV,et al.Activities of some caspase cascade enzymes and myocardial contractility in experimental left ventricular focal ischemia[J].Bull Exp Biol Med,2011,150(6): 672-675.
[7]Bravarenko NI,Onufriev MV,Stepanichev MY,et al.Caspase-like activity is essential for long-term synaptic plasticity in the terrestrial snail Helix[J].Eur J Neurosci,2006,23(1):129-140.
Effect of Ganglioside-1 and Rehabilitation on Recovery of Neurologic Behavior in Rats with Hypoxic-ischemic Brain Damage
WANG Ke,YANG Hui-juan,MA Jun,et al.Department of Neurological Rehabilitation,Qingdao Women&Children Hospital,Qingdao 266034,Shandong,China
ObjectiveTo investigate the effects and the possible mechanism of Ganglioside-1(GM1)and rehabilitation on neurologic behaviors of rats with hypoxic-ischemic brain damage(HIBD).Methods48 immature rats developed as model of HIBD were divided into 5 groups:control group,GM1 group,rehabilitation training group(R group),GM1+R group,and sham group.They were evaluated with Climb,Slope and Water Maze Tests.The expressions of activated caspase-3 in neurons were detected with immunohistochemistry.ResultsThe achievement of Climb and Slope Test were significantly different among groups(P<0.001),which ranked as the sham group>GM1+R group>R group>GM1 group>control group(P<0.05).The latency of Water Maze Test was significantly different among groups(P<0.01), which was longer in the control and GM1 groups than in the sham group(P<0.05).The activated caspase-3 expressed in hippocampus and frontal cortex was less in the GM1 and R groups than in the sham group(P<0.05),more in the GM1 group,R group and GM1+R group than in the control group in hippocampus(P<0.05),more in the R group and GM1+R group than in the control group in frontal cortex(P<0.05). The expression of activated caspase-3 in both hippocampus and frontal cortex correlated with the achievement of Climb and Slope Test(P<0.05),but not with the latency of Water Maze Test(P>0.05).ConclusionRehabilitation training and GM1 are effective on recovery of neural function in rats with HIBD with synergia,which may associated with the activated caspase-3 in terminal synapse.
hypoxic-ischemic brain damage;ganglioside-1;rehabilitation;caspase-3;rats
R742.3
A
1006-9771(2014)01-0034-03
2013-05-06
2013-07-08)
1.青岛市妇女儿童医院,山东青岛市266034;2.莒县人民医院儿保科,山东莒县276500。作者简介:王珂(1973-),女,山东枣庄市人,硕士研究生,主治医师,主要研究方向:脑瘫康复与癫痫诊治。通讯作者:候梅。
10.3969/j.issn.1006-9771.2014.01.009
