α-硫辛酸对2型糖尿病患者尿podocalyxin及MCP-1排泄的影响
2014-05-18鲍溪荷叶山东杨春林
鲍溪荷,徐 将,叶山东,杨春林
(安徽医科大学附属省立医院1.内分泌科、2.生化实验室,安徽合肥 230001)
α-硫辛酸(alpha-lipoic acid,ALA)是一种存在于线粒体的酵素,通过清除氧自由基、还原体内抗氧化系统、螯合金属离子等发挥强抗氧化作用[1]。临床上已被广泛用于治疗糖尿病相关并发症,但有关其对糖尿病肾脏足细胞的保护和抗炎作用的研究尚少。糖尿病肾病(diabetic nephropathy,DN)发病机制复杂,现研究认为炎症反应及足细胞损伤参与了DN发生发展的全过程[2]。足细胞损伤也已被证明[3]与DN蛋白尿及肾小球硬化密切相关。podocalyxin(PCX)正常表达于足细胞,是足细胞标志蛋白之一,对维持肾小球正常结构及滤过屏障起重要作用。本研究通过观察正常人和2型糖尿病(type 2 diabetesmellitus,T2DM)患者PCX和 MCP-1浓度的差异,以及ALA治疗前后排泄水平的变化,探讨ALA对T2DM患者肾小球足细胞的保护作用及其与抗炎之间的可能关系。
1 材料与方法
1.1 材料
1.1.1 研究对象 糖尿病组(DM组)36例,均为2011全年我院内分泌科门诊随访的T2DM患者,年龄34~66(51.50±10.40)岁,男22例,女14例。DM组依照1999年世界卫生组织糖尿病诊断标准:糖尿病症状+任意时间血浆葡萄糖水平≥11.1 mmol·L-1或空腹血浆葡萄糖(FPG)水平≥7.0 mmol·L-1或口服葡萄糖耐量试验(OGTT)试验中,2 h血浆葡萄糖(2hPG)水平≥11.1 mmol·L-1,重复一次确认。排除标准如下:①有严重心脑血管、肝、肾等疾病者;②有泌尿系统自身疾病或除糖尿病外引起的继发性肾脏疾病者;③有感染、肿瘤及免疫性疾病者;④近期发生过糖尿病急性并发症(如酮症酸中毒、高渗性昏迷及乳酸酸中毒等)和严重的慢性并发症者;⑤近期有服用肾毒性药物史者;⑥1周内服用过利尿剂、醛固酮受体拮抗剂、血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体拮抗剂及血管活性药物者。6个月结束后,受试对象共计34例(1例主动退出,1例出现酮症退出)。同期选择我院体检中心30名健康体检人员作为正常对照组(NC组),年龄32~68(51.37±9.69)岁。
1.1.2 药物和试剂 硫辛酸分散片(烟台只楚药业公司生产,批号2007L01107,100 mg/片);PCX、MCP-1 ELISA试剂盒(R&D Systems公司提供);肌酐测定试剂盒(上海荣盛生物药业有限公司提供);尿白蛋白及葡萄糖测定试剂盒(北京北方生物技术研究所提供)。
1.1.3 仪器 Biocell HT-1酶标仪(奥地利);Ultra2全自动糖化血红蛋白分析仪(Primus公司,美国);BNII全自动血浆蛋白分析仪(Behring公司,德国);7600-020全自动生化分析仪 (日立公司,日本)。
1.2 方法
1.2.1 研究方法 DM组在原有糖尿病治疗方案的基础上加用硫辛酸分散片(烟台只楚药业公司生产,批号2007L01107,100 mg/片,每天 3次,每次 2片),连续口服 6个月,受试期间控制饮食和运动,根据血糖情况调整降糖药用量,维持血糖浓度相对稳定(FPG:5.1~9.3 mmol·L-1,2hPG:10 mmol·L-1以下)。记录所有受试人员的性别、年龄、病程、SCr、收缩压(SBP)、舒张压(DBP),计算 BMI。
1.2.2 标本收集 受试者隔夜空腹8 h以上,清晨取空腹静脉血,检测糖化血红蛋白(HbA1c)、FPG及SCr,同时用无菌培养杯,收集清晨第1次中段尿4 m l,-40℃保存,待测尿ALB、Cr、PCX和MCP-1,治疗6个月后,复测上述指标。
1.2.3 检测指标 尿PCX、MCP-1采用酶联免疫吸附法(ELISA)测定,并严格按照试剂盒说明书操作;尿ALB测定采用免疫比浊法;血、尿Cr测定采用酶法;FPG检测采用己糖激酶法;HbA1c测定采用高压液相色谱法。为减少受试者尿量及浓度变化对测定结果的影响,尿PCX、MCP-1和ALB浓度分别采用尿 PCX/Cr(UPCR)、MCP-1/Cr(UMCR)、和ALB/Cr(UACR)表示。
1.3 统计学分析 数据运用统计软件SPSS 16.0进行统计分析,计量资料以表示,治疗前后组内差异分析采用配对t检验,组间比较采用两独立样本资料的t检验,数据的相关分析采用直线相关分析。
2 结果
2.1 两组基线资料比较 DM组与NC组相比,性别、年龄、病程、血肌酐(SCr)、血压、体质指数(BMI)差异无统计学意义,均具可比性,见Tab 1。DM组FPG、HbA1c及UACR、UPCR、UMCR水平较NC组明显升高(P<0.01)。
Tab 1 Comparison of clinical indexes between diabetic and normal control group

Tab 1 Comparison of clinical indexes between diabetic and normal control group
Group Age(yr) n(M/F)BMI/kg·m-2 SBP/kPa DBP/kPa SCr/μmol·L-1 NC 51.37±9.69 30(16/14)25.39±2.55 15.05±4.92 9.04±3.43 58.66±9.49 DM 51.50±10.40 34(21/13) 25.37±2.50 16.63±1.62 10.19±0.95 70.96±12.58
2.2 治疗前后 FPG、HbA1c及 UACR、UPCR、UMCR水平比较 经ALA治疗6个月后,UACR、UPCR和UMCR水平较治疗前明显下降,差异有统计学意义(P<0.01),FPG和HbA1c较治疗前比较差异无统计学意义,见Tab 2。
Tab 2 Comparison of FBG,HbA1c,UACR,UPCR and UMCR levels between the groups before and after therapy
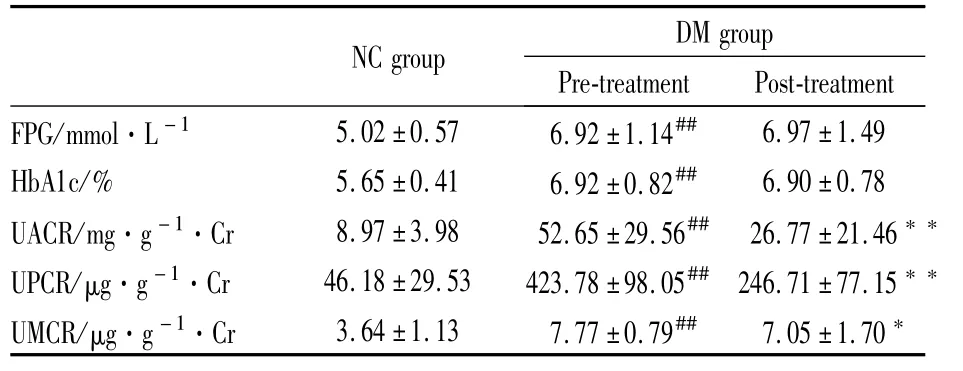
Tab 2 Comparison of FBG,HbA1c,UACR,UPCR and UMCR levels between the groups before and after therapy
##P<0.01 vs NCgroup;*P<0.05,**P<0.01 vs DM group of pre-treatment
FPG/mmol·L-1 5.02±0.57 6.92±1.14##6.97±1.49 HbA1c/% 5.65±0.41 6.92±0.82## 6.90±0.78 UACR/mg·g-1·Cr 8.97±3.98 52.65±29.56## 26.77±21.46**UPCR/μg·g-1·Cr 46.18±29.53 423.78±98.05## 246.71±77.15**UMCR/μg·g-1·Cr 3.64±1.13 7.77±0.79## 7.05±1.70*
2.3 相关性分析 以UPCR水平作为应变量,分别以UACR、UMCR为自变量进行直线相关性分析,显示UPCR与UACR、UMCR分别呈正相关(r=0.720,P<0.01)、(r=0.516,P<0.01)。
3 讨论
尿白蛋白(urinary albumin,UALB)排泄增加是反映肾脏疾病及肾小球功能受损的敏感指标,而足细胞结构和功能的改变是导致肾小球滤过膜通透性增高和蛋白尿产生的重要原因[4]。Okamura等[4]发现,DN患者的肾小球足细胞功能及结构均有不同程度损伤。PCX作为一种带负电荷的唾液粘蛋白分子,是足突顶端质膜的主要构成部分[5]。Habara等[6]研究证实,几乎所有的肾小球疾病患者尿液中均能检测到PCX。已有研究报道[7],尿PCX排泄的变化可作为足细胞损伤的早期标志物,并能监测足细胞损伤程度。本研究结果显示,T2DM患者尿PCX排泄增加,并与UALB水平呈正相关,提示T2DM患者存在足细胞损害并参与蛋白尿的形成,与文献报道一致[3-8]。
近期研究发现[5],ALA对糖尿病肾脏损害也具有较好的保护作用,但其机制不十分明确。本实验显示,ALA治疗6个月后,T2DM患者UALB和PCX排泄均明显降低,提示ALA可保护糖尿病肾小球足细胞,且作用可能与其减少UALB排泄部分有关。Tarabra等[7]发现,肾小球足细胞是MCP-1基因表达的主要部位。MCP-1与受体结合后能够刺激足细胞,增强其迁移能力,增加肾小球滤过膜通透性,引起白蛋白漏出。本实验结果显示,T2DM患者经ALA治疗后MCP-1排泄明显减少,且与UPCR水平呈正相关,提示ALA可能通过抗炎作用减轻足细胞损伤。
总之,本研究初步证实,ALA可减轻T2DM患者肾脏局部增强的炎症反应,减轻足细胞损伤、减少尿蛋白漏出,对肾脏提供一定的保护作用,确切机制值得进一步探讨。
参考文献:
[1] Ghibu S,Richard C,Delemasure S,et al.An endogenous dithiol with antioxidant properties:alpha-lipoic acid,potential uses in cardiovascular diseases[J].Ann Cardiol Angeiol(Paris),2008,57(3):161-5.
[2] 李桂林,梁尚栋.趋化因子5及其受体CCR5与糖尿病并发症[J].中国药理学通报,2011,27(10):1333-7.
[2] Li G L,Liang SD.Chemokines5 with its receptors CCR5 and diabetes complications[J].Chin Pharmacol Bull,2011,27(10):1333-7.
[3] Lee H S.Mechanisms and consequences of TGF-βoverexpression by podocytes in progressive podocyte disease[J].Cell Tissue Res,2012,347(1):129-40.
[4] Okamura K,Dummer P,Kopp J,etal.Endocytosis ofalbumin by podocytes elicits an inflammatory response and induces apoptotic cell death[J].PLoSOne,2013,8(1):e54817.
[5] Skoberne A,Konieczny A,Schiffer M.Glomerular epithelial cells in the urine:whathas to be done tomake them worthwhile[J].Am JPhysiol Renal Physiol,2009,296(2):F230-41.
[6] Habara P,MareckováH,SopkováZ,et al.A novelmethod for the estimation of podocyte injury:podocalyxin-positive elements in urine[J].Folia Biol(Praha),2008,54(5):162-7.
[7] Tarabra E,Giunti S,Barutta F,etal.Effectof themonocyte chemoattractant protein-1/CC chemokine receptor2 system on nephrin expression in streptozotocin-treated mice and human cultured podocytes[J].Diabetes,2009,58(9):2109-18.
[8] Hara M,Yamagata K,Tomino Y,etal.Urinary podocalyxin is an earlymarker for podocyte injury in patients with diabetes:establishment of a highly sensitive ELISA to detect urinary podocalyxin[J].Diabetologia,2012,55(11):2913-9.