白芍总苷对非酒精性脂肪性肝病大鼠脂质浸润及纤维化的抑制作用*
2014-05-15韩超郑琳颖吕俊华赵汝霞周永标潘卫松
韩超,郑琳颖,吕俊华,赵汝霞,周永标,潘卫松
(1.广州市中医医院科教信息科,广州 510130;2.暨南大学药学院,广州 510632;3.广州市药品检验所,广州 510160)
白芍总苷对非酒精性脂肪性肝病大鼠脂质浸润及纤维化的抑制作用*
韩超1,郑琳颖1,吕俊华2,赵汝霞2,周永标3,潘卫松3
(1.广州市中医医院科教信息科,广州 510130;2.暨南大学药学院,广州 510632;3.广州市药品检验所,广州 510160)
目的 研究白芍总苷(TGP)对果糖-高脂诱导非酒精性脂肪性肝病大鼠(NAFLD)脂质浸润及纤维化的作用。方法建立果糖-高脂诱导NAFLD大鼠模型,用药组分别灌胃给予二甲双胍(200 mg·kg-1)、TGP大剂量、小剂量(给予TGP 200,100 mg·kg-1);正常对照组和模型对照组均灌胃等量纯化水(10 mL·kg-1)。4周后,各组大鼠腹主动脉取血,检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)活性;空腹血糖(FBG)、三酰甘油(TG)含量;检测胰岛素(INS)含量,计算胰岛素敏感指数(ISI)的变化;检测游离脂肪酸(FFA),脂肪细胞因子(Apelin-36)、内脏脂肪素(visfatin)、胶原Ⅲ(COLⅢ)及胶原Ⅳ(COLⅣ)的含量;解剖大鼠,取肝脏,测定肝组织中TG含量,光镜下观察肝脏组织病理学改变。结果与模型对照组比较,TGP能有效降低NAFLD大鼠的FBG、Fins含量,提高ISI指数;降低血清和肝组织中TG含量,降低血清ALT、AST活性及FAA、Apelin,visfatin,COLⅢ,COLⅣ含量,结果均差异有统计学意义(P<0.05或P<0.01);镜检显示TGP能改善NAFLD大鼠肝脏脂质浸润及纤维化的病理学改变。结论TGP可能通过改善NAFLD大鼠异常的糖脂代谢及拮抗胰岛素抵抗,有效抑制NAFLD大鼠的脂质浸润及纤维化。
白芍总苷;果糖;肝病,脂肪性,非酒精性;脂质浸润;肝纤维化
代谢综合征(metabolic syndrome,MS)是一组代谢紊乱疾病,其基本特征包括糖代谢异常、胰岛素抵抗(insulin resistance,IR)、中心性肥胖、脂代谢紊乱、高血压等综合征[1]。大量研究表明,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)与MS的关系密切,甚至认为NAFLD是MS的一个临床特点或肝脏表现[2]。本课题组既往研究显示,TGP对IR-脂肪肝有增强胰岛素敏感性、降低血脂和保肝的作用[3-4]。大量研究证实,果糖能干扰糖脂代谢,促进IR,形成MS;并刺激肝脏脂肪生成,形成NAFLD[5-7]。白芍总苷(total glucosides of paeony,TGP)是从中药白芍中提取的有效成分。近年药理研究表明,TGP通过拮抗氧化应激反应、调节导致疾病产生和发展的炎症细胞因子及影响其相关的信号转导通路、调节相关的细胞凋亡等作用机制,常用于治疗心血管、消化、内分泌代谢、皮肤和骨骼系统病变[8]。笔者采用果糖诱导制备NAFLD-MS模型,探讨TGP抑制其脂质浸润及纤维化的作用及其机制。
1 材料与方法
1.1 动物 清洁级斯泼累格·多雷(Sprague Dawley, SD)大鼠,体质量150~180 g,6周龄,雌雄各半,购自广东省医学实验动物中心,生产许可证:SCXK(粤) 2008-0002;使用许可证:SYXK(粤)2008-0084;动物饲养于干燥、通风、安静的环境。
1.2 试药 白芍总苷胶囊(商品名:帕夫林,宁波立华制药有限公司生产,批号:H20055058);盐酸二甲双胍片(商品名:美迪康,深圳市中联制药有限公司生产,批号:H44024853);果糖(批号:AF10070111-100729-855687,archer daniels midland company);天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、游离脂肪酸(free fatty acid,FFA)和葡萄糖测定试剂盒(南京建成生物工程研究所,批号分别为20111117, 20111115,20111206,20111222);三酰甘油(triglycerides,TG)测定试剂盒(北京北化康泰临床试剂有限公司,批号:20111212);胰岛素(INS)放免检测试剂盒(北京华英生物技术研究所,批号:20111227);脂肪细胞因子(apelin-36),内脂素(visfatin),胶原Ⅲ(collagenⅢ,COLⅢ),胶原Ⅵ(collagenⅥ,COLⅥ)酶联免疫吸附测定(enzyme-linked immuno-sorbent assay, ELISA)试剂盒(美国Assay公司,批号分别为R10356-09,E30165,E30458,E30178)。
1.3 仪器 FHS-2A可调高速组织匀浆机(金坛市宏华仪器厂);DK-S22型电热恒温水浴锅(上海精宏实验设备有限公司);TGL-16G型高速冷冻离心机(上海安亭科学仪器厂);TU-1800紫外-可见分光光度计(北京普析通用仪器公司);RM2135型切片机(德国LEICA公司);NIKON EC30型倒置光学显微镜及COOLPIX99 NIKON数码相机(日本NIKON公司);多功能全波长酶标仪(美国BioTelc公司);R-911全自动放免计数仪(中国科技大学实业总公司)。
1.4 动物造模与分组 取健康SD大鼠60只,雌雄各半,适应性饲养1周,按体质量随机分为正常对照组和造模组。参考文献[3-4,9]的方法,并对方法加以改良,把文献中饮用10%蔗糖水改为10%果糖水进行造模。在造模的第6周末,禁食12 h后,在正常对照组和造模组各随机抽取大鼠2只,取肝脏做病理切片,在光镜下观察到正常对照组肝细胞、肝索、肝窦均无明显的病理变化;造模组肝细胞明显肿胀,体积较正常明显增大,大量肝细胞出现颗粒、空泡变性,局部肝细胞出现坏死、核碎裂、溶解,细胞质内充满大小不等的脂滴,界限不清,肝窦不清,肝索排列絮乱,显示复制NAFLD模型成功[10-11]。随后,把造模组按体质量随机分为模型对照组、阳性对照组(给予二甲双胍200 mg·kg-1)、白芍总苷大剂量组、小剂量组(给予白芍总苷200,100 mg·kg-1),灌胃给药,qd,连续28 d;正常对照组和模型对照组均灌胃等容量纯化水(10 mL·kg-1)。药物剂量均根据药理试验中动物与人体间的等效剂量换算得出。
1.5 标本采集及指标观察 用药第4周末,各组大鼠禁食不禁水12 h,以3%戊巴比妥钠(20 mg·kg-1)腹腔注射麻醉后,腹主动脉取血,3 000 r·min-1(r= 15 cm)离心15 min,分离血清,按照试剂盒说明书方法测定ALT、AST活性;检测空腹血糖(fasting blood glucose,FBG)、TG含量;检测INS含量,计算胰岛素敏感指数(insulin-sensitivity index,ISI)的变化;检测FAA、apelin和visfatin含量。取新鲜肝左叶用4%甲醛溶液固定,苏木精-伊红(hematoxylin and eosin,HE)染色观察病理组织学变化。
1.6 统计学方法 数据应用SPSS18.0版统计软件进行统计分析,以均数±标准差(±s)表示,计量资料采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 血糖、胰岛素及胰岛素敏感指数 与正常对照组比较,模型对照组FBG、INS含量显著升高(P<0.01), ISI指数显著降低(P<0.01)。与模型对照组比较,各药物组均能明显降低病鼠的FBG和INS(P<0.01),升高ISI指数(P<0.01)。见表1。
2.2 血清和肝组织TG 与正常对照组比较,模型对照组血清及肝组织的TG均显著升高(P<0.01)。与模型对照组比较,各药物组均能明显降低病鼠的TG (P<0.05或P<0.01)。见表2。
2.3 血清相关酶、细胞因子及肝指数 与正常对照组比较,模型对照组大鼠血清的ALT,AST水平及FFA、visfatin,COLⅢ,COLⅣ含量均显著升高(P<0.01)。与模型对照组比较,各药物组均能明显降低病鼠AST过高的活性(P<0.01);降低FFA、Apelin,visfatin,COLⅢ及COLⅣ的含量(P<0.05或P<0.01);除白芍总苷小剂量组外,其他药物组大鼠的ALT活性(P<0.01)均显著降低。见表3。
表1 5组大鼠血糖、胰岛素及胰岛素敏感指数的测定结果Tab.1 Determination results of FBG,INS and ISI in five groups of rats ±s
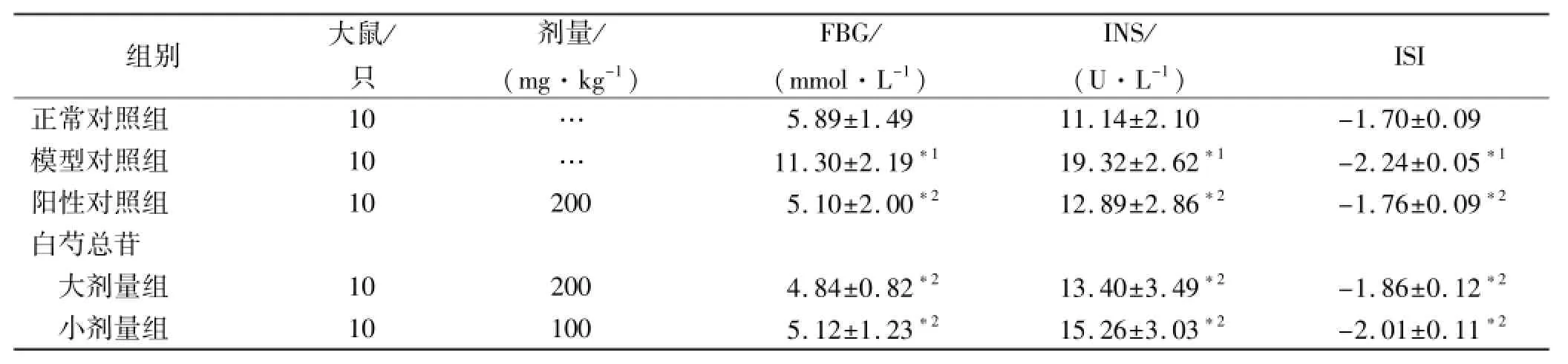
表1 5组大鼠血糖、胰岛素及胰岛素敏感指数的测定结果Tab.1 Determination results of FBG,INS and ISI in five groups of rats ±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.01Compared with normal control group,*1P<0.01;Compared with model control group,*2P<0.01
ISI正常对照组10…组别大鼠/只剂量/ (mg·kg-1) FBG/ (mmol·L-1) INS/ (U·L-1) 5.89±1.4911.14±2.10-1.70±0.09模型对照组10…11.30±2.19*119.32±2.62*1-2.24±0.05*1阳性对照组102005.10±2.00*212.89±2.86*2-1.76±0.09*2白芍总苷大剂量组102004.84±0.82*213.40±3.49*2-1.86±0.12*2小剂量组101005.12±1.23*215.26±3.03*2-2.01±0.11*2
表2 5组大鼠血清和肝组织TG测定值Tab.2 Determination results of TG in serum and liver tissue in five groups of rats ±s
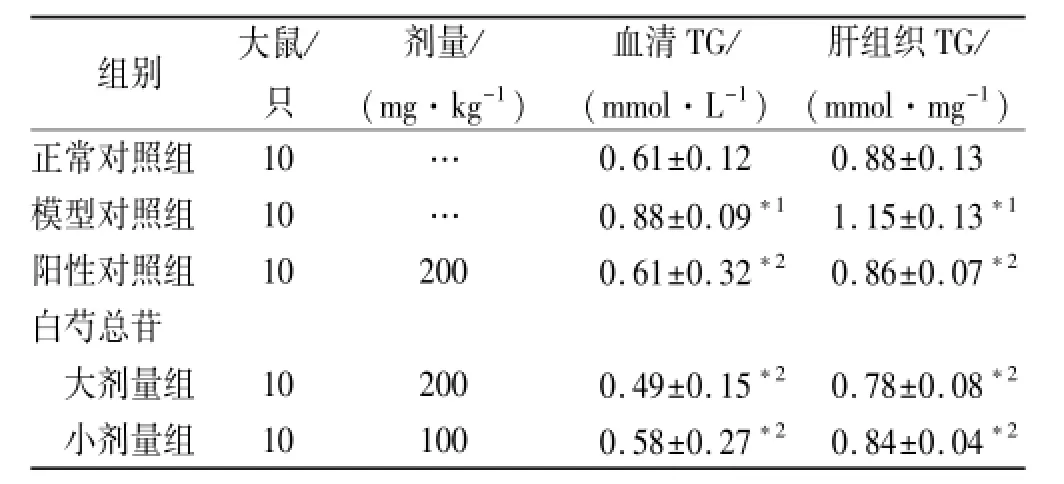
表2 5组大鼠血清和肝组织TG测定值Tab.2 Determination results of TG in serum and liver tissue in five groups of rats ±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.01Compared with normal control group,*1P<0.01;Compared with model control group,*2P<0.01
组别大鼠/只剂量/ (mg·kg-1)血清TG/ (mmol·L-1)肝组织TG/ (mmol·mg-1)正常对照组10…0.61±0.120.88±0.13模型对照组10…0.88±0.09*11.15±0.13*1阳性对照组102000.61±0.32*20.86±0.07*2白芍总苷大剂量组102000.49±0.15*20.78±0.08*2小剂量组101000.58±0.27*20.84±0.04*2
2.4 大鼠肝组织病理学影响 造模分组后,各组均灌胃给予相应药物干预治疗4周,病理镜检显示:正常对照组的肝脏结构完整,肝索排列有序,肝索以中央静脉为中心呈放射状排列,结构清楚,肝细胞为单核或双核,颗粒大小均匀一致,无明显的病理变化(图1A)。模型对照组肝细胞明显肿胀呈圆形,细胞核被挤向一边,体积较正常明显增大,大量肝细胞出现颗粒、空泡变性,局部肝细胞出现坏死、核碎裂、溶解,细胞质内充满大小不等的脂滴,界限不清,肝窦不清,肝索排列紊乱,从中央静脉向外周方向出现胞质淡染,汇管区有少量炎细胞浸润(图1B)。阳性对照组肝窦清楚,肝索排列较整齐,脂滴减少或消失,汇管区有少量的炎性细胞浸润(图1C);白芍总苷大剂量组肝细胞结构近似于正常对照组,肝窦清楚,肝索排列较整齐,汇管区有少量炎性细胞浸润(图1D);白芍总苷小剂量组肝细胞结构近似于正常对照组,肝窦清楚,肝索排列较整齐,汇管区有较多炎性细胞浸润(图1E)。
3 讨论
目前,NAFLD的发病机制尚未完全清楚,“二次打击”是目前广为接受的关于NAFLD发病机制学说。第一次打击是指IR,导致大量的FFA和TG在肝脏沉积,形成肝细胞脂肪变。第二次打击即氧化应激和脂质过氧化反应,造成肝细胞损伤和炎症反应[12]。另外, NAFLD意味着内脏脂肪的沉积,而内脏脂肪被认为是内分泌器官,能够分泌多种激素、促炎性细胞因子和抗炎性因子[13-14],如瘦素、脂联素等,均参与了IR的发生与进展。治疗NAFLD的首要目标是改善IR、纠正代谢紊乱,次要目标是减少肝脏脂肪沉积[15]。visfatin是AKBAL等[16]于2005年研究发现的一种新的具有结合并激活胰岛素受体、发挥类胰岛素样作用的激素,并通过旁分泌途径作用于内脏脂肪组织,促进脂肪组织的分化合成及积聚;还可诱导多种炎性因子的表达,导致全身或局部炎症反应,因此,有研究认为,visfatin很可能是一个重要的前炎性因子。血清visfatin浓度与内脏脂肪的数量有很强的相关性,但与皮下脂肪关系不大。还有研究发现,visfatin在NAFLD患者血清中的浓度升高,而在肝硬化患者则含量下降[17],提示降低visfatin可能可阻断或抑制NAFLD的病情进展[18]。
Apelin是孤独G蛋白耦联受体(APJ)的内源性配体,是由脂肪细胞分泌的一种新的脂肪因子,与IR、肥胖及糖尿病关系密切[19]。Apelin-APJ系统是具有多种生物学效应生理调节肽。Apelin能诱导肥胖大鼠增加肥胖、IR、肝脏氧化应激和炎症的作用,而改善胰岛素敏感性后,能恢复脂肪细胞Apelin对胰岛素延迟反应[20-21]。最近研究结果表明[22],Apelin含量与NAFLD患者的体质量指数及IR指数呈正相关。近年来研究发现[23],肝脏间质的星状细胞亦可表达Apelin,而其受体APJ则由肝实质细胞表达。在肝硬化时,Apelin在肝星状细胞表达明显增加,提示Apelin在炎症反应和纤维化过程中发挥了重要作用[24]。Apelin能促进肝硬化动脉毛细血管增殖,而阻断APJ干预肝纤维化的进程[25-26]。
表3 5组大鼠血清ALT、AST、FFA、Apelin,visfatin,COLⅢ和COLⅣ测定值Tab.3 Determination results of the serum level of ALT,AST,FFA,Apelin,visfatin,COLⅢand COLⅣin five groups of rats ±s
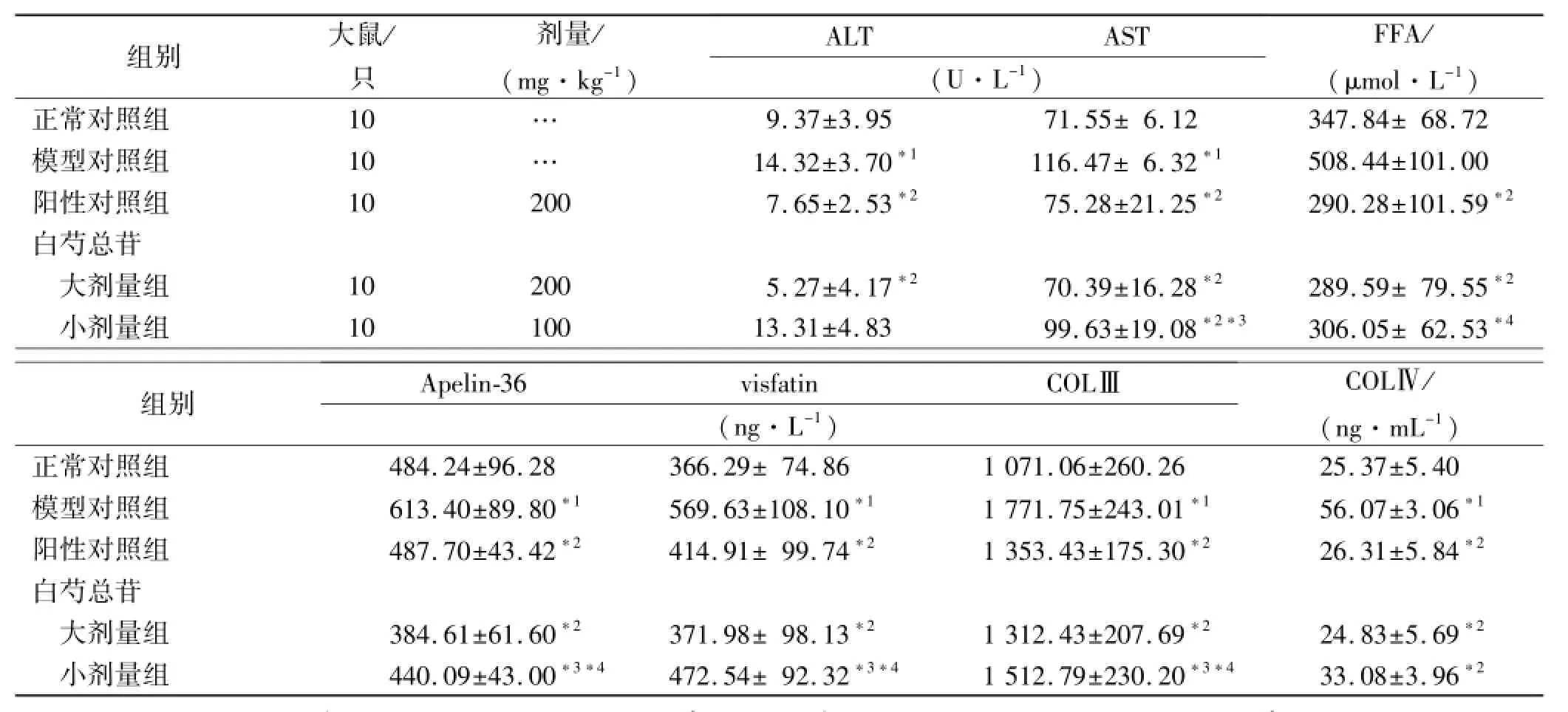
表3 5组大鼠血清ALT、AST、FFA、Apelin,visfatin,COLⅢ和COLⅣ测定值Tab.3 Determination results of the serum level of ALT,AST,FFA,Apelin,visfatin,COLⅢand COLⅣin five groups of rats ±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.01,*4P<0.05;与白芍总苷大剂量组比较,*3P<0.01Compared with normal control group,*1P<0.01;Compared with model control group,*2P<0.01,*4P<0.05;Compared with high-dose TGP group,*3P<0.01
?
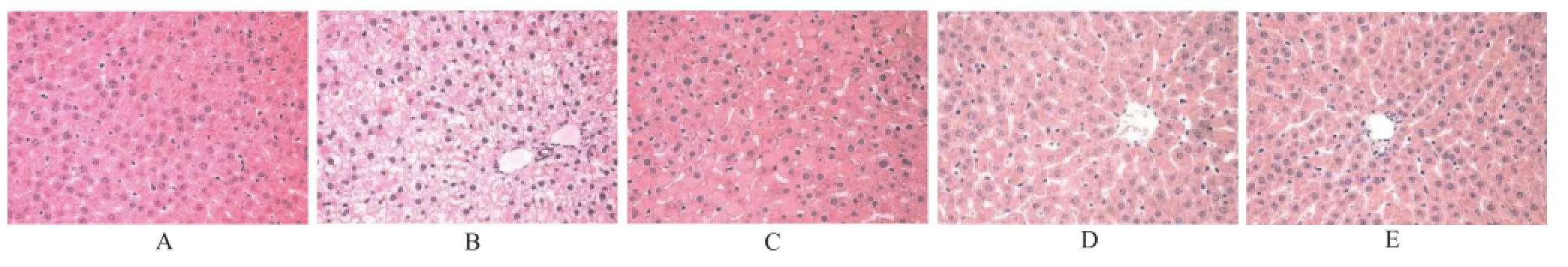
A.正常对照组;B.模型对照组;C.阳性对照组;D.白芍总苷大剂量组;E.白芍总苷小剂量组图1 5组大鼠第10周末肝脏组织病理学改变(HE,×20)A.normal control group;B.model control group;C.positive control group;D.high-dose TGP group;E.low-dose TGP groupFig.1 Histopathological changes of liver in five groups of rats at the 10thweek(HE,×20)
本课题组前期研究证明,高脂饮食可导致糖脂代谢紊乱、高胰岛素血症、IR、脂肪肝和高血压[3-4]。果糖代谢不依赖于胰岛素,并可致一系列MS疾病,在摄入相同热量的情况下,摄入果糖更容易导致脂肪沉淀,同时会使NAFLD患者肝脏中的果糖激酶和脂肪酸合成酶表达明显增加,从而加速果糖的代谢和脂肪酸的合成,促进肝脏脂质沉积,形成恶性循环[24,27]。因此,用果糖代替蔗糖进行造模,并取得成功。造模结果显示,用果糖-高脂诱导造模组大鼠同样出现糖脂代谢紊乱、高胰岛素血症、IR、肝功能异常和肝脂肪沉积,以及apelin和visfatin含量增高等病变,与高脂、高蔗糖饮食引起的IR、MS疾病及NAFLD的形成类似[10-11,28],而且模型复制更为明显和快捷。据此,笔者认为,用果糖代替蔗糖来造模效果可能更好。目前二甲双胍是公认治疗糖尿病的首选药,临床上广泛用于治疗NAFLD[29]。二甲双胍不仅提高胰岛素敏感性,通过直接作用于肝脏胰岛素信号,还可通过改变肠道渗透率和随后的内毒素依赖活化的肝枯否细胞,干预果糖诱发NAFLD,从而保护肝脏[30]。二甲双胍还可改善果糖诱发代谢综合征大鼠的高血压病[31]。因此,本组实验采用二甲双胍作为NAFLD实验的阳性对照药,并证明实验是成功的。
本研究结果显示,白芍总苷和二甲双胍均可降低NAFLD大鼠的FBG、INS含量,提高ISI,改善胰岛素敏感性及异常的糖脂代谢;降低病鼠血清中ALT,AST的活性及FFA、COLⅢ、COLⅣ的含量,降低病鼠血清和肝组织中的TG,从而减轻肝细胞脂肪沉积,改善肝功能;下调visfatin和Apelin表达,改善IR、减轻炎症反应、抑制肝纤维化;从肝脏病理组织学观察显示,TGP能减轻肝细胞炎性细胞浸润,改善脂肪变性,抑制脂质浸润,有利于肝细胞和肝组织结构、形态恢复正常。由此,笔者推断,白芍总苷和二甲双胍抑制果糖-高脂诱导NAFLD大鼠的脂质浸润及纤维化作用,可能是药物通过改善脂质代谢、提高胰岛素敏感性、下调visfatin和Apelin表达,拮抗IR,抑制慢性低度炎症反应等作用的综合结果。
[1] FERDER L,FERDER M D,INSERRA F.The role of highfructose corn syrup in metabolic syndrome and hypertension [J].Curr Hypertens Rep,2010,12(2):105-112.
[2] 赵辉,胡滨,于书君,等.代谢综合征各组分与非酒精性脂肪肝发病风险的关系[J].大连医科大学学报,2012, 34(6):586-589.
[3] 郑琳颖,潘竞锵,吕俊华.白芍总苷对脂肪肝大鼠增强胰岛素敏感性及抗脂肪肝作用[J].中国中药杂志,2008, 33(20):2385-2390.
[4] 冯瑞儿,郑琳颖,吕俊华,等.白芍总苷对代谢综合征-高血压大鼠改善胰岛素敏感性、降压和抗氧化作用[J].中国临床药理学与治疗学,2010,15(2):154-159.
[5] LIM J S,MIETUS-SNYDER M,VALENTE A,et al.The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome[J].Nat Rev Gastroenterol Hepatol,2010,7(5): 251-264.
[6] DEKKER M J,SU Q,BAKER C,et al.Fructose:a highly lipogenic nutrient implicated in insulin resistance,hepatic steatosis,and the metabolic syndrome[J].Am J Physiol Endocrinol Metab,2010,299(5):685-694.
[7] YILMAZ Y.Review article:fructose in non-alcoholic fatty liver disease[J].Aliment Pharmcol Ther,2012,35(10): 1135-1144.
[8] 郑琳颖,潘竞锵,吕俊华,等.白芍总苷药理作用研究[J].广州医药,2011,42(3):66-69.
[9] SANCHEZ-LOZADA L G,MU W,RONCAL C,et al. Comparison of free fructose and glucose to sucrose in the ability to cause fatty liver[J].Eur J Nutr,2010,49(1):1-9.
[10] 郑琳颖,潘竞锵,杨以琳,等.白芍总苷对非酒精性脂肪性肝病大鼠Apelin和Visfatin表达的影响[J].中药新药与临床药理,2013,24(1):51-54.
[11] 赵汝霞,郑琳颖,潘竞锵,等.白芍总苷对NAFLD模型大鼠肝脏保护作用的抗氧化机制[J].广东药学院学报, 2012,28(4):430-434.
[12] 楚蓝.非酒精性脂肪肝及其与代谢综合征关系的研究进展[J].国外医学:卫生学分册,2009,36(6):383-385.
[13] GNACINSKA M,MALGORZEWICA S,LYSIAK-SZYDLOWSKA W,et al.The serum profile of adipokines in overweightpatientswithmetabolicsyndrome[J]. Endokrynol Pol,2010,61(1):36-41.
[14] WOZNIAK S E,GEE L L,WACHTEL M S,et al.Adipose tissue:the new endocrine organ a review article[J].Dig Dis Sci,2009,54(9):1847-1856.
[15] 中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[16] AKBAL E,KOCAK E,TAS A,et al.Visfatin levels in nonalcoholic fatty liver disease[J].J Clin Lab Anal,2012, 26(2):115-119.
[17] DE BOER J F,BAHR M J,BOKER K H,et al.Plasma levels of PBEF/Nampt/visfatin are decreased in patients with liver cirrhosis[J].Am J Physiol Gastrointest Liver Physiol,2009,296(2):196-201.
[18] CHANG Y C,CHANG T J,LEE W J,et al.The relationship of visfatin/pre-B-cell colony-enhancing factor/nicotinamide phosphoribosyltransferaseinadiposetissuewith inflammation,insulin resistance,and plasma lipids[J]. Metabolism,2010,59(1):93-99.
[19] GARCIA-DIAZ D,CAMPION J,MILAGRO F I,et al. Adiposity dependent apelin gene expression:relationships with oxidative and inflammation markers[J].Mol Cell Biochem,2007,305(1-2):87-94.
[20] GARCIA-DIAZ D F,CAMPION J,ARELLANO A V,et al. Fat intake leads to differential response of rat adipocytes to glucose,insulin and ascorbic acid[J].Exp Biol Med (Maywood),2012,237(4):407-416.
[21] PRINCIPE A,MELGAR-LESMES P,FERNANDEZ-VARO G,et al.The hepatic apelin system:a new therapeutic target for liver disease[J].Hepatology,2008,48(4):1193-1201.
[22] ERCIN C N,DOGRU T,TAPAN S,et al.Plasma apelin levels in subjects with nonalcoholic fatty liver disease[J]. Metabolism,2010,59(7):977-981.
[23] MELGAR-LESMES P,CASALS G,PAUTA M,et al.Apelin mediates the induction of profibrogenic genes in human hepatic stellate cells[J].Endocrinology,2010,151(11): 5306-5314.
[24] SANCHEZ-LOZADA L G,MU W,RONCAL C,et al. Comparison of free fructose and glucose to sucrose in the ability to cause fatty liver[J].Eur J Nutr,2010,49(1):1-9.
[25] YOKOMORI H,ODA M,YOSHIMURA K,et al.Enhanced expressionsofapelinonproliferativehepaticarterial capillaries in human cirrhotic liver[J].Hepatol Res,2012, 42(5):508-514.
[26] REICHENBACH V,ROS J,FERNANDEZ-VARO G,et al. Prevention of fibrosis progression in CCl4-treated rats:role of the hepatic endocannabinoid and apelin systems[J].J Pharmacol Exp Ther,2012,340(3):629-637.
[27] SAMUEL V T.Fructose induced lipogenesis:from sugar to fat to insulin resistance[J].Trends Endocrinol Metab, 2011,22(2):60-65.
[28] LIM J S,MIETUS-SNYDER M,VALENTE A,et al.The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome[J].Nat Rev Gastroenterol Hepatol,2010,7(5): 251-264.
[29] BARBERO-BECERRA V J,SABTIAGO-HERNANDEZ J J, VILLEGAS-LOPEZ F A,et al.Mechanisms involved in the protective effects of metformin against nonalcoholic fatty liver disease[J].Curr Med Chem,2012,19(18):2918-2923.
[30] SPRUSS A,KANURIG,STAHL C,et al.Metformin protects against the development of fructose-induced steatosis in mice:role of the intestinal barrier function[J].Lab Invest, 2012,92(7):1020-1032.
[31] PUYO A M,BORRONI J S,BOUDOU S,et al.Metformin reduces vascular production of vasoconstrictor prostanoids in fructose overloaded rats[J].Auton Autacoid Pharmacol, 2012,32(1 Pt 2):9-14.
DOI 10.3870/yydb.2014.10.010
Inhibitory Effects of Total Glucosides of Paeony on Lipid Infiltration and Fibrosis in NAFLD Rats Induced by Fructose and High-fat Diet
HAN Chao1,ZHENG Lin-ying1,LYU Jun-hua2,ZHAO Ru-xia2,ZHOU Yong-biao3,PAN Wei-song3
(1. Department of Information,Guangzhou Hospital of Traditional Chinese Medicine,Guangzhou 510130,China;2. Pharmacological College of Jinan University,Guangzhou 510632,China;3.Guangzhou Institute of Drugs Inspection,Guangzhou 510160,China)
ObjectiveTo investigate the effect of total glucosides of paeong(TGP)on the liver lipid infiltration and fibrosis in rats with non-alcoholic fatty liver disease(NAFLD)induced by fructose and high-fat diet.MethodsFructose-highfatty induced NAFLD rat model was established.Metformin(MET,200 mg·kg-1)and TGP(200,100 mg·kg-1)was intragastrically given to the rats in the treatment group,TGP high dose and low dose group,respectively.Normal control group and model control group was intragastrically treated with equivalent distilled water(10 mL·kg-1).At the fourth week after the treatment,all the rats were sacrificed and the indices such as serum fasting blood glucose(FBG),INS,insulin sensitivity index (ISI),triglycerides(TG),apelin-36,visfatin,alanine aminotransferase(ALT),aspartate aminotransferase(AST),free fatty acid (FFA),collagenⅢ(COLⅢ),collagenⅣ(COLⅣ)were determined.Hepatic content of TG was determined and the pathological changes in the liver tissues were observed under the microscope.ResultsAs compared with the model control group,TGP effectively decreased FBG,INS,TG in serum and liver tissues,activity of ALT and AST in serum and content of FAA,Apelin, Visfatin,COLⅢand COLⅣ,with significant differences(P<0.05 orP<0.01).TGP alleviated lipid infiltration and fibrosis in rat liver tissues.ConclusionTGP can inhibit effectively lipid infiltration and fibrosis of NAFLD rats,probably through improving glucolipid metabolism and antogonizing insulin resistance.
Total glucosides of paeong;Fructose;Liver disease,fatty,nonalcoholic;Lipid infiltration;Liver fibrosis
R965
A
1004-0781(2014)10-1294-06
2013-10-24
2013-12-24
*广州市科技计划项目(2010Y1-C491);广州市中医药中西医结合科技项目(2009-A-10)
韩超(1973-),女,海南文昌人,副主任药师,学士,研究方向:从事中药学及实验药理学研究。电话:020-81226220,E-mail:wendyhan@163.com。
