烟草GA代谢相关基因ga1和ga2的克隆和表达分析
2014-05-15丁安明陈雅琼ZahidHussain张蕴睿崔萌萌孙玉合
丁安明,陈雅琼,Zahid Hussain,康 乐,张蕴睿,崔萌萌,王 倩,孙玉合*
烟草GA代谢相关基因和的克隆和表达分析
丁安明1,2,陈雅琼1,2,Zahid Hussain1,2,康 乐1,2,张蕴睿1,2,崔萌萌1,王 倩1,孙玉合1*
(1.中国农业科学院烟草研究所,烟草行业烟草基因资源利用重点实验室,青岛 266100;2.中国农业科学院研究生院,北京 100081)
为了解赤霉素(gibberellic acids, GA)在烟草生长发育中的作用,本研究利用同源克隆和RACE技术分离了3个烟草种GA代谢相关基因和的6条序列,对其进行了序列比对和进化分析;并利用荧光定量表达分析研究了其在林烟草和普通烟草中的表达谱。结果表明,相关基因在烟草属和茄科作物中保守性很高;普通烟草中克隆的和可能起源于绒毛状烟草。表达分析表明,和在林烟草生长发育早期和茎伸长期分别在叶和茎中的表达量显著高于其他组织。
烟草;赤霉素;荧光定量表达分析
赤霉素(gibberellic acids, GA)是调节植物生长发育的一类重要的二萜类激素,作用于植物整个生命周期,包括种子萌发、茎的伸长、开花诱导、花药发育及种子和果实的生长等[1-2]。目前,植物中GA的代谢途径已经基本确定,由C20前体牻牛儿牻牛儿基焦磷酸(geranylgeranyl diphoaphate, GGDP)经一系列酶催化生成[3]。该代谢途径的第一步和第二步催化反应在植物叶绿体内完成,由古巴焦磷酸合酶(ent-copalyl pyrophosphate synthase, CPS)和内根-贝壳杉烯合酶(ent-kaurene synthase, KS)催化GGDP形成内根-贝壳杉烯。编码CPS和KS两种酶的基因分别为和,并已在拟南芥、水稻、豌豆等植物中进行了克隆和功能验证分析[4-8]。Sun等[5]从拟南芥野生型分离了全长cDNA,证实该基因的产物为CPS,并用35S标记将该酶定位于叶绿体。Yamaguchi等[6]利用拟南芥矮化突变体及已克隆的南瓜cDNA做同源探针,克隆了该基因并通过放射性标记酶底物证实了其功能。Fleet等[8]对拟南芥和分别和同时进行过表达分析,并检测了基因直接产物CPS、KS及植株中的GA含量,发现虽然CPS和KS的含量大大升高,但拟南芥植株表型和GA含量均没有明显变化,从而推测GA合成的限速步骤在后续的催化反应。
Ishida等[9]利用来自拟南芥的兼并引物和RT-PCR获得了普通烟草和等基因的部分序列。作为重要的模式植物和经济作物,目前烟草和基因尚未被克隆,其在烟草生长发育中的作用也有待探讨。本研究分离了烟草和基因,分析了其进化关系和表达特性,为研究其在烟草生长发育中的功能奠定了基础。
1 材料与方法
1.1 植物材料
供试材料为普通烟草品种K326和野生二倍体林烟草、绒毛状烟草,2012年播种于温室,自然条件下培养至生殖生长期。分别采集营养生长期的根、茎、叶和生殖生长期的花芽、花。
1.2 基因克隆
使用GeneJET Plant RNA Purification Mini Kit(Thermo)提取各组织总RNA。采用PrimeScriptTMRT-PCR Kit(Takara)反转录第一链cDNA,作为PCR扩增的模板。检索本氏烟草基因组(http://solgenomics.net/organism/Nicotiana_benthamiana/genome)预测的cDNA数据库,得到本氏烟草和基因全长CDS,并据其进行相关基因的引物设计(表1),用于扩增二倍体烟草和普通烟草和基因的中间片段。PCR扩增条件参照文献[10]。将PCR产物检测回收,连接pmd18-T载体后转化大肠杆菌感受态DH5ɑ。筛选阳性克隆,并送华大基因公司测序。
采用SMARTTMRACE cDNA Amplification Kit(Clontech)分别进行3’和5’ RACE反应。所用基因特异引物GSP和巢式引物NGSP根据测序中间片段序列设计(表1),反应条件参照文献[10]。将RACE产物测序和拼接得到全长cDNA序列。
1.3 多序列比对、系统进化和亚细胞定位分析
采用DNAMAN软件将得到的烟草和基因与番茄等进行多序列比对分析;利用MEGA 5.0[11]构建NJ进化树。采用在线程序TargetP[12]对烟草和进行亚细胞定位预测。

表1 绒毛状烟草基因克隆和表达分析的引物及其序列
1.4 荧光定量表达分析
分别提取K326和林烟草不同生长时期各组织的总RNA,去除基因组DNA污染后,稀释到100 ng/μL。按照试剂盒说明,利用PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time, Takara)将总RNA反转录为cDNA,稀释5倍后利用SYBR®Premix Ex TaqTMII(Tli RNaseH Plus, Takara)在荧光定量PCR仪ABI 7500上进行qRT-PCR分析。所用基因特异引物见表1,以烟草核糖体蛋白基因作为内参[10,13]。
2 结 果
2.1 烟草ga1和ga2基因的分离
利用本氏烟草来源的引物,在普通烟草、绒毛状烟草和林烟草中都得到了约1300 bp的中间片段,并且利用RACE技术分别获得了和基因在3个烟草种中的全长CDS序列。图1显示在绒毛状烟草中获得的RACE结果。
基因5’ RACE获得了约650 bp的条带;巢式扩增得到一条508 bp的序列;3’ RACE扩增得到了1103 bp的序列。根据序列重叠并去除RACE反应加入的接头序列后,得到了绒毛状烟草包括UTR全长2836 bp的序列,其中5’ UTR和3’ UTR分别长178 bp和168 bp,编码区长2490 bp,编码829个氨基酸的蛋白质。同样的方法得到了绒毛状烟草包括UTR全长2852 bp的序列,其中5’ UTR和3’ UTR分别长208 bp和343 bp,编码区长2301 bp,编码769个氨基酸的蛋白质。将本氏烟草中预测的基因命名为/,本实验克隆的普通烟草、绒毛状烟草和林烟草的6条序列分别命名为/、/和/(表2)。
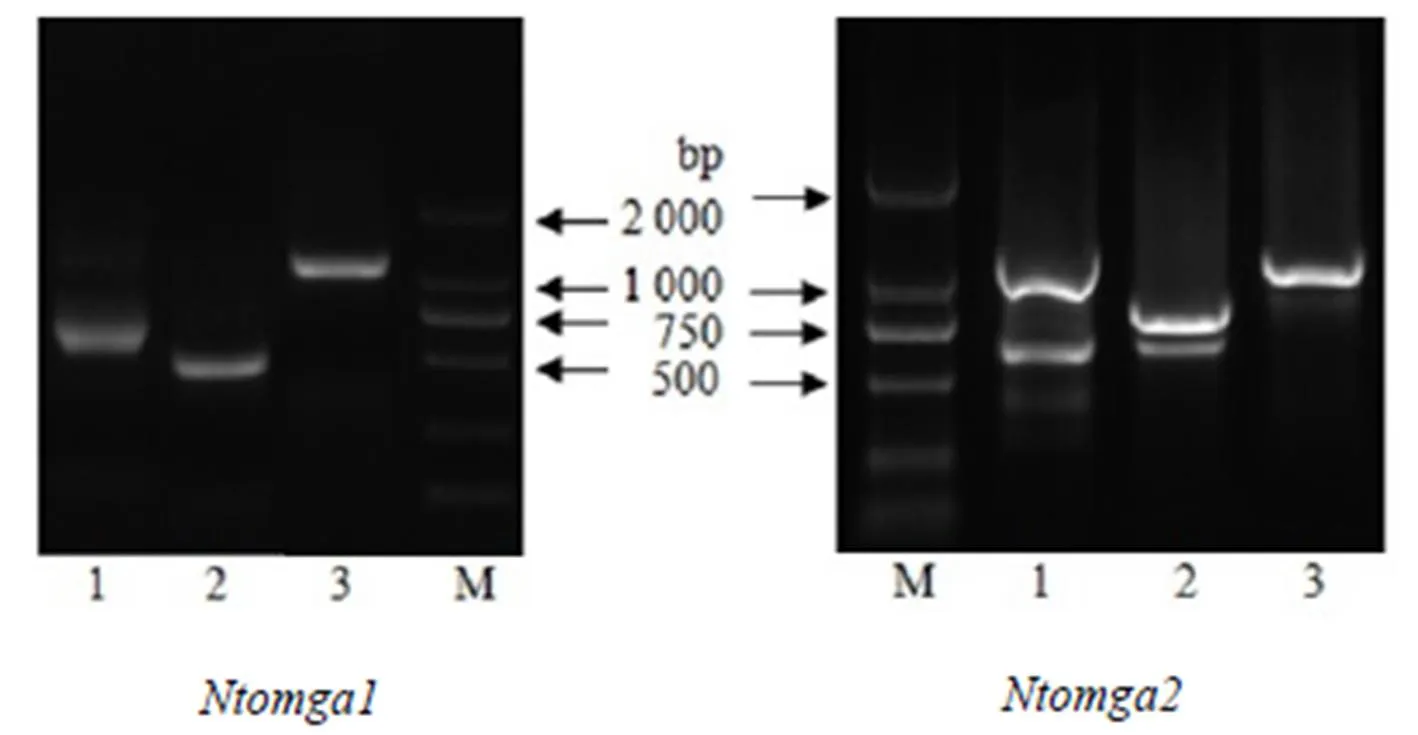
图1 绒毛状烟草ga1和ga2基因RACE扩增结果
注:M为DL2000分子量标准;1为5’ RACE扩增结果;2为5’ RACE巢式扩增结果;3为3’ RACE扩增结果。
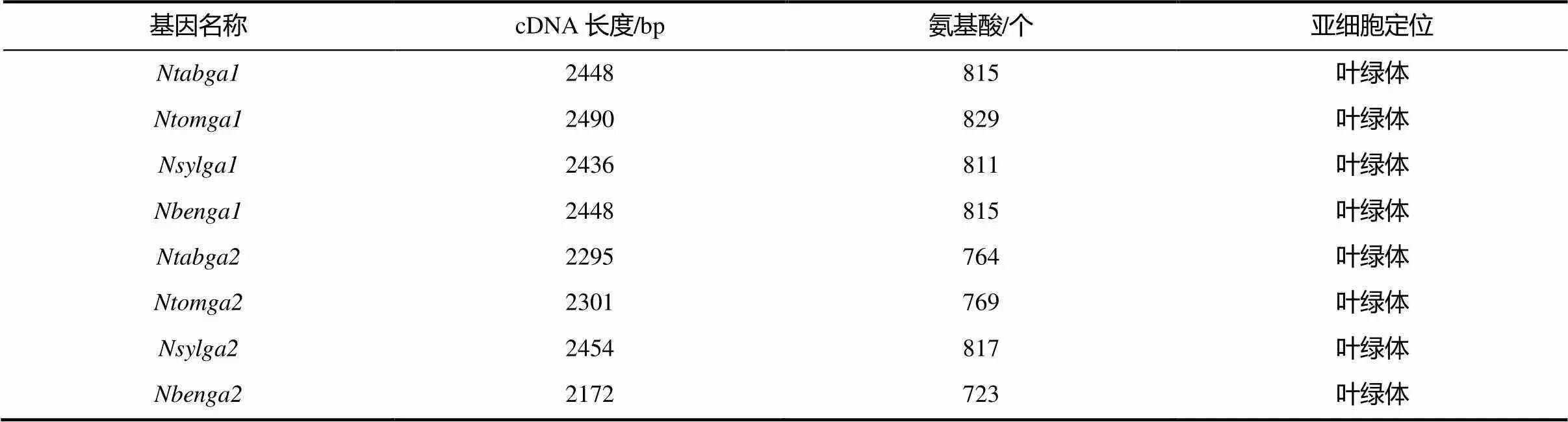
表2 烟草ga1和ga2基因的序列信息
2.2 多序列比对和亚细胞定位分析
将得到的烟草属序列与番茄相应基因编码的蛋白序列进行了多序列比对(图2)。较茄科作物番茄,ga1和ga2在烟草属不同种之间保守性很高。在线程序TargetP预测结果表明,烟草ga1和ga2均具有叶绿体定位序列,成熟蛋白定位于叶绿体,参与赤霉素在叶绿体中的合成反应(表2)。
2.3 系统进化分析
Lee等[14]认为普通烟草起源于野生二倍体绒毛状烟草和林烟草,其天然杂交F1经染色体自然加倍成为四倍体烟草。进化树分析显示(图3),普通四倍体烟草和与绒毛状烟草亲缘关系最近,而与林烟草相对较远。其他植物,如番茄、拟南芥、水稻等中均存在其直系同源基因。

注:相同的氨基酸以黑色表示;相似的氨基酸以灰色表示。

图3 烟草、番茄、拟南芥和水稻ga1和ga2的进化分析
2.4 荧光定量表达分析
荧光定量表达分析表明(图4),和在K326和林烟草被检测的组织中均有表达,但表达量在不同组织存在明显差异。二者在林烟草茎伸长前期的叶片中表达量最高;而在茎伸长期时在茎中的表达量显著高于根和叶;在生殖生长期的花芽中的表达量略高于花。在K326中,在营养生长期的茎表达量最高,而在根中表达量最高。
3 讨 论
在叶绿体中,ga1和ga2催化的合成反应是赤霉素代谢的必经途径,其发生突变最直接的表型是植株矮化[5-6]。这种作用在以农作物如小麦、水稻等矮化育种为主导的第二次绿色革命中起到了重要作用[1,15-19]。烟草作为重要的模式植物,其相关基因的研究鲜有报道。本研究利用同源克隆和RACE技术,获得了烟草属3个种和基因类似物的全长CDS序列,包括普通烟草及其可能的起源种绒毛状烟草和林烟草。序列比对发现,本研究获得的烟草和类似物的序列与Ishida等[9]获得的普通烟草和的部分序列基本一致,说明本研究获得了几种烟草的相关基因序列。
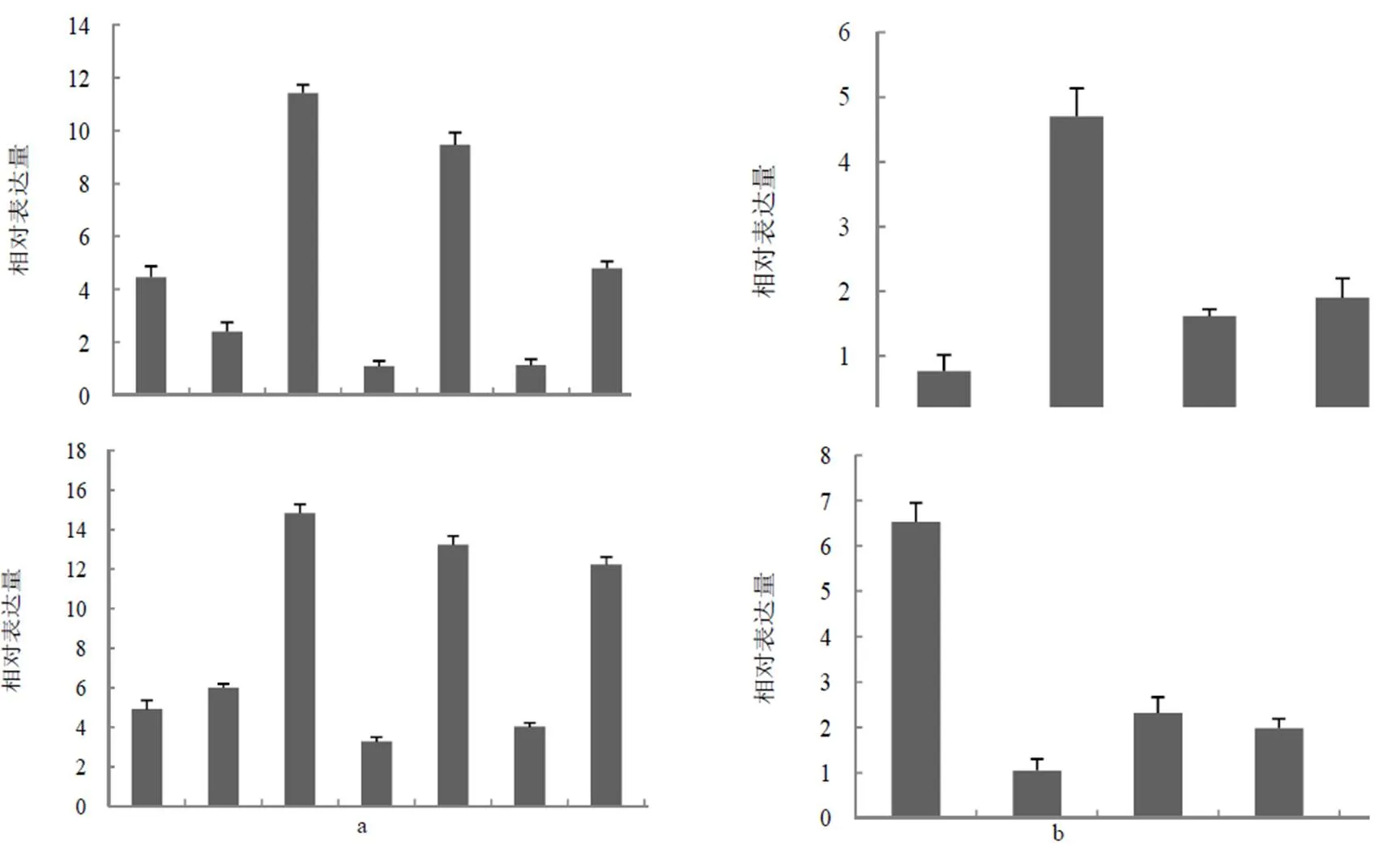
图4 烟草ga1和ga2在林烟草和普通烟草K326中的荧光定量表达分析
注:a和b分别为(上)和(下)在林烟草和普通烟草K326中的相对表达量。a(1~8)分别为林烟草茎伸长前期的根(1)、茎(2)、叶(3);茎伸长期的根(4)、茎(5)、叶(6);生殖生长期的花芽(7)、花(8)。b(1~5)分别为普通烟草K326营养生长期的根(1)、茎(2)、叶(3);生殖生长期的花芽(4)、花(5)。
通过构建系统进化树,可以分析分子间的起源关系。通常认为,普通烟草由野生二倍体绒毛状烟草和林烟草的天然杂交F1经染色体加倍形成[14,20]。由此,可以推测普通烟草较野生二倍体烟草存在和基因的二份拷贝,一个起源于绒毛状烟草,一个起源于林烟草。Prisic等[21]研究证实,水稻中存在两个CPS编码基因,但其功能已经发生了分化,一个参与赤霉素合成,另一个则参与次级代谢,生成具有防御功能的化学物质。本实验中,在普通烟草K326中克隆了两个基因的各一个拷贝,且其与绒毛状烟草中相应基因的亲缘关系最近。作者推测,普通烟草中可能还存在起源于林烟草的基因拷贝或者同源物,这份冗余的拷贝是否在进化中丢失了功能或者行使不同于赤霉素合成的功能,有待于进一步鉴定。
林烟草较普通烟草和绒毛状烟草在植株生长发育中存在较大差异。林烟草在生长发育早期呈“匍匐状”,即茎不伸长,到营养生长后期和生殖生长前期,其茎开始生长;而普通烟草和绒毛状烟草的生长发育一直伴随着茎的伸长。推测可能与GA代谢相关。因此,本研究对林烟草和普通烟草和基因进行了不同发育时期的荧光定量表达分析。结果表明,在林烟草生长发育早期其主要在叶片中表达,在茎伸长期茎中的表达量则显著高于根和叶片。已知GA的一个生理效应是能加速细胞伸长,从而促进植物的营养生长,尤其能显著促进茎和叶的生长。林烟草生长发育早期茎不伸长,主要是叶片的生长;到营养生长后期和生殖生长前期则主要是茎的伸长。这与GA代谢基因在林烟草不同发育阶段不同组织器官中的表达量基本一致。
进一步研究可以继续筛选普通烟草中起源于林烟草和基因的直系同源序列,分析序列和功能其是否已发生变化;结合RNAi、过表达和原核表达等技术研究其在烟草中的功能。
4 结 论
本研究利用RACE技术从3个烟草种中克隆了GA合成相关基因和,均被预测定位于叶绿体;序列比对发现烟草属中相关基因高度保守;进化树分析显示,普通烟草中克隆的和可能来源于绒毛状烟草;表达分析表明,相关基因的表达与林烟草的生长发育状态基本一致。
[1] Silverstone A L, Sun T P. Gibberellins and the green revolution[J]. Trends in plant science, 2000(5): 1-2.
[2] MacMillan J. Occurrence of gibberellins in vascular plants, fungi, and bacteria[J]. Plant Growth Regul, 2002, 20: 387-442.
[3] Yamaguchi S. Gibberellin metablism and its regulation[J]. Annu. Rev. Plant Biol, 2008, 59: 225-251.
[4] Sun T P, Goodman H M, Ausubel F M. Cloning the arabidopsis GA1 locus by genomic subtraction[J]. The Plant Cell, 1992(4): 119-128.
[5] Sun T P, Kamiya Y. The arabidopsis GA1 locus encodes the entcopalyl pyrophosphate synthase of gibberellin biosynthesis[J]. The Plant Cell, 1994(6): 1509-1518.
[6] Yamaguchi S, Sun T P, Kawaide H, et al. The GA2 Locus of arabidopsis thaliana encodes ent-kaurene synthase of gibberellin biosynthesis[J]. Plant physiol, 1998, 116: 1271-1278
[7] Helliwell C H, Sulivan J A, Mould R M, et al. A plasmid envelope location of arabidopsis ent-Kaurene oxidase links the plastid and endoplasmic reticulum steps of the gibberellin biosynthesis pathway[J]. The Plant Journal, 2001(28): 201-208.
[8] Fleet C M, Yamaguchi S, Hanada A, et al. Overexpression of AtCPS and AtKS in Arabidopsis confers increased ent-Kaurene production but no increase in bioactive gibberellins[J]. Plant Physiology, 2004, 132: 830-839.
[9] Ishida S, Fufazawa J, Yuasa T, et al. Involvement of 14-3-3 signaling protein binding in the functional regulation of the transcriptional activator repression of shoot growth by gibberellins[J]. The Plant Cell, 2004(16): 2641-2651.
[10] 太帅帅,刘贯山,孙玉合,等. 普通烟草CDPK 基因家族的克隆及表达分析[J]. 中国农业科学,2009,42(10):3600-3608.
[11] Tamura K, Peterson D, Peterson N, et al. MEGA5, molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2010, 28: 2731-2739.
[12] Emanuelsson O, Nielsen H, Brunak S, et al. Predicting subcecullar localization of proteins based on their N-terminal amino acid sequence[J]. J Mol Biol, 2000, 300: 1005-1016.
[13] Schmidt G W, Delaney S K. Stable internal reference genes for normalization of real-time RT-PCR in tobacco () during development and abiotic stress[J]. Mol Genet Genomics, 2010, 183: 233-241.
[14] Lee K Y, Townsend J, Tepperman J, et al. The molecular basis of sulfonylurea herbicide resistance in tobacco [J]. The EMBO Journal, 1988(7): 1241-1248.
[15] Rebetzke G J, Richards R A. Gibberellic acid-sensitive dwarfing genes reduce plant height to increase kernel number and grain yield of wheat[J]. Aust J Agric Res, 2000, 51: 235-245.
[16] 傅大雄,阮仁武,刘大军,等. 近等基因系法对小麦显性矮源的研究[J]. 中国农业科学,2007,40(4):655-664.
[17] 杨松杰,张晓科,何中虎,等. 用STS标记检测矮秆基因和在中国小麦中的分布[J]. 中国农业科学,2006,39(8):1680-1688.
[18] Khush D, Gurdev S. Breaking the yield frontier of rice[J]. Geo Journal, 1995, 35 : 329-332.
[19] 刘传光,张桂权,周汉钦,等. 华南地区常规籼稻品种产量和株型性状的遗传改良[J]. 中国农业科学,2010,43(19):3901-3911.
[20] 王元英. 烟草基因组知识篇:1. 基因组与烟草基因组计划[J]. 中国烟草科学,2010,31(1):81-82.
[21] Prisic S, Xu M M, Wilderman P R, et al. Rice contains two disparate ent-copalyl diphosphate synthases with distinct metabolic functions[J]. Plant Physiology, 2004, 136: 4228-4236.
Cloning and Expression Analysis ofandin Tobacco
DING Anming1,2, CHEN Yaqiong1,2, Zahid Hussain1,2, KANG Le1,2, ZHANG Yunrui1,2, CUI Mengmeng1, WANG Qian1, SUN Yuhe1*
(1. Key laboratory for tobacco gene resources, Tobacco Research Institute of CAAS, Qingdao 266100, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Two GA metabolism related genesandwere cloned by using homology-based method and RACE from three tobacco species to explore the role in which gibberellic acids (GA) play in tobacco growth and development. Based on sequence alignment, a phylogenetic tree was constructed. qRT-PCR was executed to detect the gene expression profiles inand. The results showed that they were highly conserved in sequences inplants and genes inmight originate from. qRT-PCR analysis showed thatandwere expressed in much higher levels in leaves of stage before stem elongation and in stem of the stem elongation stage than other tissues in.
tobacco; gibberellic acid; qRT-PCR
TS413
1007-5119(2014)01-0102-06
10.13496/j.issn.1007-5119.2014.01.019
丁安明,男,博士研究生,主要从事烟草功能基因组学研究。E-mail:anmingdsdau@163.com。
通信作者,E-mail:yhsun@163.com
2013-06-06
2013-11-14
