三种增温情景对入侵植物空心莲子草形态可塑性的影响
2014-05-14褚延梅李景吉彭培好
褚延梅,杨 健,李景吉,彭培好
(成都理工大学,生态资源与景观研究所,成都 610059)
自然环境的异质性是普遍存在的,这种异质生境可能是由单一环境因子影响,如光照强度、土壤养分、土壤水分、土壤有机质等,也可能由多因素相互作用产生[1-3]。而克隆植物因其具有克隆整合、克隆可塑和无性繁殖等克隆生活史性状而被认为对异质性生境具独特的适应能力[4-6]。表型可塑性是广布性物种适应变化、异质性生境的主要策略之一,对于那些遗传多样性较低同时又占据多样化生境的入侵种,表型可塑性可能在其成功入侵的过程中起关键作用[7]。
空心莲子草(Alternanthera philoxeroides)属苋科、莲子属两栖多年生克隆型草本杂草又称喜旱莲子草、水花生、革命草,原产于南美洲,具有非常强的入侵能力,目前已在世界32个国家分布是中国亚热带及温带地区一种严重的外来多年生杂草[8]。由于其广泛的适生性(水陆两栖均可生长)及繁殖迅速,蔓延速度快,已传播到华东、华中、华南和西南等地区,北至吉林,南至广东的20多个省、市、自治区都能找到空心莲子草的足迹,成为我国难以防除的恶性杂草之一[9-10]。空心莲子草具有很强的可塑性,如空心莲子草随着光照强度的降低,分枝强度、基株株长、茎节长度随之下降[11];随氮含量升高,分枝强度、茎节长度均有不同程度的增加[12];随土壤含水量减少,空心莲子草根冠比显著升高,分枝强度显著降低[13]。形态可塑性是同一基因型由于环境条件的改变在形态上做出相应变化的能力,是生物适应环境的一种方式,即形态可塑性是环境对基因型表达的一种修饰[14-15]。上述研究表明形态可塑性调节对空心莲子草的生存和生长具有重要的生态学意义[16],而这种高的形态可塑性被认为植物在新生境中成功入侵和拓殖的一个重要特征[17]。
温度是植物生长、发育的重要条件,任何生物的生活过程都离不开有效积温,其生长都受到温度变化的影响[18-19]。根据气候模型预测,到21世纪末全球地表平均温度还将上升1.6—6.4℃,且在高纬度或高海拔地区的增幅更明显[20]。全球变暖会通过影响植物的生理生态特性,进而对植物的种群、群落、生态系统乃至整个生物圈产生巨大影响[21]。同时研究结果表明全球变暖存在明显的昼夜不同步性,即夜间增温幅度大于白天,这种昼夜增温幅度的不均匀性可能影响植物光合作用和呼吸作用,并进一步影响植物的生长与碳积累[22-23]。全球变暖和生物入侵是影响21世纪生态系统结构和功能的两大因素,然而全球变暖将如何影响生物入侵尚无定论,对于增温如何影响空心莲子草的可塑性从而影响其适合度及入侵性的报道亦知之甚少。
本文以空心莲子草为材料,通过设置不同增温情景和连接/切断处理,比较空心莲子草匍匐茎总长、分株数、平均分株长等参数的变化,探讨两个基本科学问题:1)增温对不同处理方式的空心莲子草形态可塑性有何影响?2)空心莲子草的形态可塑性对昼夜不同增温的响应是否存在差异?
1 材料和方法
1.1 试验地点
试验地点位于成都理工大学(30°40'41″N,104°08'15″E),海拔512 m,属亚热带湿润季风气候区,气候温和、湿润、无霜期长、雨量充沛、日照较少,年平均气温16.2℃,平均降水量918.2 mm。
1.2 试验材料
试验所用空心莲子草均采自成都理工大学校园东风渠附近。考虑到空心莲子草在中国的遗传多样性非常低,而且取自同一种群,故可认为所采空心莲子草属于同一基因型[24-25]。
1.3 试验设计
从田地水沟边(成都理工大学,东风渠附近)野生状态的空心莲子草中,剪下大小近似且具有四节完整节间匍匐茎片段移栽到培养皿中恢复生长1周。培养皿为大小相等的塑料盆(口径18 cm),试验培养土为该空心莲子草种群入侵地的自然土壤。试验时间为2011年3—5月。空心莲子草恢复生长1周后,选择每个节上有不定根且生长一致的个体作为实验材料。将选取的克隆片段做切断(将枝条从中间位置切断,每边留等长或近等长的两个节)与连接两种处理,然后分组进行增温试验。
本实验共设置了4组不同温度处理,其中3组增温处理分别为白天增温、夜间增温、全天增温,另一组为对照组。在增温组中,采用红外辐射加热器(Kalglo Electronics,Bethlehem,PA,USA)进行模拟增温,加热器悬挂于增温样方的上方,距地面1.5 m(保证增温达到2℃)。本实验共设置8种组合,每种组合重复3次,随机分配。8种组合分别为:茎切断白天增温,茎连接白天增温,茎切断夜间增温,茎连接夜间增温,茎切断全天增温,茎连接全天增温,茎切断不增温,茎连接不增温。3月底同时进行白天(7:00—19:00)12 h的连续增温、夜间(19:00—7:00)12 h的连续增温、全天24 h连续增温。在对照组上方距地面1.5 m处悬挂与红外线辐射加热器同等大小的虚拟加热器,以模拟加热器的遮阴影响。为避免相互影响,每个处理组间隔2 m。
1.4 观测指标及方法
增温和切断处理开始于3月底。增温1周后,每周分别调查匍匐茎总长、分株数、平均分株长。这里的匍匐茎指的是所有匍匐在地的茎,包括一级、二级和三级匍匐茎;分株,指的是从最初的4个节间生发出来的分株;平均分株长等于匍匐茎总长除以分株数的平均值。
1.5 统计分析方法
所有数据均采用SPSS 19.0统计软件进行分析,用双因素方差分析比较匍匐茎连接或切断和不同增温处理对各指标的影响,用单因素方差分析(Oneway ANOVA)比较同一指标不同处理之间的差异显著性。所有图形均采用Sigma Plot 12.0软件绘制。
2 结果
2.1 不同增温处理下对空心莲子草匍匐茎长度的影响
由表1可知,匍匐茎连接方式对整个克隆片段的匍匐茎总长、平均分株长有显著影响,增温对整个克隆片段的匍匐茎总长和平均分株长的影响不显著。连接方式与增温对分株数的影响均不显著。增温和连接方式间无交互作用。
由图1可知,匍匐茎切断处理在一定程度上不利于匍匐茎的生长,与连接处理相比,切断处理的匍匐茎总长在3种增温处理下均有不同程度的降低,这种差异在夜间增温处理下达到显著水平(F=0.015,P=0.022),夜间处理下切断处理的匍匐茎总长降低了44.0%。与对照组相比,3种增温方式对切断处理的匍匐茎总长几乎没有影响,但是夜间增温显著促进了连接处理的匍匐茎的生长(F=0.002,P=0.021),相对与对照(7.6%),夜间增温连接处理的匍匐茎总长增高了40.5%。由此可见,夜间增温促进了茎连接的空心莲子草匍匐茎的生长。
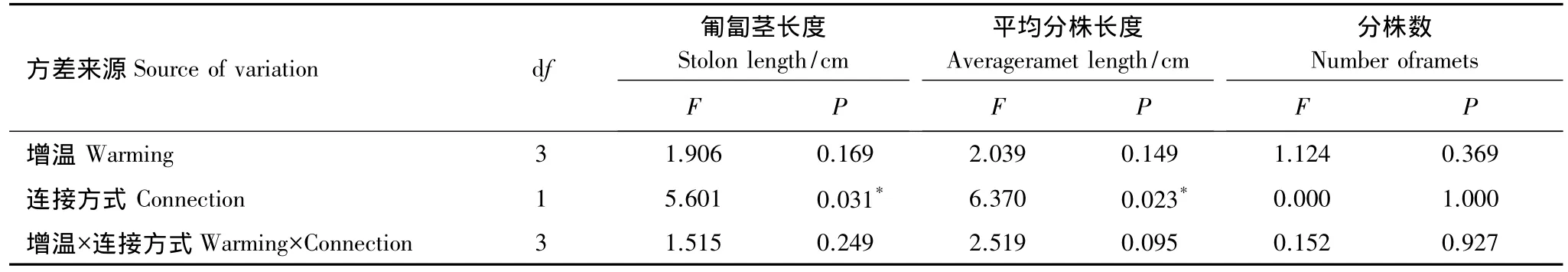
表1 匍匐茎连接、增温和二者交互效应对空心莲子草匍匐茎总长、平均分株长度以及分株数的影响Table 1 Effects of connection,experimental warming and their interactions on the total stolon length per ramet and the number of ramets of Alternanthera philoxeroides
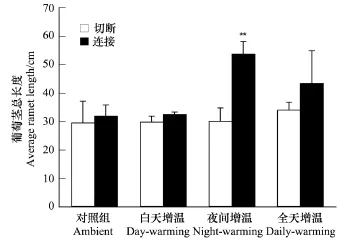
图1 匍匐茎切断或连接的空心莲子草在4种增温方式下的匍匐茎总长度(均值+标准误)Fig.1 The totalstolon length of Alternanthera philoxeroides grown under four air temperature regimes with either connected or severed stolons(mean+SE)
2.2 不同增温处理下对空心莲子草分株数及长度的影响
由图2可知,与连接处理相比,切断处理的空心莲子草平均分株长在3种温处理下均有不同程度的下降,这种差异在夜间增温处理下极为显著(F=5.445,P<0.001),切断处理的平均分株长降低了48.0%。与对照组相比,夜间增温显著促进了匍匐茎连接处理分株的生长(F=7.712,P=0.020),相对于对照(9.1%),夜间增温连接处理的平均分株长增高了28.6%。
由图3可知,与对照组相比,不论是连接处理还是切断处理的空心莲子草分株数在3种温处理下均有不同程度的增加,但都未达到显著水平。在4种温度处理下,切断组与连接组分株数的差异均不显著(P>0.05)。
3 讨论
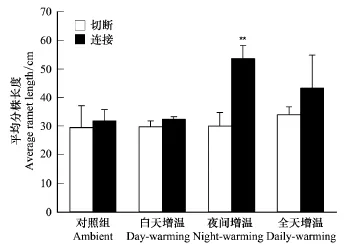
图2 匍匐茎切断或连接的空心莲子草在4种增温方式下的平均分株长度(均值+标准误)Fig.2 The averageramet length of Alternanthera philoxeroides grown under four air temperature regimes with either connected or severed stolons(mean+SE)
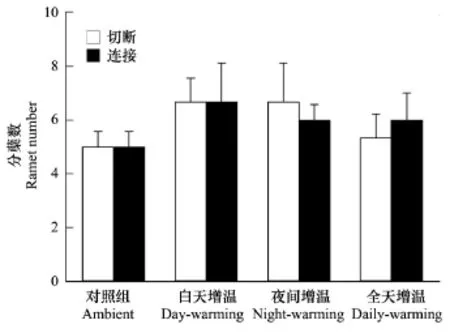
图3 匍匐茎切断或连接的空心莲子草在4种增温方式下的分株数(均值+标准误)Fig.3 The number oframets of Alternanthera philoxeroides grown under four air temperature regimes with either connected or severed stolons(mean+SE)
温度是影响植物生长和发育的最重要生态因子之一,分析物种在不同温度条件下的形态、结构方面的可塑性差异,可以更好的了解该物种对不同温度环境的适应机制。虽然全球增温方式具有不确定性,但是气候变暖对植物影响的经验认识是迫切需要的,因此设置了3种不同的增温情景(即白天、夜间和全天增温)。
匍匐茎的长短、平均分株长短和分株数量是衡量空心莲子草生理及形态特征的重要指标[11-12]。本实验中,只有夜间增温下,连接组的匍匐茎总长及平均分株长显著增加,白天增温和全天增温对空心莲子草的匍匐茎总长、分株长、分株数均无显著影响。Wang等研究表明无论是在何种水淹条件下,空心莲子草切断与连接处理对基株的匍匐茎总长度、分株数无显著影响[26];土壤增温2℃对其匍匐茎长度等形态指标的影响不显著[27]。本实验中,除了夜间增温处理外,克隆整合作用亦并未显著影响上述形态指标,这与他们的结果是一致的。Nijs等对增温对入侵物种影响的研究亦表明全天增温对入侵种的影响不显著[28],本实验结果同他们是一致的。
白天增温和全天增温对空心莲子草形态特征的影响均不显著,只有在夜间增温处理下这种影响才达到显著水平,表明不同增温方式对植物的生长具有不同的生态学适应意义。白天、夜间和全天增温会产生不同的叶表面温度,并影响光合作用源库关系[29],使空心莲子克隆片段有截然不同的光合补偿潜力,从而影响空心莲子草的生长。白天增温可能会促进空心莲子草的呼吸作用,抵消增温对其光合作用的正效应,甚至产生抑制作用[30]。全天增温比白天和夜间增温具有更高的温度,可能会产生更强烈的高温胁迫和干旱,但全天增温对空心莲子草的生长几乎没有影响,表明全天增温下空心莲子草对环境胁迫具有更强的耐受性[28]。通过增加对根系生物量的分配来缓解温度胁迫是植物常用策略之一[31];但同时温度升高可能会导致表土层的干旱,阻碍根系的生长,加剧根系间的竞争[32]。匍匐茎连接可显著降低海滩草莓以及三叶草分株之间的根系竞争,即克隆整合会显著影响根系的产生,提高其适合度[33-34]。这可能是夜间增温处理下,连接组的匍匐茎总长与平均分株长度要远远大于切断组的原因之一。根据库-源假说,植物在前一天晚上通过呼吸作用消耗碳水化合物可以促进其第2天光合作用[35-36],从而积累更多的光合产物,即夜间增温可能会激发光合补偿作用。这可能是导致夜间增温条件下空心莲子草连接组和对照组差异显著的另一个原因。
空心莲子草高度适应陆地和水域这两种异质性的生境,其形态和繁殖特征具有较大差异[37]。陶勇等对空心莲子草对水分变化的形态适应研究发现,水分条件的变化对旱生型、漂浮型和挺水型空心莲子草的各形态参数都有极显著影响,且在不同水分条件下叶、茎、根的生长优先顺序不同[38];wang等揭示了克隆整合作用可能使得空心莲子草具有在水生生境和陆生生境扩展的双重策略[26];刘健研究指出这种植物具有很强的适应匍匐茎断裂的机制[39]。这些研究都表明,形态可塑性和克隆整合在空心莲子草的入侵过程中起着重要的作用。增温可能通过改变生境的水分条件从而对其形态产生影响,例如夜间增温有助于空心莲子草匍匐茎和分株的伸长,从而快速扩展并占据有利生境,促进其入侵。
研究结果表明,空心莲子草的匍匐茎总长、分株长与分株数对不同增温的形态可塑性响应模式在匍匐茎处理间存在一定的差异,即空心莲子草对不同的增温情景的响应取决于匍匐茎连接处理的存在;空心莲子草表现出对增温环境的可塑性变化,这种形态的可塑性变化依赖增温情景;夜间增温可能促进空心莲子草的入侵。
[1]He W M,Dong M.Growth and physiological features of Salix matsudana on the Mu Us Sandland in response to shading.Chinese Journal of Applied Ecology,2003,14(2):175-178.
[2]Wang M L,Feng Y L.Effects of soil nitrogen levels on morphology,biomass allocation and photosynthesis in Ageratina adenophora and Chromoleana odorata.Acta Phytoecologica Sinica,2005,29(5):697-705.
[3]Xu Z Z,Zhou G S.Combined effects of water stress and high temperature on photosynthesis,nitrogen metabolism and lipid peroxidation of a perennial grass Leymus chinensis.Planta,2006,224(5):1080-1090.
[4]Dong M.Clonalgrowth in plantsin relation to resource heterogeneity:foraging behavior.Acta Botanica Sinica,1996,38(10):828-835.
[5]Li D Z,Takahashi S.Particularities of clonal plant species induced by physiological integration.Grassland Science,2003,49(4):395-402.
[6]Dong M.Plant clonal growth in heterogeneous habitats:riskspreading.Acta Phytoecologica Sinica,1996,20(6):543-548.
[7]Geng Y P,Zhang W J,Li B,Chen J K.Phenotypic plasticity and invasiveness of alien plants.Biodiversity Science,2004,12(4):447-455.
[8]Garhari F,Pedulla M L.Alternanthera philoxeroides(Mart.)Griseb.(Amaranthaceae),a new species for the exotic flora of Italy.Webbia:Journal of Plant Taxonomy and Geography,2001,56(1):139-143.
[9]Lin J C,Qiang S.Influence of Alternanthera philoxeroides on the species composition and diversity of weed community in spring in Nangjing.Journal of Plant Ecology,2006,30(4):585-592.
[10]Lin G L,Yang Y Z,Hu J S.Studies on biology and control of Atlernanthera philoxeroiders.Jiangsu Agricultural Research,1990,11(2):57-63.
[11]Xu K Y,Ye W H,Li G M,Li J.Phenotypic plasticity in response to light intensity in the invasive species Alternanthera philoxeroides.Journal of Wuhan Botanical Research,2005,23(6):560-563.
[12]Xu K Y,Ye W H,Li J,Li G M.Phenotypic plasticity in response to soil nutrients in the invasive species Alternanthera philoxeroides.Ecology and Environment,2005,14(5):723-726.
[13]Claridge K,Franklin S B.Compensation and Plasticity in an Invasive Plant Species.Biological Invasions, 2002, 4(4):339-347.
[14]De Kroon H,Huber H,Stuefer J F,Van Groenendael J M.A modularconcept ofphenotypic plasticity in plants. New Phytologist,2005,166(1):73-82.
[15]Bergamini A,Peintinger M.Effects of light and nitrogen on morphological plasticity of the moss Calliergonella cuspidata.Oikos,2002,96(2):355-363.
[16]Lu X M,Zhou C F,An S Q,Fang C,Zhao H,Yang Q,Yan C.Phenotypic plasticity,allometry and invasivenessofplants.Chinese Journal of Ecology,2007,26(9):1438-1444.
[17]Sultan S E.Phenotypic plasticity and plant adaptation.Acta Botanica Neerlandica,1995,44(4):363-383.
[18]Rustad L E,Campbell J L,Marion G M,Norby R J,Mitchell M J,Hartley A E,Cornelissen J H C,Gurevitch J,Gcte-News.A meta-analysis of the response of soil respiration,net nitrogen mineralization,and aboveground plant growth to experimental ecosystem warming.Oecologia,2001,126(4):543-562.
[19]Jonasson S,Michelsen A,Schmidt I K,Nielsen E V.Responses in microbes and plants to changed temperature,nutrient,and light regimes in the Arctic.Ecology,1999,80(6):1828-1843.
[20]IPCC.Climate change 2007:the physical science basis//Solomon S,Qin D,Manning M,Chen Z,Marquis M,Averyt K B,Tignor M,Miller H L,eds.Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge:Cambridge University Press,2007.
[21]Usami T,Lee J,Oikawa T.Interactive effects of increased temperature and CO2on the growth of Quercus myrsinaefolia saplings.Plant, CellandEnvironment, 2001, 24(10):1007-1019.
[22]Harvey L D D.Warm days,hot nights.Nature,1995,377(6544):15-16.
[23]Easterling D R,Horton B,Jones P D,Peterson T C,Karl T R,Parker D E,Salinger M J,Razuvayev V,Plummer N,Jamason P,Folland C K.Maximum and minimum temperature trends for the globe.Science,1997,277(5324):364-367.
[24]Xu C Y,Zhang W J,Fu C Z,Lu B U.Genetic diversity of alligator weed in China by RAPD analysis.Biodiversity and Conservation,2003,12(4):637-645.
[25]Wang B R,Li W G,Wang J B.Genetic diversity of Alternanthera philoxeroides in China.Aquatic Botany,2005,81(3):277-283.
[26]Wang N,Yu F H,Li P X,He W M,Liu J,Yu G L,Song Y B,Dong M.Clonal integration supports the expansion from terrestrial to aquatic environments of the amphibious stoloniferous herb Alternanthera philoxeroides.PlantBiology, 2009, 11(3):483-489.
[27]Jang L Z,Wang D,Liu S N,Pan R,Shen F,Zhou J.Effect of light and nitrogen on morphological traits and biomass allocation of an invasive weed Alternanthera philoxeroides(mart.)griseb.Acta Hydrobiologica Sinica,2010,34(1):101-107.
[28]Verlinden M,Nijs I.Alien plant species favoured over congeneric natives under experimental climate warming in temperate Belgian climate.Biological Invasions,2010,12(8):2777-2787.
[29]McCormick A J,Cramer M D,Watt D A.Sink strength regulates photosynthesis in sugarcane.New Phytologist,2006,171(4):759-770.
[30]Will R.Effect of different daytime and night-time temperature regimes on the foliar respiration of Pinus taeda:predicting the effectof variable temperature on acclimation. Journal of Experimental Botany,2000,51(351):1733-1739.
[31]Dubrovsky JG, North G B, NobelP S.Rootgrowth,developmental changes in the apex,and hydraulic conductivity for Optuntia ficus-indica during drought.New Phytologist,1998,138(1):75-82.
[32]Edward E J,Benham D G,Marland L A,Fitter A H.Root production is determined by radiation flux in a temperate grassland community.Global Change Biology,2004,10(2):209-227.
[33]Holzapfe C,Alpert P.Root cooperation in a clonal plant:Connected strawberries segregate roots.Oecologia,2003,134(1):72-77.
[34]Falik O,de Kroon H,Novoplansky A.Physiologically-mediated self/non-self root discrimination in Trifolium repens has mixed effects on plant performance.Plant Signaling and Behavior,2006,1(3):116-121.
[35]Turnbull M H,Murthy R,Griffin K L.The relative impacts of daytime and night-time warming on photosynthetic capacity in Populus deltoides.Plant,Cell and Environment,2002,25(12):1729-1737.
[36]Paul M J,Foyer C H.Sink regulation of photosynthesis.Journal of Experimental Botany,2001,52(360):1383-1400.
[37]Weng B Q,Lin S,Wang Y X.Discussion on adaptability and invasion mechanisms of Alternanthera philoxeroides in China.Acta Ecologica Sinica,2006,26(7):2373-2381.
[38]Tao Y,Chen S F,Jang M X.Morphological adaptation of Alternanthera philoxeroides(mart.)griseb to the change of water.Resources and Environment in the Yangtze Basin,2004,13(5):454-459.
[39]Liu J.The Distribution Pattern and Characteristics of the Invasive Plant Species in China[D].Ji'nan:Shandong University,2005:112-112.
参考文献:
[1]何维明,董鸣.毛乌素沙地旱柳生长和生理特征对遮荫的反应.应用生态学报,2003,14(2):175-178.
[2]王满莲,冯玉龙.紫茎泽兰和飞机草的形态、生物量分配和光合特性对氮营养的响应.植物生态学报,2005,29(5):697-705.
[4]董鸣.资源异质性环境中的植物克隆生长:觅食行为.植物学报,1996,38(10):828-835.
[6]董鸣.异质性生境中的植物克隆生长:风险分摊.植物生态学,1996,20(6):543-548.
[7]耿宇鹏,张文驹,李博,陈家宽.表型可塑性与外来植物的入侵能力.生物多样性,2004,12(4):447-455.
[9]林金成,强胜.空心莲子草对南京春季杂草群落组成和物种多样性的影响.植物生态学报,2006,30(4):585-592.
[10]林冠伦,杨益众,胡进生.空心莲子草生物学及防治研究.江苏农学院学报,1990,11(2):57-63.
[11]许凯扬,叶万辉,李国民,李静.入侵种喜旱莲子草对光照强度的表型可塑性反应.武汉植物学研究,2005,23(6):560-563.
[12]许凯扬,叶万辉,李静,李国民.入侵种喜旱莲子草对土壤养分的表型可塑性反应.生态环境,2005,14(5):723-726.
[16]陆霞梅,周长芳,安树青,方超,赵晖,杨茜,颜超.植物的表型可塑性、异速生长及其入侵能力.生态学杂志,2007,26(9):1438-1444.
[27]姜立志,王东,刘树楠,潘睿,沈芬,周洁.光照和氮素对喜旱莲子草形态特征和生物量分配的影响.水生生物学报,2010,34(1):101-107.
[37]翁伯琦,林嵩,王义祥.空心莲子草在我国的适应性及入侵机制.生态学报,2006,26(7):2373-2381.
[38]陶勇,陈少风,江明喜.空心莲子草对水分变化的形态适应研究.长江流域资源与环境,2004,13(5):454-459.
[39]刘建.中国入侵植物分布格局和特性分析[D].济南:山东大学,2005:112-112.
