恶性血液病患者T淋巴细胞亚群的检测分析
2014-05-05李国霞任方刚王宏伟魏百合
甄 祯 叶 芳 李国霞 任方刚 王宏伟 魏百合
山西医科大学第二医院血液科,太原 030001
恶性血液病患者T淋巴细胞亚群的检测分析
甄 祯 叶 芳▲李国霞 任方刚 王宏伟 魏百合
山西医科大学第二医院血液科,太原 030001
目的 探讨恶性血液病患者外周血T淋巴细胞亚群的特征及其临床意义。 方法 应用流式细胞仪对120例恶性血液病患者(急性白血病、慢性白血病、淋巴瘤、多发性骨髓瘤)及40例正常人外周血T淋巴细胞亚群进行检测,并比较各组的差异。 结果 恶性血液病组的CD3+、CD4+、CD4+/CD8+、CD3+CD16+CD56+T淋巴细胞比例低于对照组,CD8+T淋巴细胞比例高于对照组,差异有统计学意义(P<0.05);AL组、CL组、LM组和MM组的CD3+、CD4+、CD4+/CD8+、CD3+CD16+CD56+T淋巴细胞比例低于对照组,CD8+T淋巴细胞比例高于对照组,差异有统计学意义(P<0.05)。结论 恶性血液病患者机体免疫功能失衡导致机体免疫力下降,抗肿瘤能力减弱,T淋巴细胞亚群的检测可以为恶性血液病的诊断、治疗及判断预后提供依据。
T淋巴细胞亚群;恶性血液病;免疫功能
血液病是指原发于造血系统的一类疾病,其中恶性血液病在所有恶性肿瘤中的发病率排第6位[1],包括急慢性白血病、恶性淋巴瘤、多发性骨髓瘤(MM)、骨髓增生异常综合征等,是严重威胁人类健康的一类重大疾病。T淋巴细胞是参与机体免疫应答功能的重要细胞成分,其在体内的数量和比例关系相对稳定,一旦出现数量变化或比例失调可导致多种疾病的发生。恶性肿瘤的发生、发展多伴有T淋巴细胞亚群的改变,出现免疫功能紊乱,相关文献研究了恶性实体瘤患者体内的T淋巴细胞亚群变化[2-4]。目前对恶性血液病患者体内T淋巴细胞亚群,特别是NKT淋巴细胞比例变化的报道相对较少。本研究对120例恶性血液病患者和40例正常对照组外周血T淋巴细胞亚群进行比较分析,评估恶性血液病患者的免疫功能,明确其在血液病的发病机制。
1 资料与方法
1.1 一般资料
选取2012年9月~2013年9月在本院血液科住院患者120例为研究对象,所有患者均依据张之南血液病诊断标准[5]明确诊断,其中急性白血病(AL)53例,慢性白血病(CL)18例,MM 21例,淋巴瘤(LM)28例;男68例,女52例;年龄16~87岁,平均57岁。对照组40例,男19例,女21例;年龄21~52岁,平均41岁。两组的性别、年龄、身体状况等比较差异无统计学意义(P>0.05),具有可比性。
1.2 实验仪器和试剂
流式细胞仪型号为Beckman-Coulter公司的FC 500(Beckman Coulter,U.S.A);试剂单克隆抗体(McAb)为Beckman-Coulter公司产品。
1.3 实验方法
空腹抽取患者及健康体检者外周静脉血2 ml,置于EDTA抗凝管内,2 h内送检,于试管内分别加入单克隆抗体CD3-FITC/(CD16+CD56)-PE及CD4-FITC/ CD8-PE/CD3-PC5,然后吸取样本100 μl,PBS缓冲液1 ml,混匀,室温避光孵育15 min后加入溶血素,混匀后避光反应10 min,再于试管中加入PBS缓冲液2 ml进行洗涤,离心后弃上清液,重复洗涤1次,最后加PBS缓冲液500 μl,置于流式细胞仪中进行检测。
1.4 统计学处理
采用SPSS 17.0统计软件对数据进行分析和处理,计量资料以±s表示,采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组T淋巴细胞亚群变化的比较
恶性血液病组的CD3+、CD4+、CD4+/CD8+、CD3+CD16+CD56+T淋巴细胞比例低于对照组,CD8+T淋巴细胞比例高于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组T淋巴细胞亚群变化的比较(%,±s)

表1 两组T淋巴细胞亚群变化的比较(%,±s)
与对照组比较,*P<0.05
组别 n C D3+ C D4+ C D8+ C D4+/ C D8+C D3+C D16+C D56+恶性血液病组对照组1 2 0 6 5 . 1 2 ± 5 . 3 6*2 7 . 2 4 ± 9 . 1 2*3 1 . 7 ± 7 . 1 1*0 . 9 1 ± 0 . 6 7*3 . 5 1 ± 1 . 3 7*4 0 7 3 . 1 ± 1 2 . 1 4 3 3 . 1 5 ± 1 0 . 2 8 2 6 . 7 ± 6 . 0 6 1 . 5 3 ± 0 . 8 7 6 . 4 5 ± 4 . 2 8
2.2 不同恶性血液病与对照组T淋巴细胞亚群变化的比较
AL组、CL组、LM组和MM组的CD3+、CD4+、CD4+/ CD8+、CD3+CD16+CD56+T淋巴细胞比例低于对照组,CD8+T淋巴细胞比例高于对照组,差异有统计学意义(P<0.05)(表2)。
表2不同恶性血液病组与对照组T淋巴细胞亚群变化的比较(%,±s)
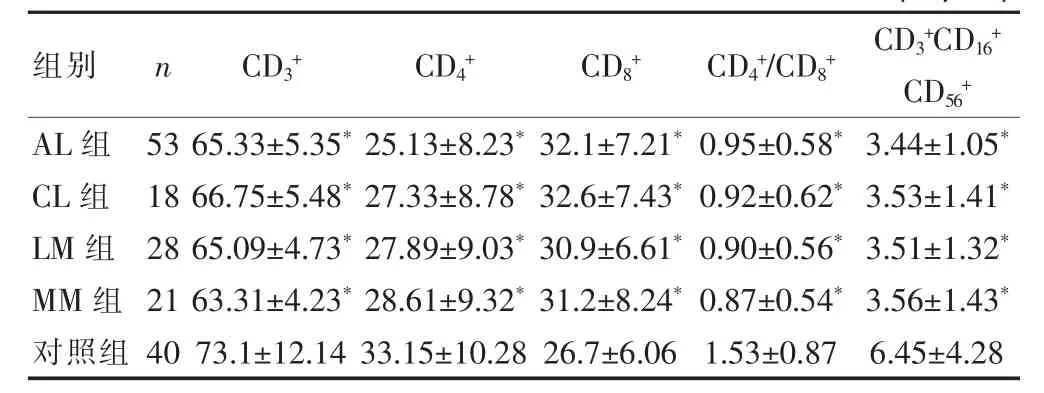
表2不同恶性血液病组与对照组T淋巴细胞亚群变化的比较(%,±s)
与对照组比较,*P<0.05
组别 n C D3+ C D4+ C D8+ C D4+/ C D8+ C D3+C D16+C D56+A L 组C L 组L M 组M M组对照组5 3 1 8 2 8 2 1 4 0 6 5 . 3 3 ± 5 . 3 5*6 6 . 7 5 ± 5 . 4 8*6 5 . 0 9 ± 4 . 7 3*6 3 . 3 1 ± 4 . 2 3*7 3 . 1 ± 1 2 . 1 4 2 5 . 1 3 ± 8 . 2 3*2 7 . 3 3 ± 8 . 7 8*2 7 . 8 9 ± 9 . 0 3*2 8 . 6 1 ± 9 . 3 2*3 3 . 1 5 ± 1 0 . 2 8 3 2 . 1 ± 7 . 2 1*3 2 . 6 ± 7 . 4 3*3 0 . 9 ± 6 . 6 1*3 1 . 2 ± 8 . 2 4*2 6 . 7 ± 6 . 0 6 0 . 9 5 ± 0 . 5 8*0 . 9 2 ± 0 . 6 2*0 . 9 0 ± 0 . 5 6*0 . 8 7 ± 0 . 5 4*1 . 5 3 ± 0 . 8 7 3 . 4 4 ± 1 . 0 5*3 . 5 3 ± 1 . 4 1*3 . 5 1 ± 1 . 3 2*3 . 5 6 ± 1 . 4 3*6 . 4 5 ± 4 . 2 8
3 讨论
T淋巴细胞是一组由胸腺生成,细胞表面含有特殊标志的免疫细胞,是机体执行细胞免疫功能及免疫调节功能的重要细胞成分,包括Th细胞、Tc细胞、NKT淋巴细胞等。Th细胞的主要细胞表面标志是CD3+和CD4+,是辅助性T淋巴细胞,也是迟发性超敏反应的启动者,可以促使B细胞产生抗体的辅助细胞,具有诱导抑制性T淋巴细胞(Ts细胞)、促进效应细胞发挥抗肿瘤作用的功能[6]。Tc细胞是细胞毒性T淋巴细胞介导反应的效应细胞,具有特异性杀伤肿瘤细胞的功能,Th/Tc一般相对稳定,是机体细胞免疫状态的中心环节,一旦出现Th细胞数量减少和Tc细胞数量增多或者Th/Tc比值发生改变时,可以使机体免疫功能发生变化[7]。NKT淋巴细胞具有NK细胞特性的T淋巴细胞亚群[8],既有T淋巴细胞的抗肿瘤免疫活性,又具有NK细胞非MHC限制性杀瘤特点[9],虽然NKT淋巴细胞在人体中的数量相对较少,但是机体抵御感染、抵抗肿瘤、调节自身免疫平衡的重要细胞[10]。
恶性肿瘤患者普遍存在免疫功能下降,主要体现在细胞免疫功能方面,且肿瘤的发生、发展与T淋巴细胞亚群有密切联系,机体抗肿瘤细胞免疫功能紊乱是肿瘤发生的重要原因之一[11]。细胞免疫是人体特异性免疫功能的一部分,相关研究表明恶性血液肿瘤患者体内执行细胞免疫功能的淋巴细胞数量减少和功能缺陷,使机体抗肿瘤能力减弱,从而导致恶性肿瘤细胞的生成和发展[12]。外周血中的CD3+、CD4+、CD8+、CD3+CD16+CD56+T淋巴细胞是反映细胞免疫功能的主要细胞,检测T淋巴细胞亚群的变化可以评估疾病的进展和预后,T淋巴细胞各亚群之间有截然不同的细胞生理功能,在数量和功能上出现异常时,可导致机体正常细胞一系列的病理生理变化。本研究结果显示,恶性血液病组患者外周血CD3+、CD4+、CD4+/CD8+、CD3+CD16+CD56+T淋巴细胞比例较正常对照组明显下降,其中AL、CL、LM和MM患者外周血CD3+、CD4+、CD4+/CD8+、CD3+CD16+CD56+T淋巴细胞比例低于对照组,而CD8+T淋巴细胞较对照组明显升高,说明恶性血液病患者出现免疫功能失衡,其抗肿瘤细胞数量减少,导致机体抗肿瘤能力减弱,与相关文献报道基本一致[13-14]。
综上所述,分析恶性血液病患者外周血T淋巴细胞亚群变化情况,可以评估恶性血液病患者的免疫功能状况,明确其在血液病发病机制和疾病诊断中的作用,为患者进一步治疗及判断预后提供一定的理论依据。
[1]Harris NL,Jaffe ES,Diebold J,et al.World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues:report of the Clinical AdvisoryCommittee meeting-Airlie House,Virginia,November 1997[J]. J Clin Oncol,1999,17(12):3835-3849.
[2]齐红,石虹,刘玉侠,等.253例恶性肿瘤患者外周血T淋巴细胞亚群的检测及其临床意义分析[J].中国实验诊断学,2009,13(11):1589-1590.
[3]杨德芬.外周血T淋巴细胞亚群检测在恶性肿瘤中的应用及临床意义[J].海南医学院学报,2013,19(10):1390-1392,1395.
[4]亢澜涛,张桂荣.411例恶性肿瘤患者T淋巴细胞亚群的检测分析[J].实用肿瘤学杂志,2007,21(4):362,365.
[5]张之南.血液病诊断与疗效标准[M].北京:科学出版社,1998:1-433.
[6]陈派强.外周血T细胞亚群检测在恶性肿瘤中的价值[J].医药论坛杂志,2012,33(4):118-119.
[7]Yasutomo K.The cellular and molecular mechanism of CD4/ CD8 lineage commitment[J].J Med Invest,2002,49(1-2):1-6.
[8]Godfrey DI,MacDonald HR,Kronenberg M,et al.NKT cells: what′s in a name?[J].Nat Rev Immunol,2004,4(3):231-237.
[9]Yamaguchi Y,Ohshita A,Kawabuchi Y,et al.Adoptive immunotherapy of cancer using activated autologous lymphocytes—current status and new strategies[J].Hum Cell,2003,16(4):183-189.
[10]Brigl M,BrennerMB.CD1:antigen presentation and T cell function[J].Annu Rev Immunol,2004,22:817-890.
[11]Des Guetz G,Uzzan B,Nicolas P,et al.Microvessel density and VEGF expression are prognostic factors in colorectal cancer.Meta-analysis of the literature[J].Br J Cancer,2006,94(12):1823-1832.
[12]Kosmidis S,Baka M,Bouhoutsou D,et al.Longitudinal assessment of immunological status and rate of immune recovery following treatment in children with ALL[J].Pediatr Blood Cancer,2008,50(3):528-532.
[13]张强,翟志敏,李庆,等.几种血液病患者细胞免疫功能分析及其临床意义[J].中国实验诊断学,2007,11(2):263-265.
[14]礼征楠,王亚男,董敏,等.T-淋巴细胞亚群在血液病中的诊断应用[J].中国医疗前沿,2010,5(4):63,73.
Detection and analysis of T lymphocyte subset in patient with hematologic malignancy
ZHEN Zhen YE Fang▲LI Guo-xia REN Fang-gang WANG Hong-weiWEI Bai-he
Department of Hematology,the Second Hospital of Shanxi Medical University,Taiyuan 030001,China
ObjectiveTo explore the feature and clinical significance of T lymphocyte subset in patient with hematologic malignancy.MethodsThe peripheral blood T lymphocyte subset of 120 cases of patients with hematologic malignancy(acute leukemia,chronic leukemia,lymphoma,multiple myeloma)and 40 cases of normal people was detected by flow cytometry respectively,the difference between each group was analyzed.ResultsCD3+,CD4+,CD4+/CD8+,CD3+CD16+CD56+T lymphocyte cell in hematologic malignancy group was lower than that in control group respectively,CD8+T lymphocyte cell in hematologic malignancy group was higher than that in control group,with statistical difference(P<0.05).CD3+,CD4+, CD4+/CD8+,CD3+CD16+CD56+T lymphocyte cell in AL group,CL group,LM group and MM group was lower than that in control group respectively,CD8+T lymphocyte cell in AL group,CL group,LM group and MM group was higher than that in control group respectively,with statistical difference(P<0.05).ConclusionThe imbalanced immunity function of patients with hematologic malignancy leads to decreased organism immunity,weakens the ability of resisting tumor.The detection of T lymphocyte cell subset can provide evidence for diagnosis,treatment and prognosis judgment for hematologic malignancy.
T lymphocyte subset;Hematologic malignancy;Immunity function
R733
A
1674-4721(2014)03(c)-0101-03
2014-02-18本文编辑:李亚聪)
山西省国际科技合作项目(2012081044-1);山西省留学基金(晋留管办发[2009]9号106);山西省人事厅归国留学人员择优资助项目(晋财社[2011]172号)
▲通讯作者
