乳腺浸润性小叶癌的临床病理特征及保乳切缘阳性的危险因素分析
2014-05-05秦春新禚守荣秦立新
秦春新禚守荣秦立新
(1 山东省威海市立医院乳腺外科,山东 威海 264200;2 山东省莱州市中医院,山东 莱州 261400)
乳腺浸润性小叶癌的临床病理特征及保乳切缘阳性的危险因素分析
秦春新1禚守荣1秦立新2
(1 山东省威海市立医院乳腺外科,山东 威海 264200;2 山东省莱州市中医院,山东 莱州 261400)
目的 探讨乳腺浸润性小叶癌的临床病理特征及保乳切缘阳性的危险因素分析。方法 回顾我院2000年至2012年浸润性小叶癌病例资料,描述浸润性小叶癌临床病理特征,分析影响保乳切缘的临床病理因素。结果 我院浸润性小叶癌手术患者78例,其中行保乳手术患者20例,一次手术保乳成功率为60%。单因素分析切检(P= 0.009),超声/钼靶提示结构紊乱(P= 0.009),超声/钼靶提示多中心或多灶性(P=0.006),术前核磁检查提示多中心或多灶性(P= 0.002)与阳性切缘显著相关。Logistic回归表明术前核磁检查结果为影响保乳切缘的主要危险因素 (P= 0.025)。结论 浸润性小叶癌可选择保乳的手术方式,术前核磁检查提示多中心或多灶性的患者保乳切缘阳性风险较大。保乳术前核磁检查应尤为重视。
乳腺浸润性小叶癌;病理特征;保乳;危险因素
浸润性小叶癌(ILC)占乳腺浸润性癌的8%~14%,是浸润性乳腺癌的第二种常见类型,仅低于浸润性导管癌(IDC)。近年来,ILC在绝经后妇女中的发病率逐年升高[1]。与浸润性乳腺癌其他类型相比,ILC具有多灶性(跳跃性)病灶,双侧发生及多中心发生的特点[2],ILC生长方式广泛浸润,临床触诊及影像学检查难以发现边界清楚的肿块。病灶多中心,常常累及双侧乳房,术后容易复发,目前对于ILC是否能够选择保乳手术仍存在争议,对于如何根据临床病理特征筛选适合保乳患者的问题仍不明确[1,3]。本文回顾我院2000年~2012年浸润性小叶癌病例资料,描述浸润性小叶癌临床病理特征,分析接受保乳治疗的病例,分析影响保乳切缘的临床病理因素,以期为临床浸润性小叶癌患者术式选择提供依据。
1 资料与方法
1.1 一般资料
回顾我院2000年~2012年78例乳腺浸润性小叶癌病例。由一位病理科医师对病理结果进行重新读片重新确认其病理,混有导管-小叶成分的不纳入本研究。
1.2 研究方法
从病例中获取如下临床病理资料:是否绝经、肿瘤大小、淋巴结转移、活检方法(切检或针吸)、手术相关信息、记录钼靶及超声结果(大小、是否出现结构紊乱、是否为多灶、多中心)。T分期根据第六版 TNM分期系统。肿瘤T分期≥T2,腋窝淋巴结为阳性(超声或活检结果)的患者在我中心建议接受新辅助化疗。记录患者是否行新辅助化疗。对浸润性小叶癌患者行保乳或根治术由医师根据病情及患者意愿共同决定。所有患者或进行全腋窝淋巴结清扫,或行前哨淋巴结活检。
对于行保乳手术的患者,区段切除的标本切缘按照标准进行术中评判。使用缝线和墨水标记乳腺组织的上下、外侧、内侧、中部。标本3~5 mm每层。检查标本边缘至肿块附近。切缘阳性为有肿瘤细胞或DCIS浸润肿瘤边缘2 mm以内。阴性切缘定义为距离肿瘤≥ 2 mm。若切缘距离肿物<2 mm则行二次扩大切除,若切缘阳性则改行乳腺癌改良根治术。行免疫组化检查ER PR受体及HER-2受体的情况,ER阳性,PgR 阳性定义为> 10%。HER2/neu status使用免疫组化或Fish检查。HER2阳性定义为免疫组化3+或FISH阳性。研究终点为保乳手术是否成功,主要评价指标为切缘(阴性,近切缘或阳性切缘)。
1.3 统计方法
单因素分析采用卡方检验,将单因素分析差异有显著意义的因素纳入Logistic模型多因素回归分析,应用SPSS17.0统计软件进行分析。
2 研究结果
2.1 浸润性小叶癌临床病理特征
本组78例乳腺癌占同期本院收治乳腺癌病例总数6.5%,平均年龄为(53.29±1.36) (30~81)岁。38例(48.7%)绝经前,40例(51.3%)绝经后。16例(20.5%)临床触诊未触及肿物,其中9例经超声提示出可疑病灶,13例经钼靶检查提示可疑病灶,超声与钼靶联合检查可检出该16例临床未触及的病灶。25例(32.1%)T≤2 cm,48例(44.7%)2<T≤5 cm,5例(7%)T>5 cm。36例淋巴结为阴性(46.2%),1~3枚阳性淋巴结为32例(41.0%),4~10枚阳性淋巴结为10例(12.8%)。ER(+)54例(69.2%),PR(+)53例(67.9%)。HER-2(-)62例(79.5%)。组织学I级30例(38.5%),组织学Ⅱ级42例(53.8%),Ⅲ级6例(7.7%)。
2.2 保乳患者阳性切缘的危险因素
本组患者20例行保乳,其中保乳成功切缘阴性为12例,切缘周边距离肿物较近者4例,切缘阳性4例。术中冰冻病理检查切缘,6例为切缘有癌组织,2例切缘距离癌组织较近,12例切缘阴性,一次手术保乳成功率为60%。对2例距离癌组织较近患者行局部扩大切除后再送检呈阴性。术后石蜡病理检查,14例病例切缘均未见癌细胞。对6例切缘有癌组织患者行改良根治术。①一次手术切缘情况与临床病理因素之间的关系:表1为浸润性小叶癌保乳手术切缘与临床病理因素之间的关系。单因素分析切检(vs. 与粗针吸或细针吸活检相比;P= 0.009),超声/钼靶提示结构紊乱(vs.仅有肿块或钙化;P= 0.009),超声/钼靶提示多中心或多灶性(vs.局限单病灶P=0.006),术前核磁检查提示多中心或多灶性(vs.局限单病灶P= 0.002) 经单因素分析与阳性切缘显著相关。②Logistic回归分析:为筛选出影响浸润性小叶癌保乳切缘结果的主要危险因素,将上述全部因素同时引入Logistic回归模型,采用逐步向前筛选出较优的方程。结果表明,术前核磁检查结果为影响保乳切缘的主要危险因素 (核磁检查提示多中心性多灶性相对于核磁提示局限单病灶的危险比为33.00 [95% CI,1.56-697.96];P= 0.025)。
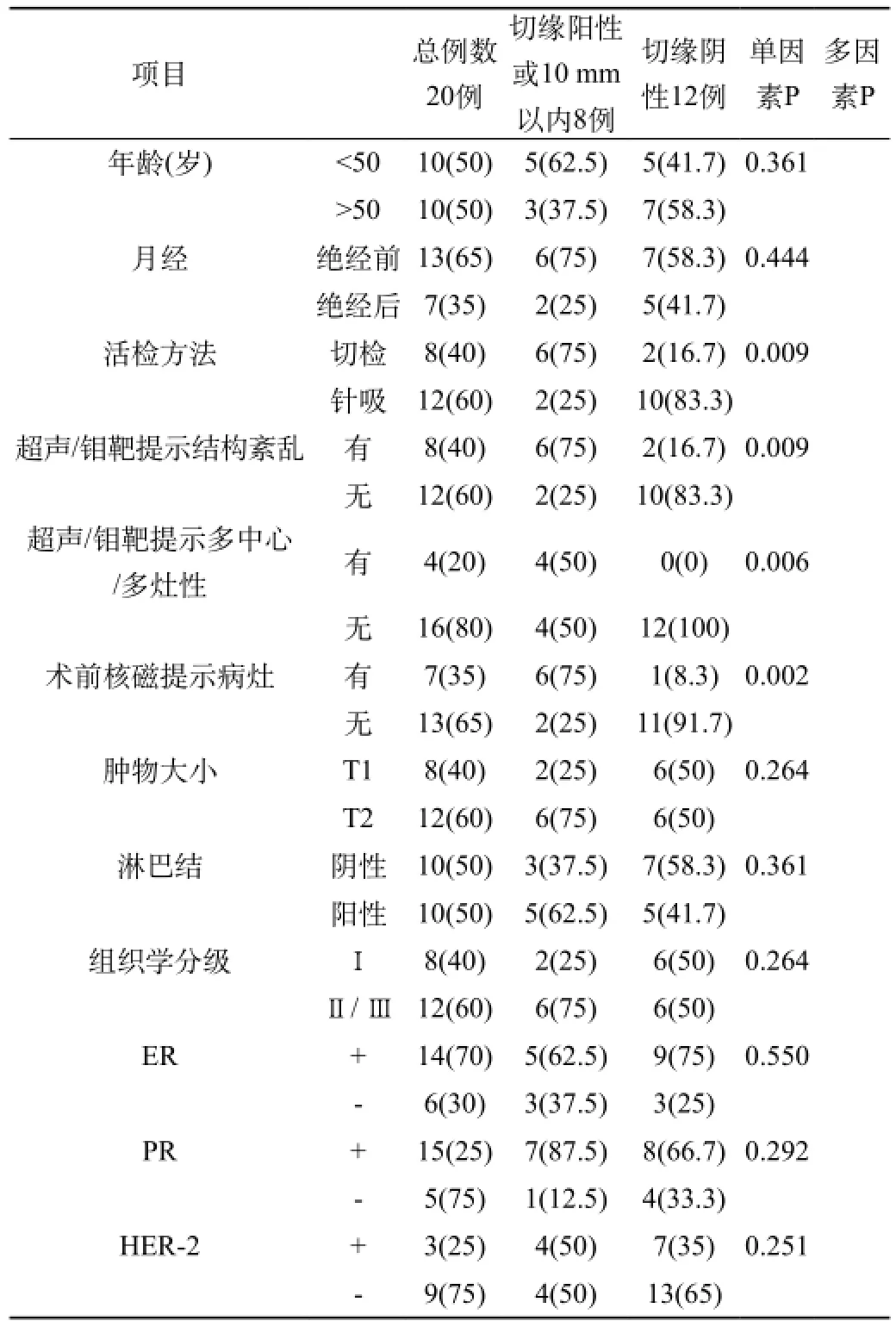
表1 浸润性小叶癌保乳手术切缘与临床病理因素之间的关系。
3 讨 论
浸润性小叶癌是继浸润性导管癌之后第二大乳腺恶性肿瘤常见的病理类型。与浸润性导管癌相比主要有以下几点不同:浸润性小叶癌确诊时肿块体积相对较大,本组T2及以上的肿物占51.7%,淋巴结阳性者占53.8%。ILC的生长方式可不破坏正常组织结构、较少引起继发性纤维化改变,病灶往往临床触诊不清,本组20.5%临床触诊未触及到明确肿块,仅有局限增厚或未触及。免疫组化检测ER,PR阳性率较高,HER-2阳性率低,本组ER(+)69.2%,PR(+)67.9%,HER-2(-)79.5%,与国内外研究结果一致[4,5]。ILC易发生转移的部位与IDC不同,ILC较容易转移至胃肠道、腹腔、子宫、脑,而IDC较长发生肺、肝及骨转移。
随乳腺癌综合治疗的发展及患者对美学要求的提高,乳腺癌保乳率逐年提高。最新一项大型三期前瞻性临床试验结果表明在早期乳腺癌患者中,行保乳术与改良根治术的患者二者生存期无显著差异[6]。年龄、组织学分级、广泛导管内成分、多中心/多灶性乳腺癌为影响保乳成功率的主要因素[7]。然而目前尚无大规模前瞻性研究对不同病理类型乳腺癌保乳进行进一步分析。Sulyok等研究纳入了235例ILC,其中163例行乳腺癌改良根治术,72例行保乳。ILC患者中,行根治术或保乳随访15年,无远处转移生存期无显著差异(62% vs.70%;P=0.2017),总生存率无显著差异(62% vs.70%;P=0.1728),并提出有无放疗对乳腺癌术后复发影响较大,随访15年,放疗组复发率为10%,未放疗组复发率为53%[8],本组研究通过一次手术保乳成功率为60%,ILC临床病理特点常为广泛浸润生长,ILC与IDC保乳相比较难获得阳性切缘。IDC为3.9%-24% ,而ILC 阳性切缘率为20.0%~49%,具有显著差异[9,10]。故浸润性小叶癌保乳的病例选择仍需慎重。
依据预后因素对浸润性小叶癌保乳病例进行选择,保乳术能够成为浸润性小叶癌的一种适合的治疗方法。既往研究指出钼靶肿瘤体积> 1.5 cm ,病理回报肿瘤体积在2.0 cm 以上,脉管癌栓,多灶性,多中心为切缘阳性的预后因素。浸润性小叶癌保乳的患者,术前超声检查回报结构紊乱、活检方法为切检、病理结果含有导管内癌成分,为保乳失败的危险因素[10-12]。本研究中切检,超声/钼靶提示结构紊乱,超声/钼靶提示多中心或多灶性,术前核磁检查提示多中心或多灶性与阳性切缘显著相关。
ILC钼靶及超声诊断也相对困难,敏感性低于导管癌,且检测肿物大小常低于实际大小,若仅依据钼靶或超声术前评估肿物大小行保乳术,往往造成保乳切缘阳性或距离肿物较近[13]。乳腺核磁对乳腺癌的诊断敏感性较高,对浸润性小叶癌的敏感性亦高,为88%~96%,核磁诊断结果与病理结果相关度达0.89,高于其他检查手段[14]。本研究多因素分析术前行核磁检查发现多中心性病灶或肿瘤多灶性生长为保乳切缘阳性最主要的危险因素。研究表明有为12%~33%乳腺癌患者在行核磁检查后需将手术方案由保乳改为改良根治术或改为行新辅助化疗后再行手术治疗[14]。故对于ILC保乳更应重视术前核磁检查,对肿瘤分期及生长方式进行充分评估再决定是否适合保乳。
4 结 论
浸润性小叶癌可选择保乳的手术方式,但需依据临床病理特征对适合保乳的患者进行筛选,切检,超声或钼靶提示结构紊乱,多中心或多灶性,术前核磁检查提示多中心或多灶性的患者保乳切缘阳性风险较大。保乳术前核磁检查应尤为重视。
[1] Cao AY,Huang L,Wu J,et al.Tumor characteristics and the clinical outcome of invasive lobular carcinoma compared to infiltrating ductal carcinoma in a Chinese population[J].World J Surg Oncol,2012,10:152.
[2] 李崖青,郭晓静,刘芳芳,等.乳腺浸润性小叶癌的研究进展[J].中国肿瘤临床,2012,29(3):170-173.
[3] Galimberti V,Maisonneuve P,Rotmensz N,et al.Influence of margin status on outcomes in lobular carcinoma:experience of the European Institute of Oncology[J].Ann Surg,2011,253(3):580-584.
[4] Sikora MJ,Jankowitz RC,Dabbs DJ,et al.Invasive lobular carcinoma of the breast:Patient response to systemic endocrine therapy and hormone response in model systems[J].Steroids,2013 ,78(6):568-575.
[5] 张奇兵,杨明,张鹏,等.乳腺浸润性小叶癌临床病理特点[J].中国老年学杂志,2011,31(17):3246-3248.
[6] Litiere S,Werutsky G,Fentiman IS,et al.Breast conserving therapy versus mastectomy for stage I-Ⅱ breast cancer:20 year follow-up of the EORTC 10801 phase 3 randomised trial[J]. Lancet Oncol,2012,13(4):412-419.
[7] Kapoor NS,Eaton A,King TA,et al.Should Breast Density Influence Patient Selection for Breast-Conserving Surgery? [J]. Ann Surg Oncol,2013,20(2):600-606.
[8] Fodor J,Sulyok Z,Polgar C,et al.Breast-conserving treatment for early invasive lobular breast cancer:15 years results[J].Magy Seb,2001,54(4):209-214.
[9] Shah C,Wilkinson JB,Shaitelman S,et al.Clinical outcomes using accelerated partial breast irradiation in patients with invasive lobular carcinoma[J].Int J Radiat Oncol Biol Phys,2011,81(4): e547-551.
[10] Dillon MF,Hill AD,Fleming FJ,et al.Identifying patients at risk of compromised margins following breast conservation for lobular carcinoma[J].Am J Surg,2006,191(2):201-205.
[11] Dillon MF,Maguire AA,McDermott EW,et al.Needle core biopsy characteristics identify patients at risk of compromised margins in breast conservation surgery[J].Mod Pathol,2008,21(1):39-45.
[12] Silberfein EJ,Hunt KK,Broglio K,et al.Clinicopathologic factors associated with involved margins after breast-conserving surgery for invasive lobular carcinoma[J].Clin Breast Cancer,2010,10(1):52-58.
[13] Fasching PA,Heusinger K,Loehberg CR,et al.Influence of mammographic density on the diagnostic accuracy of tumor size assessment and association with breast cancer tumor characteristics[J].Eur J Radiol,2006,60(3):398-404.
[14] Mann RM.The effectiveness of MR imaging in the assessment of invasive lobular carcinoma of the breast[J].Magn Reson Imaging Clin N Am,2010,18(2):259-276.
Invasive Lobular Carcinoma of the Breast-Conserving Clinicopathological Features and Risk Factors Analysis for Positive Margin
QIN Chun-xin1, ZHUO Shou-rong1, QIN Li-xin2
(1 Department of Breast Surgery, Weihai Municipal Hospital, Weihai 264200, China; 2 Laizhou TCM Hospital, Laizhou 261400, China)
Objective Discussion invasive lobular carcinoma clinicopathological features and conserving positive margin analysis of risk factors. Methods Clinicop athologic features of ILC patients between 2000 and 2012 were retrospectively reviewed to determine if specific clinical and pathologic factors influenced the margins status after breast conserving surgery. Results 78 cases of ILC were reviewed, 20 patients received breast conserving surgery(BCS) as their initial procedure. BCS was successful in 60% patients who received negative margin after 1 surgical procedure. An ultrasonographic/ mammography diagnosis of architectural distortion(P= 0.009), an ultrasonographic or mammography diagnosis of mulifocality and multicentricity lesions(P= 0.002), excisional biopsy(P= 0.009), mulifocality and multicentricity findings by MRI (P= 0.002) were significantly associated with close of positive margins on univariate analysis. Multivariable logistic regression analysis, only MRI diagnosis retained statistical significance (P= 0.025). Conclusion ILC was not a contradiction of breast conserving surgery. MRI diagnosis is a critical predictive factor of margin status after BCS. With appropriate patient selection, most patients can undergo successful BCS. Based on the currently available data, it is strongly recommended that preoperative MR imaging be conducted in all patients with ILC prior to therapy.
Invasive lobular carcinoma; Pathology; Breast-conserving; Risk factors
R737.9
B
1671-8194(2014)18-0058-03
