栀子大黄汤有效成分在体肠吸收研究*
2014-04-30李允郎巧玲冯芳史清水
李允,郎巧玲,冯芳,2**,史清水
中国药科大学 1药物分析教研室;2药物质量与安全预警教育部重点实验室,南京 210009;3江苏省食品药品检验所,南京 210008
栀子大黄汤有效成分在体肠吸收研究*
李允1,郎巧玲1,冯芳1,2**,史清水3
中国药科大学1药物分析教研室;2药物质量与安全预警教育部重点实验室,南京 210009;3江苏省食品药品检验所,南京 210008
目的:研究栀子大黄汤中栀子苷、柚皮苷、橙皮苷和新橙皮苷4种有效成分的大鼠在体肠吸收动力学。方法:运用大鼠在体单向灌流重量法进行肠吸收实验,考察不同吸收部位和药物浓度下的肠吸收动力学,采用HPLC法测定有效成分的浓度。结果:栀子苷、柚皮苷和新橙皮苷在小肠的吸收速率常数(Ka)和有效渗透系数(Peff)显著大于结肠(P<0.05);橙皮苷在十二指肠和空肠吸收参数显著大于回肠和结肠(P<0.05);药物浓度在一定范围内对栀子苷、柚皮苷和新橙皮苷的Ka和Peff无显著影响(P>0.05),橙皮苷的Ka和Peff随浓度的升高先增加后降低。结论:栀子大黄汤中4种有效成分在全肠道均有吸收;栀子苷、柚皮苷和新橙皮苷的吸收机制为被动扩散,橙皮苷在吸收过程中存在高浓度饱和现象,推测吸收机制为主动转运或易化扩散。
栀子大黄汤;活性成分;在体单向灌流;HPLC法
栀子大黄汤来源于《金匮要略》,由栀子、大黄、枳实、淡豆豉组成。临床主要用于治疗酒精性肝病、急性肝炎、病毒性肝炎。本实验室前期研究已经证实,该方的主要有效成分为栀子苷、橙皮苷、柚皮苷和新橙皮苷[1]。中药多以水煎液口服给药,胃肠道吸收对药效具有重要的影响。当前关于肠吸收的实验多以单体有效成分进行研究,本文直接使用栀子大黄汤水煎液进行大鼠在体单向灌流,以方中主要药效成分为研究对象,探讨其在不同吸收部位、不同浓度下的肠吸收动力学,以期为栀子大黄汤的临床药动学和药效学的深入研究提供理论依据,为中药新剂型的研究提供必要的生物药剂学依据。
1 材料
1.1 仪器
LC-2010C高效液相色谱仪、LC-solution工作站(日本岛津公司);Anke TGL-16B高速离心机(上海安亭科学仪器厂)。
1.2 药材与试剂
生栀子(产地:江西,批号:070418)、生大黄(产地:甘肃,批号:070618)、炒枳实(产地:江西,批号:071019)、淡豆豉(产地:江苏,批号:090523),均购自南京先声药店。经中国药科大学中药学院秦民坚教授鉴定:栀子为茜草科植物栀子Gardenia jasminoidesEllis.的干燥成熟果实;大黄为蓼科植物药用大黄Rheum officinaleBaill.的根和根茎;枳实为芸香科植物甜橙Citrus aurantiumL.的干燥幼果;淡豆豉为豆科植物大豆Glycine max(L.)Merr.的成熟种子的发酵加工品;以上4味药材粉碎,过60目筛,待用。
栀子苷对照品(批号:12041808)、柚皮苷对照品(批号:12030612)、橙皮苷对照品(批号:12020304)、新橙皮苷对照品(批号:12030701),均购自成都曼思特公司。Krebs-Ringer试剂(K-R营养液,自制);其余试剂为分析纯。
1.3 动物
SD大鼠,雄性,(200±20)g,购自南京青龙山动物养殖中心,合格证号:SCXK(苏)2013-0001。
2 方法
2.1 栀子大黄汤的制备
取栀子9 g、大黄3 g、枳实12 g、淡豆豉24 g,粉碎,10倍量水浸泡30 min,武火煮沸,文火煎煮30 min,过滤,滤渣继续提取2次,合并滤液;浓缩至60 mL,即得。汤剂中栀子苷、柚皮苷、橙皮苷、新橙皮苷的含量分别约为3.22%、9.86%、0.67%、5.96%。
2.2 灌流液中栀子苷、柚皮苷、橙皮苷和新橙皮苷的HPLC法测定
2.2.1 色谱条件色谱柱:LiChrospher-C18(250 mm ×4.6 mm,5 μm);流动相:0.1%乙酸(A)-甲醇(B),梯度洗脱,洗脱程序如下:0 min 5%B,12.5 min 30%B,26.8 min 36%B,50 min 45%B,55~60 min 95%B,61~70 min 5%B;流速:1.0 mL·min-1;检测波长:258 nm;进样量:20 μL;柱温:25℃。
2.2.2 肠灌流液样品的配制按照“2.1”项下方法制备栀子大黄汤水煎液,精密吸取约5.70 mL,置于100 mL量瓶中,加K-R液稀释至刻度,即得。
2.2.3 样品处理精密移取1 mL肠灌流液样品,加入95%乙醇2.8 mL,振摇、密闭,取适量,16000 r· min-1离心10 min,取上清液进样分析。
2.3 大鼠在体肠吸收实验
2.3.1 大鼠在体肠单向灌流方法试验前用供试液将管道冲洗至出液口药物浓度与供试液浓度相同。取大鼠,腹腔注射20%的乌拉坦(5 mL·kg-1)麻醉,分离出待考察的肠段(十二指肠、空肠、回肠、结肠),各取约10 cm,小心插入硅胶管(2 mm i.d.;4 mm o.d.)并结扎。用预热至37℃的生理盐水冲洗肠道,稳定10 min后通入空气,将肠道内剩余液体排尽,然后用预热至37℃的肠灌流液进行在体单向灌流。实验开始前先以实验灌流液(37℃)灌充肠段,以0.20 mL·min-1的灌流速度[2-3]平衡30 min[4-5],吸收达到稳定状态后,收集30~45、45~60、60~75、75~90、90~105 min时间段内的灌流液样品。收集到的样品存储于-20℃冰箱中,以待后续分析。
2.3.2 大鼠肠吸收动力学参数的计算与统计分析将灌流后收集到的肠灌流液样品按照“2.2.3”项下进行处理,按照“2.2.1”色谱条件进行HPLC法分析,以重量法计算各组的吸收速率常数(Ka)和有效渗透系数(Peff),并采用SPSS 16.0统计软件对各组吸收参数进行单因素方差分析。公式为:
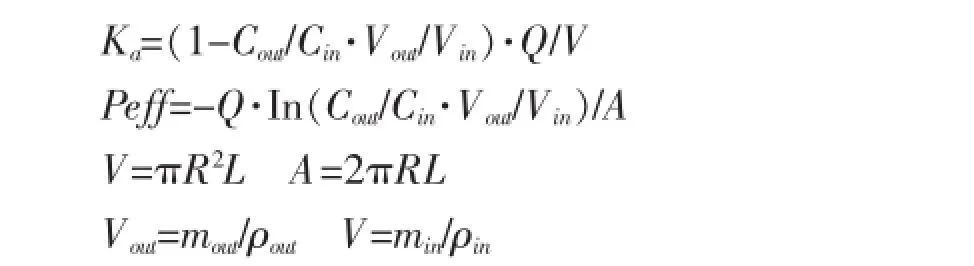
式中:Cin和Cout分别为肠道进口和出口灌流液的浓度(μg·mL-1);Q为灌流速度(0.2 mL·min-1);Vin和Vout分别为灌入和收集的供试液的体积(mL,假定供试液的密度为1.0 g·mL-1,根据测得的质量计算体积);L为灌流肠段的长度(cm);R为灌流肠段的横截面半径(0.18 cm[6]);A为灌流肠段的表面积(cm2),V为灌流肠段的体积(cm3)。
3 结果
3.1 专属性考察
以空白K-R液作为肠灌流液进行大鼠在体单向灌流,即得空白肠灌流液。分别制备空白肠灌流液、空白肠灌流液加混合对照品溶液、含药肠灌流液样本,按照“2.2.3”项下进行处理,进样。结果表明,空白肠灌流液及汤剂中的其他成分不干扰测定。结果见图1。
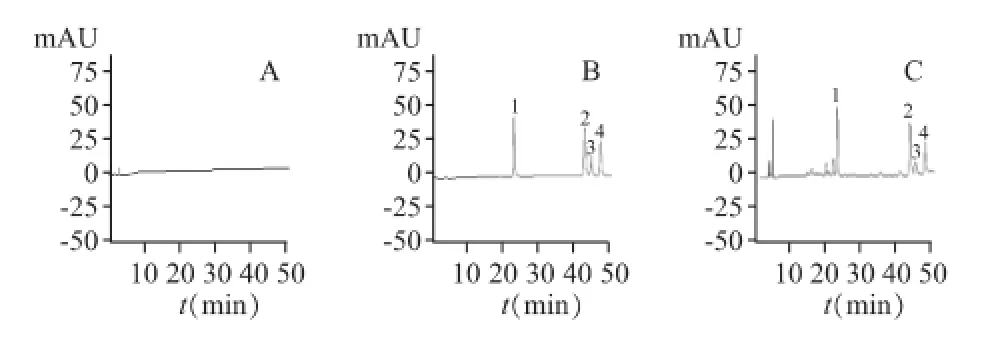
图1 栀子大黄汤肠灌流液色谱图
3.2 线性关系考察
分别取各对照品适量,置20 mL量瓶中,加入空白肠灌流液定容,得对照品储备液。分别精密吸取储备液10、5、2.5、1、0.4 mL于20 mL量瓶中,加入空白肠灌流液配制成系列混合对照品溶液,按照“2.2.3”项处理后进样、测定,结果见表1。
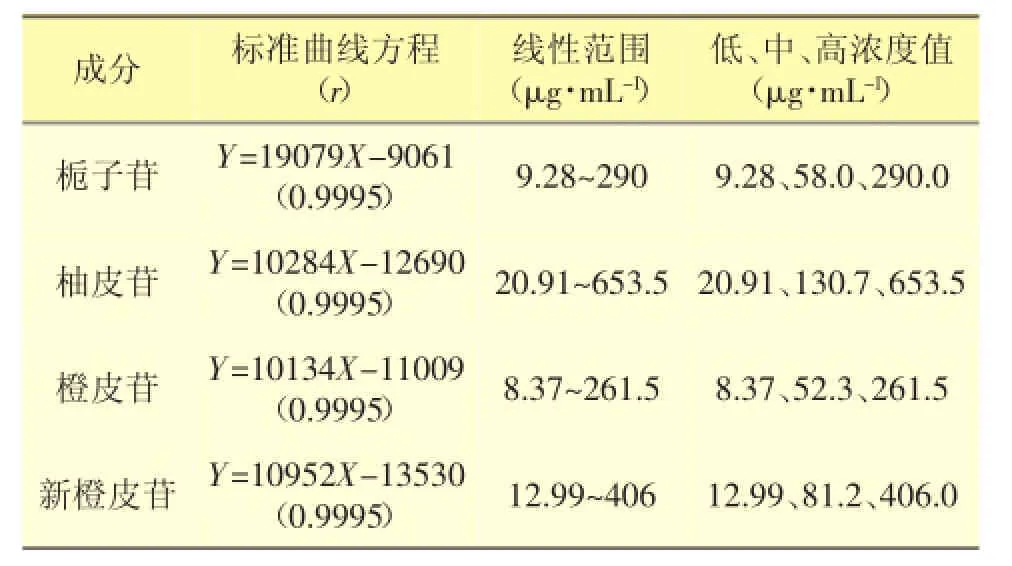
表1 4种物质的标准曲线及线性范围
3.3 精密度测定
分别配制低、中、高3种浓度的模拟肠灌流液样品,重复测定5次,连续测定5天,计算日内、日间精密度。各物质日内、日间精密度均在0.11%~1.35%,符合方法学要求。
3.4 提取回收率
配制低、中、高3种浓度的模拟肠灌流液样品,依法处理、分析,结果表明,各测定成分的提取回收率均在96.7%~104.8%(n=5)。
3.5 稳定性考察
配制低、中、高3种浓度的供试品溶液,置于37℃水浴中,分别于0、30、60、90、120 min取样,测定结果显示4种物质在灌流液中2 h稳定。
分别考察上述供试品室温放置8 h,3次反复冻融,-20℃冰柜中放置10 d的稳定性,以及处理后样本4℃进样器放置的稳定性。结果表明,样本上述条件下均无明显变化。
3.6 药物肠吸收影响因素考察
3.6.1 药物在不同肠段的吸收情况取4只大鼠,分别取十二指肠、空肠、回肠、结肠段,分别对其进行单向灌流。结果见表2。
表2 栀子大黄汤中4种特征成分在不同肠段的吸收参数(±s,n=4)
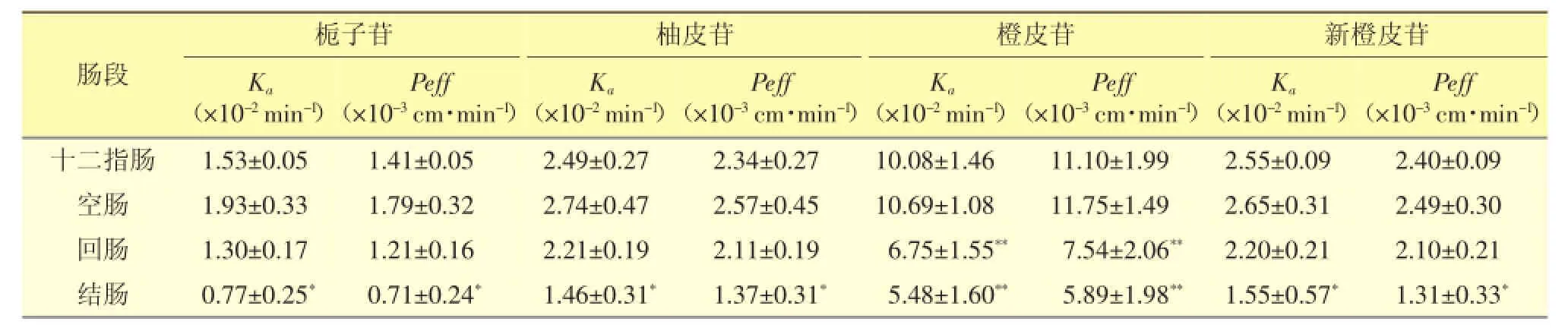
表2 栀子大黄汤中4种特征成分在不同肠段的吸收参数(±s,n=4)
注:与空肠段相比,*P<0.05,**P<0.01
栀子苷新橙皮苷柚皮苷橙皮苷肠段KaKa Ka(×10-2min-1)(×10-2min-1)Peff(×10-3cm·min-1)(×10-2min-1)Peff(×10-3cm·min-1)(×10-2min-1)Peff(×10-3cm·min-1)KaPeff(×10-3cm·min-1)十二指肠1.53±0.051.41±0.052.49±0.272.34±0.2710.08±1.4611.10±1.992.55±0.092.40±0.09空肠1.93±0.331.79±0.322.74±0.472.57±0.4510.69±1.0811.75±1.492.65±0.312.49±0.30回肠1.30±0.171.21±0.162.21±0.192.11±0.196.75±1.55**7.54±2.06**2.20±0.212.10±0.21结肠0.77±0.25*0.71±0.24*1.46±0.31*1.37±0.31*5.48±1.60**5.89±1.98**1.55±0.57*1.31±0.33*
结果显示,栀子苷、柚皮苷和新橙皮苷的主要吸收部位均为空肠、十二指肠和回肠,且三个肠段间的吸收均无显著差异(P>0.05),但显著大于结肠(P<0.05);橙皮苷的主要吸收部位为空肠和十二指肠,与回肠和结肠的Ka和Peff有极显著差异(P<0.01)。由此可知,栀子大黄汤中的4种有效成分主要在小肠吸收,结肠吸收较少。
3.6.2 药物不同浓度对肠吸收的影响分别量取2.85、5.70、11.40mL的栀子大黄汤溶液于3个100mL量瓶中,用K-R液配制成低、中、高3种浓度(分别相当于人用剂量的0.5倍、1倍和2倍)的肠灌流液样品,对大鼠空肠段进行单向灌流实验,结果见表3。
表3 栀子大黄汤中4种物质在不同浓度下的吸收参数(±s,n=4)
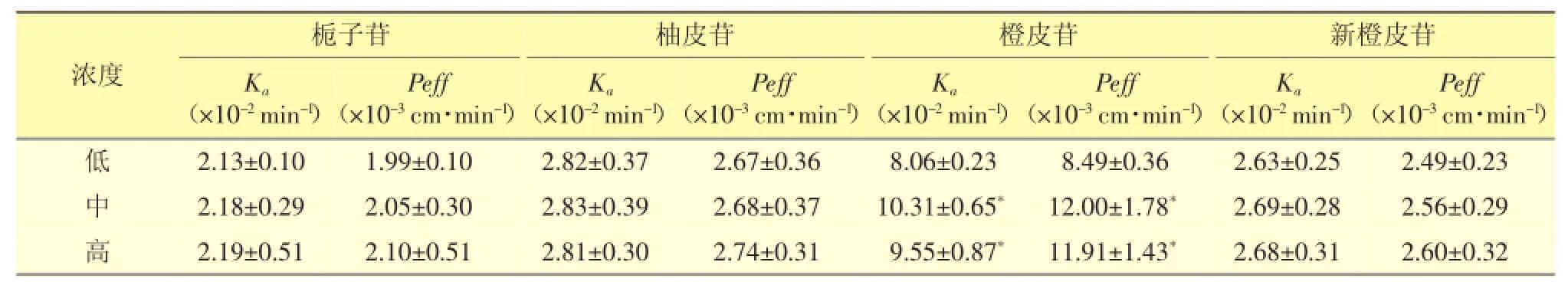
表3 栀子大黄汤中4种物质在不同浓度下的吸收参数(±s,n=4)
注:与低浓度组相比,*P<0.05
栀子苷柚皮苷橙皮苷新橙皮苷KaPeff(×10-3cm·min-1)浓度KaPeff(×10-3cm·min-1)Peff(×10-3cm·min-1)Ka Ka (×10-2min-1)(×10-2min-1)(×10-2min-1)(×10-2min-1)Peff(×10-3cm·min-1)低2.13±0.101.99±0.102.82±0.372.67±0.368.06±0.238.49±0.362.63±0.252.49±0.23中2.18±0.292.05±0.302.83±0.392.68±0.3710.31±0.65*12.00±1.78*2.69±0.282.56±0.29高2.19±0.512.10±0.512.81±0.302.74±0.319.55±0.87*11.91±1.43*2.68±0.312.60±0.32
结果显示,栀子苷、柚皮苷和新橙皮苷在不同浓度下的吸收参数无显著差异(P>0.05);随浓度的升高,橙皮苷的吸收先增加后降低,低浓度与中、高浓度的吸收参数有显著差异(P<0.05),说明栀子苷、柚皮苷和新橙皮苷在空肠的吸收均以被动扩散为主,橙皮苷的吸收机制可能为主动转运或易化扩散。
4 讨论
在体灌流方法主要包括在体单向肠灌流和在体循环肠灌流,在体循环肠灌流因灌流时间长和灌流速度较大,对肠黏膜的损伤较大;单向灌流的灌流速度接近体内肠道的环境,吸收速率稳定,与人体有良好的相关性。Parvin等[7]给出了大鼠与人体的Peff相关性计算公式:Peff,human=11.04Peff,rat-0.0003(cm·s-1),根据该计算公式,栀子大黄汤中的栀子苷、柚皮苷、橙皮苷和新橙皮苷在人体空肠的Peff分别约为2.94×10-5cm·s-1、2.52×10-4cm·s-1、1.60× 10-3cm·s-1、1.82×10-4cm·s-1。
单向灌流实验表明,4种特征成分的主要吸收部位为小肠上段,推测可能是因为4种物质均含有多个羟基和/或酚羟基,具有弱酸性,小肠上段的pH相对较低,药物多以非解离型存在,较易透过小肠黏膜从而使其吸收较大。肠上皮细胞腔侧面膜中含有P-糖蛋白(P-gp),可以将已经吸收入肠上皮细胞的药物转运回肠腔,从而降低口服药物的生物利用度。橙皮苷在不同浓度下的Ka有显著差异,可能是由于P-gp参与其肠道吸收的原因。研究表明,P-gp在肠道的吸收具有明显的剂量依赖性[8],低剂量给药时,P-gp对药物的外排作用很大;高剂量下,P-gp介导的分泌转运达到饱和,导致药物吸收增加。本研究中提示,橙皮苷可能是受到P-gp外排作用的影响。此外,Valenzuela[9]、Takara[10]等均指出大鼠肠道内P-gp的水平自近端(近幽门)至远端(回盲管)逐渐升高,且在结肠也有明显的表达,因此推测橙皮苷在十二指肠段和空肠段的吸收显著大于回肠段和结肠段,可能与P-gp在不同肠段的表达水平有关,但要确定橙皮苷是否为P-gp底物,还有待进一步研究。
[1] Wang H,Feng F,Zhuang BY,et al.Evaluation of hepatoprotective effect of Zhi-Zi-Da-Huang decoction and its two fractions against acute alcohol-induced liver injury in rats[J].J Ethnopharmacol,2009,126(2): 273-9.
[2] Kim JS,Mitchell S,Kijek P,et al.The suitability of an in situ perfusion model for permeability determinations:utility for BCS Class I biowaiver requests[J].Mol Pharm,2006,3(6):686-94.
[3] Dahan A,West BT,Amidon GL.Segmental-dependent membrane permeability along the intestine following oral drug administration:Evaluation of a triple singlepass intestinal perfusion(TSPIP)approach in the rat[J].Eur J Pharm Sci,2009,36(2-3):320-9.
[4] Varma MV,Panchagnula R.Prediction ofin vivointestinal absorption enhancement on p-glycoprotein inhibition,from rat in situ permeability[J].J Pharm Sci, 2005,94(8):1694-704.
[5] Escribano E,Sala XG,Salamanca J,et al.Single-pass intestinal perfusion to establish the intestinal permeability of model drugs in mouse[J].Inter J Pharm, 2012,436(1-2):472-7.
[6] Fagerholm U,Johansson M,Lennernäs H.Comparison between permeability coefficients in rat and human jejunum[J].Pharm Res,1996,13(9):1336-42.
[7] Zakeri-Milani P,Valizadeh H,Tajerzadeh H,et al. Predictinghumanintestinal permeabilityusingsingle pass intestinal perfusion in rat[J].J Pharm Pharm Sci, 2007,10(3):368-79.
[8] 贺云霞,孙进,程刚.多药耐药性P-糖蛋白在药物肠道吸收中的作用[J].沈阳药科大学学报,2004,21(5):389-93.
[9] Valanzuela B,Nácher A,Ruiz-Carretero P,et al.Profile of P-glycoproten distribution in the rat and its possible influence on the salbutamol intestinal absorption process[J].J Pharm Sci,2004,93(6):1641-8.
[10] Takara K,Ohnishi N,Horibe S,et al.Expression profiles of drug metabolizing enzyme CYP3A and drug effluxtransportermultidrugresistance1subfamily mRNAs in rat small intestine[J].Drug Metab Dispos, 2003,31(10):1235-9.
Intestinal Absorption Studies of the Active Components in Zhi-Zi-Da-Huang Decoction*
LI Yun1,LANG Qiao-ling1,FENG Fang1,2**,SHI Qing-shui3
1Department of Pharmaceutical Analysis;2Key Laboratory of Drug Quality Control and Pharmacovigilance, China Pharmaceutical University,Nanjing 210009;3Jiangsu Institute of Food and Drug Control,Nanjing 210008,China
Objective:To study thein vivointestinal absorption kinetics of geniposide(GE),naringin (NA),hesperidin(HE)and neohesperdin(NE)in Zhi-Zi-Da-Huang Decoction(ZZDHD).Methods:The in situ single-pass perfusion gravimetric method was adopted to investigate the influence of absorption site and drug concentration on the rat intestinal absorption.The HPLC was used to measure the contents of GE, NA,HE and NE.Results:For GE,NA and NE,their absorption parameters,theKaandPeff,in the small intestines were significantly different from those in the colon(P<0.05);the absorption of HE decreased significantly in ileum and colon than in duodenum and jejunum(P<0.05).Within a certain range of concentration,GE,NA and NE had no significant variation ofKaandPeff(P>0.05),while the absorption of HE first increased and then decreased with the increase of drug concentration(P<0.05).Conclusion:The four active components in ZZDHD could be absorbed in the whole intestinal canal of rats.The absorption of GE,NA and NE in rat intestine appeared to be by the passive diffusion mechanism while that of the HE was prelimnarily determined to be by an active transport or facilitated diffusion mechanism.
Zhi-Zi-Da-Huang Decoction;Active components;In situ single-pass perfusion;HPLC
R965
A
1673-7806(2014)03-197-04
国家自然科学基金项目(No.81274063)
李允,女,硕士生 E-mail:liyun9002@163.com
**通讯作者 冯芳,女,教授 E-mail:fengfangl@163.com
2014-02-19
2014-03-05
