2014年2月CDE受理药品评介
2014-04-30苏红
苏红
中国医药工业信息中心,上海 200040
2014年2月CDE受理药品评介
苏红
中国医药工业信息中心,上海 200040
2014年2月,CDE共受理药品申请537件,其中,新药申请146件,仿制申请100件,进口申请42件,新药申请件数已超过仿制申请。具体详见图1、表1。
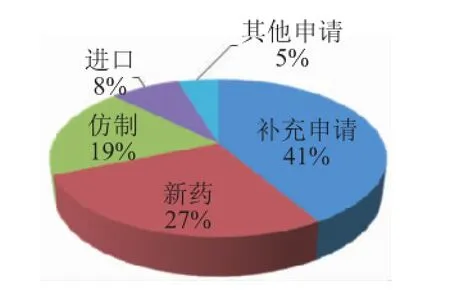
图1 2014年2月CDE受理药品申请类型分布
1 类新药简介
注册分类为1类的新药申报均为新药临床申请,其中,化学药品有8个品种,生物制品有6个品种。生物制品中有4个品种均为疫苗,针对H7N9,共有2个疫苗和1个治疗用抗体药物,体现了国内制药企业针对流行病学而开展新药研发的及时性。
根据CPM数据库,申报的1类化药新药中,丙酮酸钠之前曾由美国Emphycorp开发,将0.5~5 mmol·L-1丙酮酸钠溶解于0.9%氯化钠溶液,雾化后用于治疗哮喘、COPD和囊性纤维化,但由于2期临床结果不理想而终止研发。另一个药物吡非尼酮,2008年12月首次在日本上市,用于预防和治疗突发性肺纤维化,此外,前期研究表明吡非尼酮可能会对多发性硬化症和风湿性关节炎有效,睿星基因所申报的新适应症还并不明确。
DP-VPA由爱尔兰D-Pharm研发,目前处于2期临床,恩华药业获得该药在中国的开发权。F573则是双肽小分子可逆caspase抑制剂,由Immune制药研发,目前还处于临床前研究。
浙江华阳药业申报的注射用重组艾塞那肽-人血清白蛋白融合蛋白(酵母菌)是通过将艾塞那肽与白蛋白融合,从而提高艾塞那肽的半衰期,在此之前,2012年4月派格生物医药(苏州)有限公司已申报聚乙二醇艾塞那肽缓释微球,2013年1月扬子江药业集团北京海燕药业有限公司已申报重组Exendin-4注射液,国内制药企业围绕Exendin-4已经有3个1类新药申报。

表1 2014年2月CDE受理的1类新药临床申请
化药新药主要品种
去除进口申请、进口再注册、复审和补充申请,2012年2月CDE受理的化学药品申请共计224件,其中,新药申请共124件,化学药品新药申请件数占新药申请总数的85%。具体详见图2、表2。

图2 化学药品申请类型分布
化学药品申请中,6类仿制申请约占45%,而3类新药申请件数已经增至申请总数的41%。由于药物审评周期的延长、研发成本的上升、仿制药一致性评价等影响,仿制药的投入与产出比已大不如前,预计今后仿制药的申请占比会进一步降低。
从2月份的申请情况看,骨骼与肌肉用药领域,自2009年美国FDA批准布洛芬注射剂型用于疼痛和发热的治疗,布洛芬注射剂实际已有多家申请;对乙酰氨基酚注射液已有国产药品,规格为1 mL或2 mL,肌肉注射给药,此次以3.3类申请应该是大输液。
精神障碍用药、抗肿瘤药和消化系统用药分别有多个3.1类品种申报,其中,阿戈美拉汀片、鲁拉西酮片、阿塞那平舌下片、阿比特龙片等已有进口申请在前,除阿塞那平舌下片外,这些品种的国内新药申报非常多。
组蛋白去乙酰化酶抑制剂伏立诺他结构式相对简单,江苏正大天晴在伏立诺他首获批准后就跟进申报,已拿到临床批件,是该品种研发进度最为领先的,后续跟进这个品种的制药企业有10余家,包括浙江贝达。
泊马度胺胶囊的首家申请企业为江苏豪森,先声制药紧随其后,不过在2013年年底也有了进口申请,到目前为止奥赛康和华威医药也加入了该品种的申报行列。
博舒替尼是2012年9月获美国FDA批准上市的,目前仅有天津汉康申报,实际上,替尼类药物的国内1类新药申请要多于3.1类申请。
止吐药福沙匹坦二甲葡胺注射液已有多家企业申报,均处于在审评阶段。而甘油磷酰胆碱申报企业不多,这个药最早于1990年在意大利上市,作为促智药,用于失忆症及年龄相关的记忆,该药还在韩国、俄罗斯、阿根廷和希腊等国上市。促智药在我国销售火热已不是秘密,随着老龄化社会的到来,这类药品市场前景看好。甘油磷酰胆碱尚未在美国和欧洲的几个主要国家上市,且上市时间较早,可能申报存在一定风险。
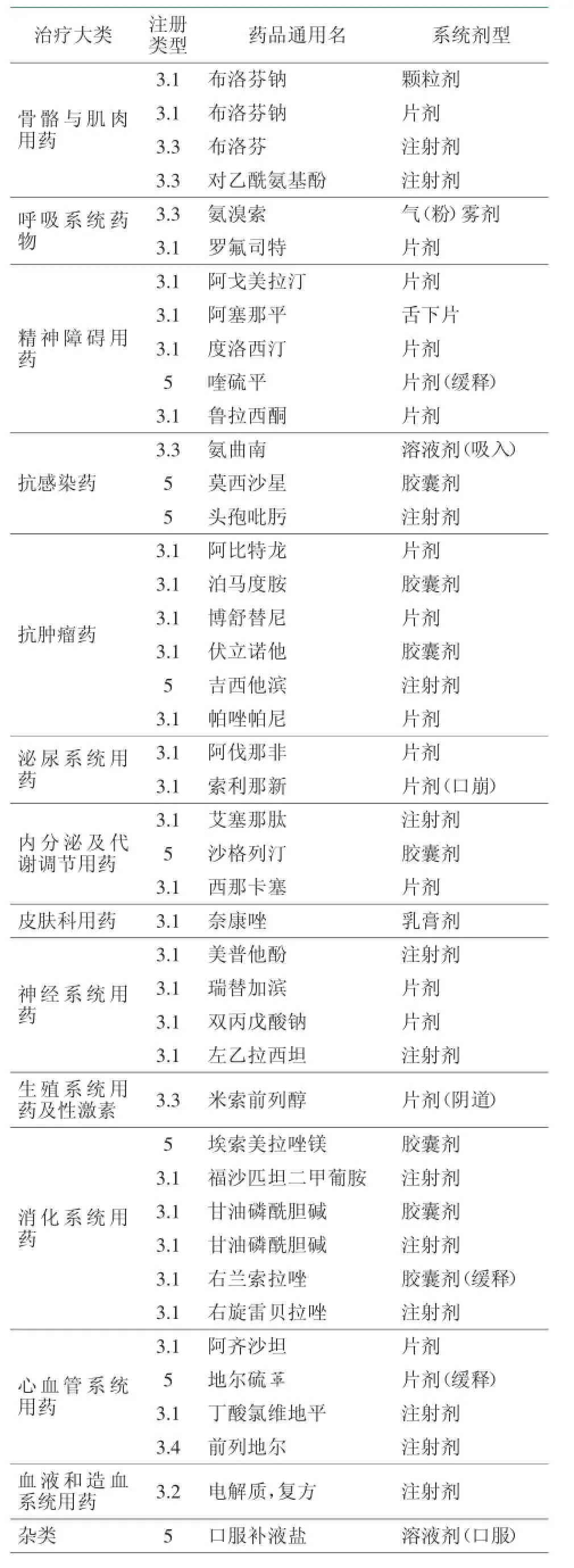
表2 2014年2月申报的主要化药新药
