缺血性脑卒中治疗时间窗的创新药物研究进展*
2014-04-30林红军方伟蓉李运曼
林红军,方伟蓉,李运曼
中国药科大学生理教研室,南京 210009
缺血性脑卒中治疗时间窗的创新药物研究进展*
林红军,方伟蓉,李运曼**
中国药科大学生理教研室,南京 210009
缺血性脑卒中发作后,一定时间内可以通过治疗减轻脑损伤的程度、促进机能恢复、改善长期预后,这个允许的时间称为治疗时间窗。它与缺血半暗带的转归密切相关,PAF受体拮抗剂、以TXA2为靶点的药物及药物联合应用等可以延缓或逆转缺血半暗带损伤,有助于延长时间窗。本文综述了脑缺血半暗带的发病机制及近5年来抗缺血性脑卒中治疗时间窗的药物研究进展,以期为临床用药提供可靠的理论依据。
缺血性脑卒中;治疗时间窗;缺血半暗带;研究进展
1977年Abtrup等[1]提出脑缺血半暗带的概念,即围绕着梗死中心的缺血脑组织,其电活动停止、但结构仍保持完整且其损伤具有可逆性。由半暗带概念引伸出的“治疗时间窗”概念,也成为脑缺血/再灌注(ischemic/reperfusion,I/R)损伤和脑保护研究的热点。脑卒中患者的治疗效果与治疗时间窗紧密相关,近年来国际中风治疗临床前研究指南(STAIR)也将更多的精力用于时间窗的研究[2],国内外对治疗缺血性脑卒中药物的研究也多重视时间窗。药物延缓了缺血半暗带的损伤也就是延长了治疗的时间窗,目前保护缺血半暗带的研究主要集中在血小板活化因子(platelet activating factor,PAF)受体拮抗剂、血栓烷A2(thromboxane A2,TXA2)为靶点的药物、自由基清除剂、抑制钙超载以及药物的联合应用等。本文对缺血性脑卒中治疗时间窗研究进行综述,以便从中发现适于临床的治疗药物,并为以后药物的开发及临床合理用药指明方向。
1 缺血半暗带与时间窗的关系
1.1 缺血半暗带的产生及其意义
脑缺血发生后,从空间来看,缺血中心部(ischemic core)的血流完全中断,因而立即出现不可逆损害。虽然其周围呈现出机能上的障碍,电活动亦停止,但形态学上尚保持完整,即存在可挽救的组织缺血半暗带(ischemic penumbra)。及时恢复适量的血流或采用有效的药物治疗,可逆转缺血脑组织的损伤,否则将转变为实质性不可逆性损伤[3]。另外,即使缺血中心部无血液的再灌注,但通过各种神经保护疗法亦可能得以挽救,因而它是急性缺血性脑卒中治疗的关键。
1.2 缺血半暗带的转归与治疗时间窗的关系
Pulsinelli认为在脑缺血发作后,一定时间内可以通过治疗减轻脑损伤的程度、促进机能恢复、改善长期的效果,这个允许的时间称为治疗时间窗[4]。即病态及与之对应的治疗方法的种类决定了治疗时间窗的存在。所以时间窗的长短与缺血半暗带的损伤和治疗方法有关。
缺血半暗带易遭受的损伤有兴奋性神经毒性、钙离子超载、炎症损伤、氧化应激等,针对缺血半暗带的损伤节点寻找关键的治疗靶点和有效的治疗药物可以延长治疗时间窗。最新的研究热点(如图1)主要有:(1)通过抑制PAF受体来抑制PAF活化引起的血栓形成和炎症反应;(2)通过抑制环氧化酶(cyclooxygenase,COX)和血栓烷合酶(thromboxane synthase,TXS)来抑制TXA2生成;(3)通过抑制谷氨酸受体(glutamate receptors,GluR)和激活钠钙交换器(sodium calcium exchanger,NCX)抑制细胞内Ca2+超载;(4)抗氧化剂清除脑缺血半暗带自由基;(5)联合用药。以上5种途径均可以延缓这些病态的进展,延长治疗时间窗。
2 最新的延长时间窗的创新药物
2.1 PAF受体拮抗剂
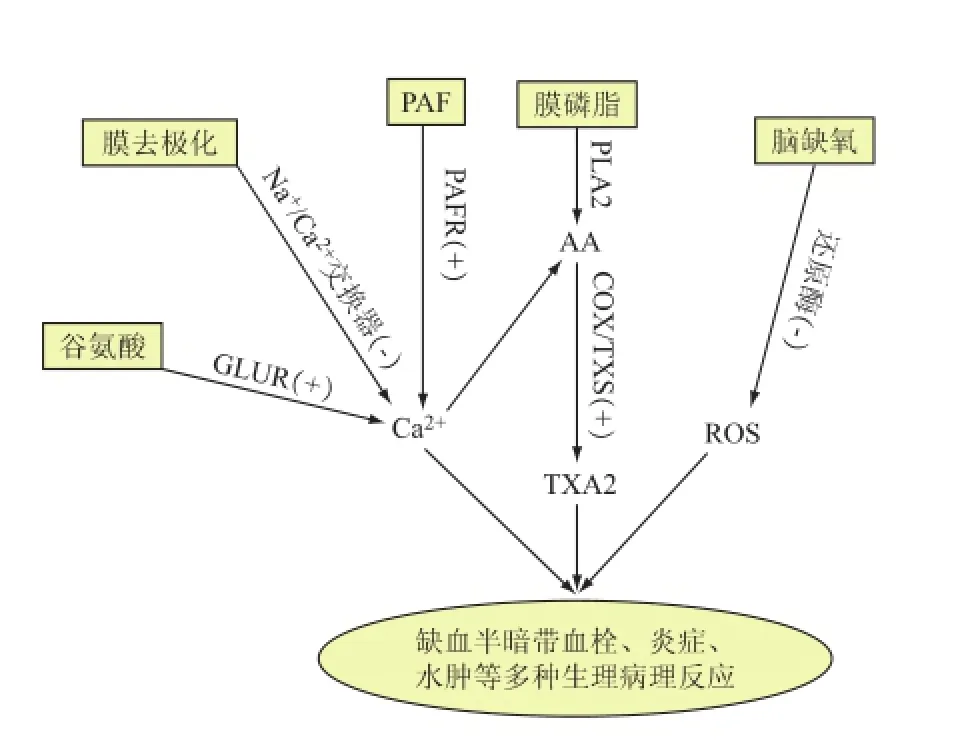
图1 药物调控缺血半暗带转归的主要靶点
血小板活化因子具有显著的诱导血小板聚集作用,促进血栓形成,引发缺血性脑卒中;同时也是脑缺血后出现的主要炎症介质,它发挥生物学活性是通过与细胞、组织中的PAF受体结合而实现的[5]。PAF与受体结合后的细胞内信号转导可能有以下通路[6]:(1)通过G蛋白转导激活磷脂酶C(PLCβ),产生二酰甘油(DAG)和三磷酸肌醇(IP3),DAG激活蛋白激酶C(PKC),再激活转录因子NF-κB等,IP3诱导细胞内Ca2+浓度升高,最终产生花生四烯酸(arachidonic acid,AA),AA也可以在环加氧酶和血栓烷合酶作用下产生TXA2;(2)通过G蛋白转导活化腺苷环化酶(AC),第二信使cAMP激活蛋白激酶A(PKA),介导血小板聚集、炎症反应、活性氧产生;(3)通过直接或间接方式激活酪氨酸蛋白激酶(PTK),再活化磷脂酶D(PLD)、PLCγ、磷脂酰肌醇-3激酶(PI-3K)及丝裂原激活的蛋白激酶(MAPK)。在缺血性脑损伤中,PAF是重要的病理损伤因子,也是药物治疗的关键靶点,因此,PAF受体拮抗剂有望成为治疗脑缺血的有效药物。
2.1.1 银杏内酯B银杏内酯B(结构式见图2)为天然的PAF受体拮抗剂,是从银杏叶中提取的一种萜内酯,能通过血脑屏障。动物实验结果表明,脑缺血再灌注0.5 h、1 h、2 h后均可以显著减少脑水肿与梗死面积,增加脑血流,改善神经功能评分,可能是通过抑制细胞内钙超载、下调iNOS、细胞间粘附分子(ICAM-1)及间质金属蛋白酶MMP-9的表达,保护血脑屏障;通过增强组织中自由基清除能力,抑制脂质过氧化反应,增加Na+-K+-ATP酶的释放,从而减轻脑部损伤,最佳治疗时间窗可以持续到缺血后4 h[7-8]。这些结果表明,银杏内酯B的治疗时间窗较宽,有益于其临床应用。

图2 银杏内酯B的化学结构
2.1.2 LAU-0901LAU-0901(结构式见图3)是一种高度有效的和选择性的PAF受体拮抗剂,在大鼠中脑动脉闭塞(middle cerebral artery occlusion,MCAO)后2 h给药仍能提供神经保护,减小脑梗死面积和脑水肿,减弱小胶质细胞浸润,并促进星形胶质细胞和神经元的存活[9]。
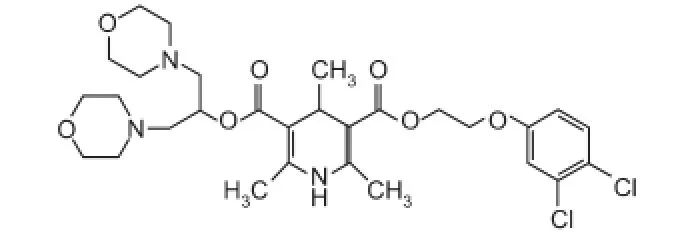
图3 LAU-0901的化学结构
目前银杏叶提取物金纳多已经进入临床用于治疗急性脑梗死[10]。还有大量的天然的PAF受体拮抗剂等待进一步研究,如α-bulnesene、穿心莲内酯、cedrol、L-652、469/tussilagone、manolide等;还有大量的植物浸膏作为PAF受体拮抗剂,如苦味叶下株的正己烷提取物、高良姜的醚提取物等。这些药物都比合成的药物如阿司匹林有更小的毒性、更少的副作用[11]。PAF受体拮抗剂都有较长的时间窗,并且这些药物作用于人的时间窗显著长于动物模型的时间窗[12]。大量的PAF受体拮抗剂为临床发现长时间窗的治疗药物提供可能。
2.2 TXA2为靶点的药物
TXA2具有强烈的血小板聚集和缩血管作用,参与血栓形成并调节血管张力,是潜在的治疗缺血性脑卒中靶点。当脑缺血发生时,AA代谢途径被激活,导致TXA2过量生成,加重缺血性脑卒中损伤[13]。使用药物干预TXA2的生成能达到防治缺血性脑卒中的作用。TXA2的生成依赖COX和TXS。所以,目前以TXA2为作用靶点的治疗脑缺血药物主要是COX抑制剂和TXS抑制剂。
2.2.1 COX抑制剂阿司匹林可以抑制COX的活性,减少TXA2的生成,达到抑制血小板聚集形成血栓的作用。在脑缺血后,经腹腔注射给予阿司匹林1次,其有效治疗时间窗可延长到2 h,或在缺血前30 min给药有效[14]。近期有报道称,最晚在脑卒中发生后6 h给予阿司匹林能减轻脑损伤,但需在随后多次脑卒中发病后重复给药。因此,尽早使用阿司匹林对于降低脑卒中危害有重要的作用。目前临床上阿司匹林一般作为缺血性脑卒中二级预防的首选药物,可以低剂量长期或终生用药,能在一定程度上降低脑卒中的复发,但因阿司匹林具有阿司匹林抵抗现象、且病人在规律服用治疗剂量阿司匹林的情况下,仍有心脑血管事件和严重的胃肠道不良反应发生[15],大剂量有胃肠道出血的风险,这些都不利于脑卒中的治疗。
2.2.2 TXS抑制剂TXS是生物合成TXA2的另一个关键酶,可以抑制前列腺素H2(prostaglandin H2,PGH2)向TXA2的转化。TXS抑制剂的开发主要集中于20世纪80~90年代,包括奥扎格雷(OKY-046)、呋格雷酸(U63557A)、达唑氧苯(UK37248)、伊波格雷(CV4151)[16]等。临床上主要应用的是奥扎格雷,其治疗时间窗少于1 h[17],需要与其他药物如肝素、氯沙坦等合用。近年来TXS抑制剂的研发进展并不快,其较窄的治疗时间窗和出血副作用限制了其在临床上的应用。
由此可见,TXA2为靶点的药物具有治疗时间窗较窄、副作用较多的缺点,需要尽早用药或者联合其他药物才能有效治疗缺血性脑卒中。
2.3 抑制细胞内钙超载的药物
脑缺血后谷氨酸大量产生,介导谷氨酸受体主要为N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体的过度激活,导致Ca2+和Na+内流,细胞内Ca2+超载,继而引发细胞水肿,神经元受损。另外,突触后致密物-95(postsynaptic density-95,PSD-95)是定位在后突触膜下的一种特殊结构,通过PSD-95可造成NMDA受体与第二信使的连接,促进兴奋性毒性的传递,造成神经元型一氧化氮合酶(nNOS)的激活和NO的生成,当NO释放后,进一步引起O2°、ONOO°、OH°等氧自由基的产生[18-19],这些活性自由基往往会成为线粒体损伤的诱因。除此之外,脑缺血后脑内ATP大量消耗造成Na+/K+泵失活和膜去极化,从而使钠钙交换器(sodium calcium exchanger,NCX)受到抑制,从而导致神经元细胞内钙超载,线粒体破坏释放细胞色素C,诱导细胞凋亡[20]。因此抑制谷氨酸中毒的药物主要有NMDA受体拮抗剂和促进钠钙交换器的药物。
2.3.1 NMDA受体拮抗剂硫酸镁抑制NMDA受体以及电压依赖性钙通道。在动物模型和小规模的临床实验中发现其具有一定潜力的神经保护作用,然而当前临床研究表明,即使静脉给予硫酸镁的量已经超过了神经保护的剂量,但仍然对脑卒中病人的治疗效果并不理想,需要进一步的临床研究。其3期临床试验招募了1700名脑卒中患者,15 min内静脉给予4 g硫酸镁,再在后续的24 h中给予维持剂量16 g,以确定其治疗效果、用药剂量、疗程和最佳治疗时机,研究结果尚未公布[21]。
厚朴酚(结构见图4-左)对抗大鼠永久性脑缺血,通过减弱谷氨酸和NMDA介导的神经毒性,减弱谷氨酸介导的Ca2+内流和神经元肿胀而起到神经保护作用,在4 h内减小梗死体积、改善神经功能[22]。和厚朴酚(结构见图4-右)则通过抑制NMDA受体介导PSD95-nNOS通路减少NO的释放,也能抑制nNOS从细胞质易位到细胞膜,但不影响细胞内总的nNOS表达,这样细胞质内nNOS表达量增多而膜上的nNOS表达量减少,可以显著降低NO在皮质神经元的生成,抑制NO产物介导的神经毒性,其治疗时间窗达到缺血后5 h[18-19]。
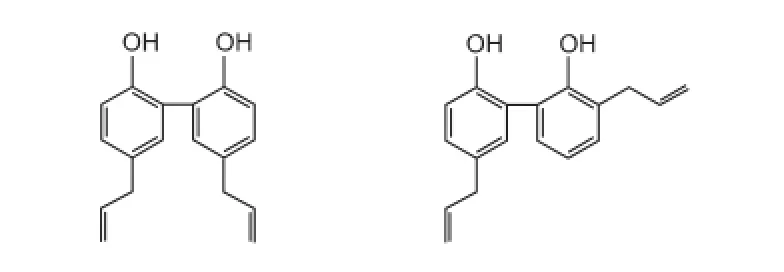
图4 厚朴酚(左)与和厚朴酚结构(右)的化学结构
2.3.2 调节钠钙交换器的药物钠钙交换器(NCX)是心肌细胞膜上的一种跨膜离子通道,其本质是一种膜蛋白,根据基因编码的不同分为3种亚基:NCX1、NCX2和NCX3。NCX对神经元细胞内外的钠、钙离子的交换在维持神经元内外钙离子的平衡中发挥重要作用。缺血性脑卒中发作后钠钙交换器的基因表达显著抑制,细胞内钙离子超载,实验动物研究表明,永久性脑缺血后,脑缺血部位三个转录体均被下调90%左右[20]。
作用于NCX的药物很少,最新研究发现,前列腺素E2EP1型受体拮抗剂SC51089(结构见图5)通过促进NCX减少细胞内Ca2+积累并介导pkB/Akt的磷酸化,减少线粒体移位,从而抑制神经细胞凋亡[23],在脑卒中发作后12 h仍有很好的疗效,减小永久性大鼠脑缺血模型的梗死面积、改善神经系统、改善缺血后的体温、动脉血压和脑血流。
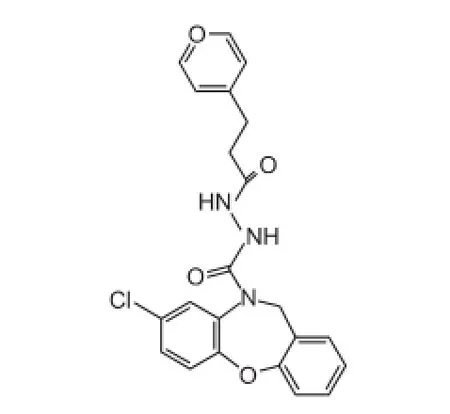
图5 SC51089的化学结构
NMDA受体拮抗剂在动物体上有一定的疗效,但临床研究发现其治疗时间窗很窄,直接抑制NMDA受体和nNOS会引起强烈副作用,如严重的精神病样不良反应、运动障碍、认知障碍等[24]。NCX在心肌缺血方面研究的较早,但在脑缺血方面则处于刚起步的阶段,其对缺血半暗带的影响有待进一步研究。
2.4 抑制氧化应激的药物
当前研究表明,氧化应激是缺血再灌注的必然结果,可以通过脂质过氧化、蛋白质变性或DNA的修饰等途径促使神经细胞坏死,也可以通过线粒体、内质网或死亡受体等途径启动神经细胞凋亡。临床上主要采用抗氧化治疗,使用的抗氧化剂主要通过清除自由基、抑制脂质过氧化而发挥神经保护作用。
2.4.1 依达拉奉依达拉奉是一种自由基清除剂,容易通过血脑屏障,可以抑制脑细胞的过氧化作用,有效地提高大鼠局灶性脑缺血时脑组织中超氧化物歧化酶(SOD)的活力,降低丙二醛(MDA)的水平,并且有效抑制caspase-3表达,对抗神经细胞凋亡,目前在日本广泛地应用于治疗急性缺血性脑卒中。临床数据表明,在缺血后72 h内给药能显著地减少患者脑梗死体积,而且在给药后3个月内都有神经保护作用[25]。但依达拉奉治疗时间窗较窄,需要在卒中发作后立即给药[26]。
2.4.2 依布硒啉依布硒啉(ebselen)通过抑制脂质过氧化,抑制大脑皮质诱导型iNOS蛋白的表达起到抗氧化作用。其3期临床以48 h内的脑卒中患者作为研究对象,发现其对24 h内的患者有较好的疗效,但超过24 h则效果不好。目前,依布硒啉对大脑皮质梗死患者疗效的研究仍在进行中[27]。
2.4.3 SUN-N8075SUN-N8075(结构见图6)由日本Asubio公司合成,是一种具有神经保护特性的自由基清除剂。它还具有T-型钙通道及钠通道阻滞作用,其1期临床研究正在美国进行中[28]。
图6 SUN-N8075的化学结构
2.4.4 川芎提取物川芎嗪和四乙基吡嗪(TMP)都是中国传统中药川芎的重要提取物,它们能通过血脑屏障。硫氧还原蛋白(thioredoxin,Trx)在清除氧化产物方面起着重要作用。脑缺血后Trx-1/Trx-2和TrxR-1/TrxR-2的表达被显著抑制,然而TMP能够提高它们的表达,通过降低硫氧还原蛋白的表达,大大提升Trx-1/2 mRNA和Trx还原酶1/2 mRNA的表达,清除活性氧达到细胞保护作用,降低脑缺血大鼠神经功能缺陷评分,减小梗死面积等缺血再灌注损伤,也可以通过上调Trx表达抑制神经细胞凋亡[29-30]。研究结果表明,其治疗时间窗为脑缺血后4 h。
抗氧化治疗能一定程度地减轻脑缺血半暗带的损伤,但效果并不理想,且不能成为临床上的常规治疗手段,主要原因是目前对氧化应激的机制尚未完全阐明,抗氧化剂缺乏特异性。因此阐明氧化应激的分子机制,对于寻找高特异性治疗时间窗较长的新型抗氧化剂具有重要意义。
2.5 药物联合应用
药物联合应用是脑缺血脑卒中药物研究的热点,缺血性脑卒中的病理生理机制极为复杂,涉及兴奋性神经毒性、氧化损伤、炎症反应、Ca2+超负荷、渗透效应等多元机制,常常引起严重的缺血、缺氧性脑损伤及一些并发症,因此单一用药或者用一种方法也许并不会对治疗缺血性脑损伤有明显效果,要考虑联合用药,或使用多种治疗手段相结合。主要为神经保护药和组织纤溶酶原激活物(tissue plasminogen activator,tPA)的联合应用,因为tPA在临床上单独使用具有时间窗窄、出血副反应概率高以及神经毒性等副作用,神经保护剂可以保护溶栓治疗造成的再灌注损伤。
2.5.1 尿酸尿酸(uric acid)是一种良好的自由基清除剂,在动物模型中和2期临床研究中已被证明是安全有效的。其3期临床已于2011年6月开始,以评估尿酸和tPA联合用药比单独使用tPA在4.5 h的时间窗内对脑卒中有更好的疗效,结果将于近期公布[31]。
2.5.2 米诺环素联合tPA米诺环素(minocycline)是一种广谱抗菌的四环素类抗生素,对人体安全无毒且耐受性较好。与tPA联合应用没有副作用,并且降低tPA溶栓后复灌引起的出血率、抑制基质金属蛋白酶,延长tPA的治疗时间窗[32]。
2.5.3 其他药物联合tPA研究显示外源的牛磺酸能显著减小梗死面积,改善脑卒中动物模型的神经功能评分。牛磺酸能促进尿激酶溶栓治疗和对再灌注具有神经保护作用。联合用药治疗时间窗可以达到8 h[33]。依达拉奉与tPA联合用药也可以在4.5~9 h内静脉溶栓治疗脑梗死[34]。
药物联合应用已经取得了很好的效果,提高了药物的疗效,减少了副作用,延长了药物治疗时间窗,具有很好的前景。
3 展望
脑缺血后,核心梗死区往往无法逆转,缺血半暗带为治疗缺血脑卒中提供可能,延缓其损伤可以延长治疗时间窗。今后应加强逆转缺血半暗带的机制研究,发现新的有效的延缓缺血半暗带损伤的靶点及药物,有助于延长治疗时间窗。
PAF受体是新型的抗缺血性脑卒中药物治疗靶点,且天然的PAF受体拮抗剂来源较广、副作用较少,将为临床提供更多的长时间窗的治疗药物。其抗炎、抗氧化、抑制血小板聚集的作用可以减少溶栓治疗再灌注后的损伤,具有延长溶栓药治疗时间窗的潜力。另外药物的协同作用比单一用药的时间窗显著延长,神经保护药物和tPA的联合应用可以延长治疗tPA的时间窗或在时间窗内具有更好的治疗效果;也可以考虑两个作用机制不同的药物协同作用,例如低剂量的阿司匹林联合奥扎格雷可以通过不同的机制抑制TXA2合成和促进PGI2形成[35],具有更好地抗血栓作用,延长溶栓治疗的时间窗。药物的联合应用对于缺血脑卒中的治疗具有更好的疗效,应该成为今后研究的重点,并且认为,药物详实的时间窗研究,有助于临床上采用多靶点且有效治疗时间窗不同的药物,针对不同阶段的不同病理环节,采用综合调控,可许成为治疗缺血脑卒中的一条可行之路。
[1] Astrup J,Siesjö BK,Symon L.Thresholds in cerebral ischemia-the ischemic penumbra[J].Stroke,1981,12(6): 723-5.
[2] Fisher M,Feuerstein G,Howells DW,et al.Update of the stroke therapy academic industry roundtable preclinical recommendations[J].Stroke,2009,40(6):2244-50.
[3] Candelario JE,Gonzalez-Falcon A,Garcia-Cabrera M, et al.Post-ischaemic treatment with the cyclooxygenase-2 inhibitor nimesulide reduces blood-brain barrier disruption and leukocyte infiltration following transient focal cerebral ischaemia in rats[J].J Neurochem,2007, 100(4):1108-20.
[4] Pulsinelli WA.The therapeutic window inischemic brain injury[J].Curr Opin Neurol,1995,8(1):3-5.
[5] Marianna MK,Bruna B,Anderson SN,et al.Activation ofPAF-receptorinducesregulatorydendriticcells through PGE2 and IL-10[J].Prostag Leukotr Ess,2013, 89(5):319-26.
[6] Ishii S,Nagase T,Shimizu T.Platelet-activating factor receptor[J].Prostag Oth Lipid M,2002,68-69:599-609.
[7] Sun J,Li YM,Fang WR,et al.Therapeutic time window for treatment of focal cerebral ischemia reperfusion injury with XQ-1h in rats[J].Eur J Pharmacol,2011, 666(1):105-10.
[8] Fang WR,Deng Y,Li YM,et al.Blood brain barrier permeability and therapeutic time window of Ginkgolide B in ischemia-reperfusion injury[J].Eur J Pharm Sci, 2010,39(1):8-14.
[9] Ludmila B,Tiffany NE,Larissa K,et al.Superior neuroprotective efficacy of LAU-0901,a novel platelet-activatingfactorantagonist,inexperimentalstroke[J].Transl Stroke Res,2012,3(1):154-63.
[10] 郭建,杨涛.金纳多注射液治疗急性脑梗死临床研究[J].中医学报,2013,28(187):1895-6.
[11] Singh P,Singh IN,Mondal SC,et al.Platelet-activating factor(PAF)-antagonists of natural origin[J].Fitoterapia,2013,84:180-201.
[12] Ginsberg MD.Neuroprotection for ischemic stroke:past present and future[J].Neuropharmacology,2008,55(3): 363-89.
[13] Rink C,Khanna S.Significance of brain tissue oxygenation and the arachidonic acid cascade in stroke[J].Antioxid Redox Sign,2011,10(14):1889-903.
[14] KimSW,JeongJY,KimHJ,et al.Combination treatment with ethyl pyruvate and aspirin enhances neuroprotection in the post-ischemic brain[J].Neurotox Res,2010,17(1):39-49.
[15] Yi XY,Zhou Q,Lin J,et al.Aspirin resistance in Chinese stroke patients increased the rate of recurrent stroke and other vascular events[J].Int J Stroke,2013, 8(7):535-9.
[16] Norimichi N.Thromboxane A2:physiology/pathophysiology,cellular signal transduction and pharmacology[J].Pharmacol Therapeut,2008,118(1):18-35.
[17] Arii K,Igarashi H,Atii T,et al.The effect of ozagrel sodium on photochemical thrombosis in rat:therapeutic window and combined therapy with heparin sodium[J].Life Sci,2002,71(25):2983-94.
[18] Lai TW,Shyu WC,Wang Y T.Stroke intervention pathways:NMDA receptors and beyond[J].Trends Mol Med,2011,17,(5):266-75.
[19] Hua ZY,Bian XL,Liu XY,et al.Honokiol protects brainagainstischemia-reperfusioninjuryinrats through disrupting PSD95-nNOS interaction[J].Brain Res,2013,1491:204-12.
[20] Giuseppe P,Rossana S,Serenella A,et al.Does Na+/ Ca2+exchanger,NCX,represent a new druggable target in stroke intervention[J].Transl Stroke Res,2014, 5(1):145-55.
[21] Singh H,Jalodia S,Gupta MS,et al.Role of magne-siumsulfateinneuroprotectioninacuteischemic stroke[J].Ann Indian Acad Neurol,2012,15(3):177-80.
[22] Lee WT,Lin MH,Lee EJ,et al.Magnolol reduces glutamate-induced neuronal excitotoxicity and protects against permanent focal cerebral ischemia up to 4 hours[J].PLos One,2012,7(7):e39952.
[23] Abe T,Kunz A,Shimamura M,et al.The neuroprotective effect of prostaglandin E2 EP1 receptor inhibition has a wide therapeutic window,is sustained in time and is not sexually dimorphic[J].J Cerebr Blood F Met,2009,29(1):66-72.
[24] Li Z,Fei L,Xu HB,et al.Treatment of cerebral ischemia by disrupting ischemia-induced interaction of nNOS with PSD-95[J].Nat Med,2011,16(12):1439-43.
[25] Kikuchi K,Uchikado H,Morioka M,et al.Clinical neuroprotective drugs for treatment and prevention of stroke[J].Int J Mol Sci,2012,13(6):7739-61.
[26] Kiyoshi K,Koichi K,Naohisa M,et al.Edaravone:A new therapeutic approach for the treatment of acute stroke[J].Med Hypotheses,2010,75(6):583-5.
[27] Minnerup J,Sutherland BA,Buchan AM,et al.Neuroprotection for stroke:Current status and future perspectives[J].Int J Mol Sci,2012,13(9):11753-72.
[28] Akane M,Shimazawa M,Inokuchi Y,et al.SUN N8075,anovelradicalscavenger,protectsagainst retinal cell death in mice[J].Neurosci Lett,2011,488 (1):87-91.
[29] Zhu XL,Xiong LZ,Wang Q,et al.Therapeutic time windowandmechanismoftetramethylpyrazineon transient focal cerebral ischemia/reperfusion injury in rats[J].Neurosci Lett,2009,449(1):24-7.
[30] Jia J,Zhang X,Hu YS,et al.Protective effect of tetraethyl pyrazine against focal cerebral ischemia/reperfusion injury in rats:therapeutic time window and its mechanism[J].Thromb Res,2009,123(5):727-30.
[31] Amaro S,Cánovas D,Castellanos M,et al.The URICO-ICTUS study,a phase 3 study of combined treatmentwithuricacidandrtPAadministeredintravenously in acute ischaemic stroke patients within the first 4.5 h of onset of symptoms[J].Int J Stroke,2010, 5(4):325-8.
[32] Fagansc SC,Waller JL,Nichols FT,et al.Minocycline to improve neurologic outcome in stroke(MINOS):a dose-finding study[J].Stroke,2010,41(10):2283-7.
[33] Guan WH,Zhao YM,Xu C.A combined treatment with taurine and intra-arterial thrombolysis in an embolic model of stroke in rats:increased neuroprotective efficacyandextendedtherapeutictimewindow[J].Stroke Res,2011,2(1):80-91.
[34] 李欣,李雯,刘凌云.依达拉奉联合rt-PA超时间窗静脉溶栓治疗急性脑梗死的疗效[J].中国老年学杂志,2013,33(14):3287-8.
[35] Gyu HA,Sook YS,Cheol SJ,et al.Thromboxane A2 synthetase inhibitor plus low dose aspirin:can it be a salvage treatment in acute stroke beyond thrombolytic time window[J].J Korean Neurosurg S,2011,50(1): 1-5.
Innovative Drug Research Progress in Therapeutic Time Window for Ischemic Stroke*
LIN Hong-Jun,FANG Wei-rong,LI Yun-Man**
Department of Physiology,China Pharmaceutical University,Nanjing 210009,PR China
After ischemic stroke,there is a period of time called therapeutic time window for reducing the degree of brain injury,promoting the function recovery and improving the long-term outcome.It is closely related to ischemic penumbra outcomes,besides,the application of PAF receptor antagonists,TXA2 targeting drugs or drug combinations can slow or reverse ischemic penumbra damages,which can extend the time window.This paper reviews the mechanism of ischemic penumbra and time window of anti-stroke drug treatment that have been researched for the past five years,which provides more chances for clinical medicine.
Ischemic stroke;Therapeutic time window;Ischemic penumbra;Research progress
R743.3
A
1673-7806(2014)02-134-06
国家自然科学基金项目编号:81202974;江苏省自然科学基金:项目编号:BK2011625
林红军,男,硕士生 E-mail:756291447@qq.com
**通讯作者 李运曼,女,教授,博士生导师,研究方向:心脑血管药理学 E-mail:yucaoren@sina.com
2013-12-30
2014-02-23
