动物胚胎发育中的MicroRNAs研究进展
2014-04-28吴伟伟哈尼克孜石晓雷于丽娟田月珍田可川
吴伟伟,宫 平,哈尼克孜,石晓雷,于丽娟,田月珍,田可川
(新疆畜牧科学院畜牧科学研究所,新疆 乌鲁木齐 830000)
动物胚胎发育中的MicroRNAs研究进展
吴伟伟,宫 平,哈尼克孜,石晓雷,于丽娟,田月珍,田可川*
(新疆畜牧科学院畜牧科学研究所,新疆 乌鲁木齐 830000)
MicroRNA(miRNA)是一类广泛存在于真核生物中的非编码RNA,具有调控功能,长度约有20~25个核苷酸,它通过与靶基因特异性的碱基配对引起靶基因的降解或者抑制其翻译,从而实现对靶基因的转录后表达的调控。文章综述了miRNA的发现、体内生成机制、作用机制及不同动物种类胚胎发育过程中miRNA的鉴定和研究,并并阐述了miRNA研究中的问题及应用前景。
miRNA;动物;胚胎发育;
microRNAs(miRNAs)首先是指非编码RNA,它具有调控功能,且属于内源性,发现于真核生物中,这些小的miRNA通常靶向一个或者多个mRNA,调节基因表达的方式多是断裂靶标mRNAs或抑制翻译水平,这类miRNA长度较小,约有20~25个核苷酸。一部分特异的核酸酶通过剪切加工那些长的初级转录物就产生了成熟的miRNAs,再与RNA诱导产生的沉默复合体组装,运用碱基互补配对的原理对靶mRNA进行识别,而指导复合体阻遏mRNA的翻译或降解靶mRNA则取决于其互补程度的差异。目前研究发现miRNA涉及多个调节途径,如细胞的增值与凋亡、脂肪的生成代谢、组织器官的形成、造血功能、病毒防御及机体的发育等等。
1 miRNA的发现
20世纪90年代,一种存在于线虫体内的不编码蛋白的RNA(lin-4)被lee等人发现[1],这种RNA可生成一对比较小的RNA转录本,两个转录本都能调节线虫幼虫的生长发育情况,其调节方式是在翻译时抑制核蛋白lin-14的表达。研究人员推测可能是lin-4的部分序列与基因lin-14的mRNA的3'UTR区特异性的重复序列存在的序列互补导致了这一现象的产生。研究人员发现启动发育幼虫第二阶段的条件是在第一阶段的末期降低lin-14的表达,在经过七年的研究后,人们找到了另一个miRNA,即let-7,其也能对线虫的生长发育进行条件,类似于lin-4。let-7发现以后,研究人员在许多生物体中发现了miRNAs,主要采用的方式是生物信息学预测及随机克隆和测序。这些被发现的miRNAs被Sanger研究所主办的miRBase网站进行整理注释后公布于众,见图1。

图1 miRNA的生物起源
miRNAs多为长度为21-25nt的双链RNA分子,其具有发卡结构且起源于内源性表达转录本。microRNAs(miRNAs)是一种小的由高等真核生物的基因组编码的类似于siRNA的分子,其控制沉默复合体阻遏mRNA翻译或降解mRNA的方式是运用碱基互补配对的原理对靶mRNA进行配对。miRNAs的表达只存在于某些特殊的组织及发育阶段,可见其保守的物种进化过程,而组织和细胞的特异性功能则取决于miRNA的组织特异性和时序性,证实miRNA调节细胞生长和发育的多样性[2]。
2012年8月1日,SangermicroRNA序列数据库 (miRBase)升级至19.0版。与以往的数据库相比,miRBase19.0更新了大量数据;miRNA发夹前体序列新增3171条,总数升至21264条;成熟miRNA新增3625条,总数升至25141条;miRBase19.0版报道的所有物种新增25个,总数升至193个。并且新版数据库对miRNA序列注释和命名法进行了系统的修正,彻底取消了miR*命名法,而以-5p和-3p的命名法取代之。牛目前有766条前体序列,755条成熟miRNA。绵羊有55条前体序列,103条成熟miRNA。猪有271条前体序列,306条成熟miRNA。见表1、图2。
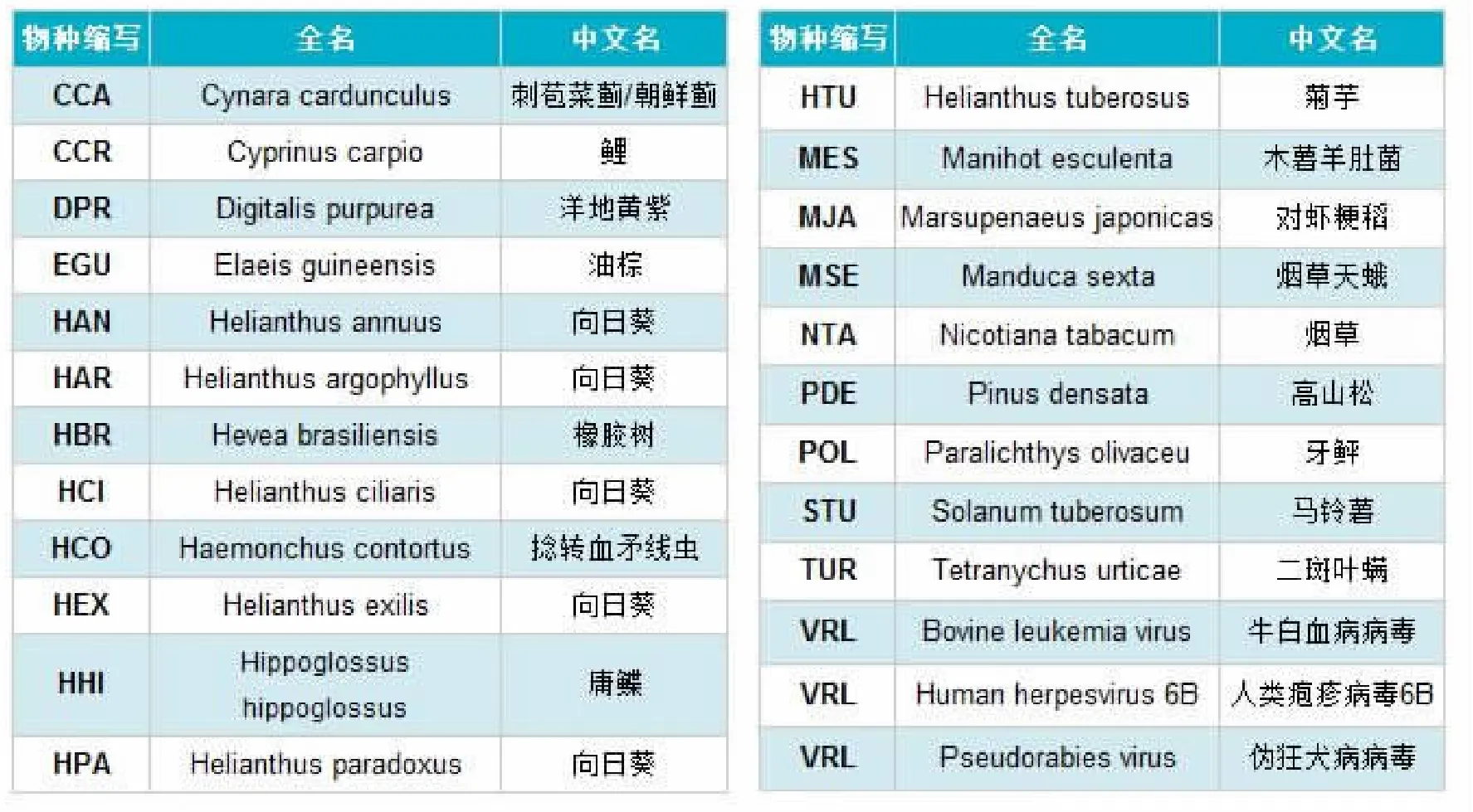
表1 miRbase19.0新增物种列表

图2miRBase数据库相关信息Fig2.TheinformationofmiRBasedatabase
2 miRNA的体内生成机制
定位于生物体基因组上的miRNA编码基因经过转录和加工可获得成熟miRNA。科学家估算认为大约有720种miRNA编码基因存在于人类基因组中,其中的30%包含在蛋白编码基因的内含子中,剩余的70%则位于基因的间隔区。大部分的miRNA编码基因是从和宿主蛋白基因共同转录的基因的内含子中剪切出的,但也有存在于单独的转录单位中的miRNA,不过大多产生于包含miRNA簇的转录本或蛋白编码基因的基因内序列。前人研究认为miRNA的生物发生经历了一个比较复杂的过程:pri-miRNA—pre-miRNA—miRNA双链体 (miRNA:miRNA*)—成熟miRNA—特异性结合到RNA诱导沉默复合物(RISC)等[3]。 见图3。

图3miRNAs的生物学发生和功能Fig3.ThebiogenesisandfunctionofmiRNAs
(A)miRNAs编码基因转录生成初级转录本(pri-miRNA):在细胞核开始发生miRNA序列。Bartel[4]和Kim[5]研究表明RNA聚合酶II调控基因启动了大部分的miRNA的转录过程。miRNA基因首先在RNA聚合酶II的促进下转录生成一个长的初级转录本,而在这个初级转录本中包含一个发夹结构及成熟miRNA。在初级转录本转录成功后,这些初级转录本由于存在不完全互补序列可以生成二级结构复合物,最后经过折叠后定位于细胞核。为了方便而后产生的miRNA前体进行剪切,首先要对初级转录本进行初步加工,而对于如何加工的研究则不多。通过研究线虫的let-7miRNA,我们发现其5′端存在剪接引导序列,而这些序列正是反式剪接的底物。初级转录本的反式剪接对产生成熟let-7RNA具有非常重要的影响,其具有延长发夹结构末端的茎区的作用,从而使RNA聚合酶ⅢDrosha的底物暴露出来,剪除影响下一步剪切的序列。
(B)pri-miRNA剪切产生前体miRNA(pre-miRNA):在miRNA双链的RNA区域被称为“微处理器”(microprocessor)的复合物识别之前,首先需要折叠成发夹环,然后再被较长的转录本切割成大约70nt的发卡结构前体[6-9]。RNASEN(DROSHA)与DGCR8组成“微处理器”复合物。
(C)miRNA前体从细胞核内转出:位于细胞质内的Dicer酶需要对动物的pre-miRNAs进行深一步的加工。Yi等[10]报道前体miRNA从细胞核内转运到细胞质是依靠于RanGTP/exportin5的转运机制。首先是exportin5促使前体miRNA从Drosha复合体中释放出来,并和其结合,但这必须在RanGTP具有高浓度的情况下才能进行,结合后前体miRNA被带入至细胞质内。进入胞质后,RanGTP的浓度会有所降低,此时前体miRNA从exportin5中脱离与Dicer酶结合开始下一步的加工。
(D)miRNA:miRNA*双链体的形成:前体miRNA在进入胞质后即会结合第二个双链特异性RNAse III,但前提是这个RNAseIII必须含有酶复合物。DICER1组件存在于这些酶复合物中,此组件可以识别dsRNA,再从pre-miRNA的非环末端切割约2个螺旋或22bp,然后移去环形成较小的双链RNA[11]。
(E)miRNA的成熟:DICER1-bounddsRNA与RNA-inducedsilencingcomplex(RISC)快速结合,再通过与RISC互作展开双链小RNA,进而生成成熟miRNA[5,12,13]。post-DICER1dsRNA的热力学性质决定了双链体的哪条链条被降解或形成成熟miRNA[14,15]。miRNA由于其在碱基配对上稳定性较差在加工的时候就被加载到RISC上。miRNA首先被加载到复合物中,在 “种子”序列的作用下与碱基配对,与RISC mRNA转录本3′非翻译区中的特定结合位点进行靶作用。“种子”序列即seedsequence,决定了miRNA与mRNA的结合,其大概有7-8nt的序列,位于成熟miRNA的上。RISC是介导miRNA基因沉默和miRNA:mRNA互作所必须的一种核糖核蛋白复合物。目前已发现RISC组件是由TRBP、Argonaute蛋白和Dicer组成的,其中最受关注的是Argonaute蛋白和核糖核酸酶Dicer。 RISC中的一个非常重要的功能元件是Aargonaute蛋白,其发挥的功效主要是作为内源性切割的催化元件。在miRNA发生中发挥核糖核酸酶作用的是Dicer,主要功效是释放成熟miRNA双体。
3 miRNA作用机制
miRNA主要调控真核生物基因表达的转录,是一种较新的基因表达调控因子,其具有非蛋白质性质。目前在miRNA调控基因领域的研究热点是其表达研究机制。现在存在的关于miRNA调控基因表达机制的理论假说模型有重激活、去阻遏、SG颗粒扣押靶mRNA、mRNA降解、P小体、翻译起始抑制和起始后抑制等[3]。
3.1 miRNA抑制翻译的起始
在含有m′Gppp具有帽子结构(7MGpppG)和多聚腺苷酸尾巴(AAAAA)的pri-miRNA帽子,含有内部核糖体进入位点和含有ApppN帽子结构的三种mRNA,只有miRNA可以抑制m′Qppp帽子结构;而且,核糖核蛋白复合体中聚集了某些帽子结构结合蛋白或者miRNA翻译起始过程中,干扰真核翻译起始因子(enkaryotictranslationinitiationfactors)eIF4G相互作用的蛋白质,进而导致翻译起始复合物不能与40s核糖体小亚基进行结合。另外:AGO(Argonautc)蛋白由于具有eIF4G帽子结合结构域的同源结构序列,从而可以阻止eIF4G生成起始复合物。抑制存在三个模型:一个模型结合了miRNA5'帽子结构上mi-RISC和e-IF4E之间的竞争;另一个模型是mi-RISC促进m-RNApoly3'尾巴的脱腺苷化;第三个模型是mi-RISC阻止60s核糖体单位与40s的翻译起始复合体的结合。mi-RISC介导的e-IF6,阻止核糖亚单位的起始位点结合来抑制翻译。miRNA及其靶标与多核糖共沉淀,可抑制内部核糖体进入位点,启动非依赖性的帽子翻译。
3.2 miRNA的起始后抑制
开始在线虫中发现lin-4的靶基因lin-14和lin-18的mRNA在结合lin-4前后,经蔗糖梯度和甲泛葡胺密度梯度,离心其密度未发生改变,实际上是lin-14和lin-18的miRNA在与lin-4结合后仍与多核糖体相偶连,翻译开始后才产生抑制作用。多聚核糖体与miRNA及其标靶结合于蔗糖沉降梯度中。多聚核糖体之所以能够翻译miRNA标靶是由于它们对抑制翻译的条件比较敏感。比如,一些翻译抑制剂与多聚核糖体经过短暂的保温,这些抑制剂如嘌呤霉素、多羟基瑙醇或密旋霉素,之后多聚核糖体可形成核糖体亚基或核糖体单体[16-19]。miRNA还可以结合基因的编码区和5′UTR区。miRNA通过与靶细胞的启动子和5′UTR区结合来启动一些基因的表达。如miRNA-373与E-钙黏蛋白和含冷激域的蛋白质C2的启动子区域结合上调了靶基因的表达。
人们针对miRNA标靶被成功翻译但无对应的蛋白质产物的这一矛盾现象提出了多肽链在翻译的同时降解的假说。但是这种假说并没有被正面证据所证实,如人们仍不明确假定的蛋白酶的性质。由于沉默的mRNA蛋白质表达无法被蛋白酶体抑制剂恢复,所以我们可以排除存在蛋白酶体参与[18]。
Petersen等[19]人为了获得miRNA沉默标靶的机制,设计出一个包含3′非翻译区(3′UTR)的合成的miRNA用于报告mRNA,而6个可以转染与miRNA类似的siRNA部分互补的相同位点存在于这个3′非翻译区上。虽然siRNA抑制mRNA的瞬时表达,但多聚核糖体依然可以和报告mRNA结合。在翻译起始受抑制的核糖体的解离速度要高于未受抑制的核糖体。这样便形成了一个miRNA可引起核糖体提前解离或脱落的假说。
还有其他一些证据表明miRNA对翻译起始后的抑制:通过含有内部核糖体进入位点 (IRES)的5’UTR启动的报告mRNA的进行翻译时一样产生沉默。由于mRNA帽结构与被IRES启动的mRNA的翻译无关,进一步证实了miRNA对翻译的抑制发生于帽识别之后的阶段[20]。
3.3 miRNA介导的mRNA降解与P小体有关
由于miRNA的脱腺苷化,去帽子和核苷酸内切酶的消化,使得miRNA降解。同时也发现Ago(Argonautc)蛋白定位于降解miRNA的RNA的颗粒。利用RNA颗粒含有的降解酶使其降解。
P小体是一种RNA颗粒体,且存在于真核细胞细胞质中,包含有大量的mRNA的降解蛋白和翻译抑制子,当mRNA的翻译受到抑制时,P小体会出现体积和数量上的变化,但此过程并非不可逆,受到翻译抑制的mRNA只是暂时停留在P小体。当出现环境变化时,mRNA返回到细胞质中,结合核糖体合成蛋白质,P小体包含AGO(Argonautc)蛋白和GW182抗体等参与miRNA转录沉默子的蛋白。这些蛋白引导miRNA与P小体中的蛋白结合,从而抑制靶细胞的翻译。如肝特异性miRNA-122沉默肝细胞中的GAT1mRNA,在P小体中随机聚集,在应激状概况下,可以通过促进miRISC-靶mRNA复合体解离和P小体解聚,去除miRNA的抑制作用,从细胞核进入到细胞质中,与GAT1的3UTR区结合,从而使P小体释放出GAT1mRNA,进入核糖体开始翻译。
4 动物胚胎miRNA的鉴定和研究
4.1 对斑马鱼胚胎的研究
斑马鱼(Daniorerio)由于其具有水生脊椎动物的显著特征,一直被作为常用模式动物用于研究现代遗传学、发育生物学及细胞生物学等[21]。生物信息学预测认为,斑马鱼基因组可能至少可以编码400种miRNAs[22]。研究人员在对斑马鱼不同发育阶段的小RNA文库构建研究后发现其已有217个miRNAs[22],并已经掌握了部分miRNAs的功能机制。下面将具体阐述miRNAs对斑马鱼的发育调控机制。
把用于加工成熟miRNAs的Dicer酶进行基因突变可以为我们展现斑马鱼胚胎发育中miRNAs所起的作用[23]。由于斑马鱼在早起卵裂到中囊胚期之前的胚胎发育是受母源性基因的调控[24],所以Ciruna[25]和Giraldez[26]等进行了一些方法以排除受到母源性基因的影响。他们将正常斑马鱼胚胎中的生殖细胞替换成结合了Dicer突变的生殖细胞,已经发生Dicer突变的生殖细胞会出现于这些被替换后仍能正常发育的斑马鱼个体中。
配子在突变后进行受精而后产生的胚胎发育时不能产生成熟的miRNAs,这一点可用于研究在斑马鱼胚胎发育中缺失miRNAs会发生何种变化。神经胚的形成也会受到Dicer突变的重要影响。产生实心的棒状结构的神经管的原因是神经板到神经管的发育过程中出现异常。不仅视网膜的发育会受到Dicer的影响,脊髓发育也受到Dicer突变的干扰,如神经底板的降低,神经官腔的缺少及脑室数的减少等。虽然神经系统的发育已出现畸形,但通过分析基因的表达我们观察到一些图示如神经管的背-腹轴和前-后轴并未受到彻底的破坏,以此可发现还未破坏胚胎神经系统的图示,可见miRNAs对胚胎神经系统的图式形成及命运决定过程影响较小,Dicer酶对神经细胞的分化及脑正常发育起着十分重要的作用。研究人员认为斑马鱼胚胎的早期发育受某些miRNAs的影响的一个佐证是斑马鱼脑和原肠胚发育出现缺陷是由Dicer突变引起的[26]。
Giaraldez等[26]利用报告基因GFP研究发现当胚胎外包达到二分之一时miRNA-430家族才开始表达,而后当开始形成原肠胚和体节时继续表达,表达在发育2d后下降。在Dicer突变胚胎中注射合成的mi-430双链核苷酸则能降低脑和原肠胚的异常发育情况。Lim[27]等研究预测了miRNA-430的靶基因情况,发现其可以调控不止一个靶基因的表达,当早期胚胎对母源mRNA脱腺苷化及清除有促进作用。
在斑马鱼脑中另一个表达丰富的miRNA是miRNA-125b,它通过对P53mRNA的3′UTR的直接作用进而抑制P53蛋白的表达。对斑马鱼胚胎进行r射线和喜树碱处理可快速增加P53的蛋白水平,进而可引起斑马鱼脑细胞的大面积凋亡[28]。这些都表明了在斑马鱼脑部发育中miRNA-125b所起到的重要作用。
对斑马鱼肠的发育和成熟起到关键作用的是miRNA-145,因为其可以调控肠平滑肌的发育。当miRNA-145的表达受到抑制时,肠平滑肌和上皮细胞的发育将不完全,导致碱性磷酸酶完全不能表达,从而使肠平滑肌的功能得不到发挥[29]。
另外在斑马鱼的心室的形成过程中不可缺少的miRNA是miRNA-143,其主要功能是直接抑制F-action加帽蛋白基因Adducin3的表达。当miRNA-143被敲出时,心室肌肉F-action的重构将被抑制,进而引起心室塌陷导致心室收缩力下降。可见心室形成过程中miRNA-143对Adducin3基因表达调控的重要性[30]。
4.2 鼠胚胎方面的研究
采用miRNA扩增结合miRNA芯片技术,筛选在小鼠受精后1.5d(2细胞)和2.5d(4细胞)胚胎中差异表达的microRNA。在对MicroRNA芯片数据进行分析后发现miRNA的表达有192个(2倍)出现了显著差异,在4细胞时表达比2细胞明显上调的miRNA有122个,明显下调的miRNA有70个。这次的miRNA表达变化是在胚胎基因组激活之后,通过分析这些差异的表达水平和功能,我们发现在胚胎发育中有些与发育相关的重要基因可能受到miRNA的调控,可见miRNA在胚胎发育中所产生的作用重大,而这些对我们进一步研究发现阻滞胚胎发育的分子机制有着非常重大的意义[31]。
miR-34c在性成熟小鼠(1个月)睾丸中表达量最高,且只在生精细胞中高表达,其次为成熟睾丸,在睾丸中表达量少的阶段主要在胚胎期及和出生至到性成熟之前,另外其在卵巢组织中的表达也很低;这些现象都说明该miRNA为睾丸生精细胞特异且高度表达[32]。合成miR-34c模拟物,观察分析小鼠胚胎干细胞诱导分化雄性生殖时所到的此miRNA的影响。研究结果表明转染miR-34c的mESCs,经RA诱导48h后,AP阳性克隆的结果表明,c-Myc、0ct4等一些多能性相关基因表达下降明显,而Scp3、Vasa等一些生殖相关基因表达大幅度上调。初步揭示,小鼠胚胎干细胞在向生殖细胞诱导分化时受到miR-34c作用。miR-34c可作用于RARg(RA的Y亚体受体)基因的3′UTR,从而可能调控雄性生殖细胞的发生过程,特别是调控生殖细胞的减数分裂过程。以上说明,miR-34c可能与哺乳动物雄性生殖系统有着密切的关系,其对mESCs向雄性生殖细胞分化起着十分重要的作用。
4.3 猪胚胎方面的研究
Li等[33]采集了猪从胚胎期到180日龄10个发育阶段的完整胚胎或富有代表性的不同组织类型来构建miRNA文库,利用Solexa测序技术对10个miRNA文库进行序列测定,结果共检测到995个miRNA,对应862个Pre-miRNA,uniquemiRNA序列有771个,同时还发现高表达的miRNA主要是以isomiR的形式进行表达,isomiR和miRNA*增加了miRNA对基因调控的复杂性。发现miRNA的let-7家簇和mi-R-122分别有50个、29个成员。Let-7家族有高度的保守性。尤其在30胚龄和45胚龄的早期发育阶段[34]。8种猪特异性的miRNA在这10个文库中共表达。
Zhou等[35]以猪 33d的胚胎(E33)为研究对象,利用 Solexa高通量测序技术鉴定猪胚胎头部与内脏的miRNA在头部文库中共识别出候选miRNA194种,已知miRNA75种;而在内脏文库中识别出候选miRNA130种,已知miRNA76种,在两个器官组织中表达量最高的分别为miR-9和miR-1。在成年猪的肌肉、肺脏和大脑中表达量最高的分别是miR-1、miR-103和miR-140*。选取了50种靶基因,KEGG Pathway分析表明这些靶基因参与胚胎神经系统、四肢、前后模式、背腹模式的形成。
4.4 鸡胚胎方面的研究
以往研究发现,鸡的基因组中含有大量的miRNA。Glazov等[37]采用Solexa高通量测序研究发育第5 d、7d、9d鸡胚胎,发现了449个新的miRNA,其中的很多在不同的时间点有不同的表达模式。Damell利用原位杂交法分析研究对鸡胚胎发育早期miRNA的表达情况,研究表明在胚胎发育的前5d约有100个miRNA进行表达,而这期间表达的miRNA大部分都有组织表达特异性的特点[38,39]。HickS等[78]通过高通量测序发现在鸡胚胎发育的第11d有近200个miRNA开始表达,而法氏囊和脾脏中的miRNA表达量在第15d和20d会出现显著的差异,在发育的第15d和20dnc-miR-21在法氏囊中不表达却在脾脏中表达较高,而同源的miR-148b却出现了相反的情况。
4.5 家蚕卵方面的研究
Yu等[36]在家蚕14个发育时期的miRNAs进行分析研究,结果表明miRNA在家蚕四龄蜕皮期的表达数量和种类远高于家蚕其他发育期,进一步利用Stem-loopRT-PCR分析表明,在四龄蜕皮期表达变化差异较大的是一些保守miRNA,说明miRNA对这一时期的调控作用比较重大。研究人员进一步分析了15个保守的家蚕miRNAs的表达量,结果表明在不同发育时期表达量变化显著的miRNAs有8个,结合家蚕的发育特点及靶基因预测的结果,进一步筛选分析了一些miRNAs的靶基因及其在家蚕发育中的可能机制,这些都为我们全面的发掘和阐述miRNAs对家蚕发育的调控作用提供了理论依据。
5 展 望
随着新一代高通量测序的成熟和普及,利用这项技术鉴定和筛选绵羊组织和细胞中的miRNA的研究报道越来越多,取得了不少成果。在绵羊基因组信息还不完整背景下,关于与目标性状密切相关的具体miRNA的靶基因及其调控机制还不清楚,研究也非常欠缺。当然这一点既是重点,也是难点。因为只有我们把具体的miRNA的靶基因找到,才能阐明miRNA调控性状的分子机制。
[1]LeeRC,FeinbaumRL,AmbrosV.TheC.elegansheterochronicgenelin-4encodessmallRNAswith antisensecomplementaritytolin-4[J].Cell,1993,75(5):843-854.
[2]张敬磊.MiRNA-99a通过靶向调节EIF2C2/PTEN信号通路抑制肝癌细胞的生长[D].上海:第二军医大学,2012.
[3]李国喜.猪脂肪组织发育相关miRNA的鉴定及miR-103生物学功能的初步研究[D].陕西:西北农林科技大学,2011.
[4]BartelDP.MicroRNAs:genomics,biogenesis,mechanism,andfunction[J].Cell,2004,116(2):281-297.
[5]KimVN.MicroRNAbiogenesis:coordinatedcroppinganddicing[J].NatRevMolCellBiol,2005,6(5): 376-385.
[6]DenliAM,TopsBB,PlasterkRH,etal.ProcessingofprimarymicroRNAsbytheMicroprocessorcomplex[J].Nature,2004,432(7014):231-235.
[7]HanJ,LeeY,YeomKH,etal.MolecularbasisfortherecognitionofprimarymicroRNAsbythe Drosha-DGCR8complex[J].Cell,2006,125(5):887-901.
[8]LeeY,JeonK,LeeJT,etal.MicroRNAmaturation:stepwiseprocessingandsubcellularlocalization[J]. EMBO,2002,21(17):4663-4670.
[9]LeeY,AhnC,HanJ,etal.ThenuclearRNaseⅢDroshainitiatesmicroRNAprocessing[J].Nature,2003, 425(6956):415-419.
[10]YiR,QinY,MacaraIG,CullenBR.Exportin-5mediatesthenuclearexportofpre-microRNAsand shorthairpinRNAs[J].GenesDev,2003,17(24):3011-3016.
[11]VermeulenA,BehlenL,ReynoldsA,etal.ThecontributionsofdsRNAstructuretoDicerspecificity andefficiency[J].RNA,2005,11(5):674-682.
[12]CarthewRW,SontheimerEJ.OriginsandmechanismsofmiRNAsandsiRNAs[J].Cell,2009,136(4): 642-655.
[13]GregoryRI,ChendrimadaTP,CoochN,etal.HumanRISCcouplesmicroRNAbiogenesisand posttranscriptionalgenesilencing[J].Cell,2005,123(4):631-640.
[14]KhvorovaA,ReynoldsA,JayasenaSD,etal.FunctionalsiRNAsandmiRNAsexhibitstrandbias[J]. Cell,2003,115(2):209-216.
[15]SchwarzDS,HutvagnerG,DuT,etal.AsymmetryintheassemblyoftheRNAienzymecomplex[J].Cell, 2003,115(2):199-208.
[16]张征.microRNA介导HAb18G/CD147分子转录后调控及其机制[D].西安:第四军医大学,2009.
[17]MaroneyPA,YangY,FisherJ,etal.EvidencethatmicroRNAsareassociatedwithtranslating messengerRNAsinhumancells[J].NatStructMolBiol,2006,13(12):1102-1107.
[18]NottrottS,MJSimard,JDRichter.Humanlet-7amiRNAblocksproteinproductiononactively translatingpolyribosomes[J].NatStructMolBiol,2006,13(12):1108-1114.
[19]PetersenCP,BordeleauME,PelletierJ,etal.ShortRNAsrepresstranslationafterinitiationin mammaliancells[J].MolCell,2006,21(4):533-542.
[20]张振辉.MicroRNA-26对大鼠心脏重构的调控作用[D].广东:广州医学院,2011.
[21]丁雷,闫学春,孙效文,等.MicroRNAs对斑马鱼发育的调控[J].遗传,2011,33(11):1179-1184.
[22]KloostermanWP,PlasterkRHA.ThediversefunctionsofmicroRNAsinanimaldevelopmentanddisease [J].DevCell,2006,11(4):441-450.
[23]ThatcherEJ,BondJ,PaydarI,etal.GenomicorganizationofzebrafishmicroRNAs[J].BMCGenomics, 2008,9:253.
[24]WienhoidsE,KoudijsMJ,vanEedenFJM,etal.ThemicroRNA-ProducingenzymeDicerlisessential forzebrafishdevelopment[J].NatGenet,2003,35(3):217-218.
[25]CirunaB,WeidingerG,KnautH,etal.Productionofmaternal-zygoticmutantzebrafishbygerm-line replacement[J].ProcNatlAcadSciUSA,2002,99(23):14919-14924.
[26]GiraldezAJ,CinalliRM,GlasnerME,etal.MicroRNAsregulatebrainmorphogenesisinzebrafish[J]. Science,2005,308(5732):833-838.
[27]LimLP,LauNC,Garrett-EngeleP,etal.MicroarrayanalysisshoesthatsomemicroRNAsdownregulatelarge numbers of targetmRNAs[J].Nature,2005,433(7027):769-773.
[28]Le MTN,The C,Shyh-Chang N,et al.MicroRNA-125b is a novel negative regulator of p53[J].Genes Dev,2009,23(7):862-876.
[29]Zeng L,Carter AD,Childs SJ.miR-145 directs intestinalmaturation in zebrafish[J].Proc Natl Acad Sci USA,2009,106(42):17793-17798.
[30]Deacon DC,Nevis KR,Cashman TJ,et al.The miR-143-adducin3 pathway is essential for cardiac chambermorphogenesis[J].Development,2010,137(11):1187-1189.
[31]崔骥.小鼠种植前2细胞和4细胞胚胎的MicroRNA芯片分析[D].江苏:南京医科大学,2011.
[32]张姗姗.miR-34c在小鼠胚胎干细胞向雄性生殖细胞分化过程中的作用[D].陕西:西北农林科技大学,2011.
[33]Li M Z,Liu Y K,W T,et al.Repertoire of Porcine MicroRNAs in Adult Ovary and Testis by Deep Sequencing[J].Int JBiol Sci.2011,7(7):1045-1055.
[34]Bernstein E,Kim SY,Carmell M A,et al.Dicer is essential formouse development[J].Nature genetics. 2003,35(3):215-217.
[35]Zhou Y,Tang X,Song Q,et al.Identification and Characterization of Pig Embryo MicroRNAs by Solexa Sequencing[J].Reprod Dom Anim.2013,48:112-120.
[36]Yu X,Zhou Q,Li S—C,Luo Q,Cai Y,et al.The Silkworm(Bombyx mori)microRNAs and Their Expressions in Multiple Developmental Stages[J].PLoSONE 3(8):2997.
[37]Glazov,E.A.,Cottee,P.A.,Barris,W.C..et al.A microRNA catalog of the developing chicken embryo identified by a deep sequeneing approachlJ].Genome Res.2008,18(6):957-964.
[38]Darnell,D.K.,Kaur,S,Stanislaw,S.et al.MicroRNA expression during chick embryo development[J]. Developmental Dynamies.2006,235(11):3156-3165.
[39]Damell,D.,Kaur,S.,Stanislaw,S.et al.GEISHA:an in situ hybridization gene expression resource for the chicken embryo[J].Cytogenetic and genome researeh.2007,117(l-4):30-35.
Progress ofm iRNA Research in Animal Embryonic Development
WUWei-wei,Gong Ping,HANIKEZI,SHIXiao-lei,YU Li-juan,
XU Xin-ming,TIAN Yue-zhen,TIAN Ke-chuan*
(Institute of Animal Sciences,Xinjiang Academy of Animal Science,Urumqi830000,China)
MicroRNAs(miRNAs)are non-coding RNA in eukaryotes,With functions of regulating,which is made up by 20-25 bases,and they regulate target gene expression at transcriptional and posttranscriptional levels by specific base-pairing with targetmRNA,So as to accomplish the target gene transcription regulation. This article reviewed the found ofmicroRNAs,the mechanism of generation and action in vivo,the research and identification ofmiRNA in animal embryonic development,and the problems and prospect in the study were elaborated.
miRNA;animal;embryonic development
S814.8
A
1003-6377(2014)01-0001-09
2013-11-20
自治区公益性院所基金项目;国家农业杰出人才及创新团队建设项目;国家绒毛用羊产业技术体系(CARS-40-02)
吴伟伟(1981-),女,吉林人,博士,助理研究员,研究方向:动物遗传育种与繁殖。
田可川(1963-),男,研究员,研究方向:动物遗传育种与繁殖。
