强化生物除磷系统中胞外聚合物的特性
2014-04-28王然登程战利彭永臻王淑莹哈尔滨工业大学城市水资源与水环境国家重点实验室黑龙江哈尔滨50090北京工业大学北京市水质科学与水环境恢复工程重点实验室北京市脱氮除磷处理与过程控制工程技术研究中心北京004
王然登,程战利,彭永臻,*,王淑莹(.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 50090;.北京工业大学,北京市水质科学与水环境恢复工程重点实验室,北京市脱氮除磷处理与过程控制工程技术研究中心,北京 004)
强化生物除磷系统中胞外聚合物的特性
王然登1,程战利1,彭永臻1,2*,王淑莹2(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090;2.北京工业大学,北京市水质科学与水环境恢复工程重点实验室,北京市脱氮除磷处理与过程控制工程技术研究中心,北京 100124)
胞外聚合物(EPS)在生物除磷过程中具有蓄磷能力,为进一步明确生物除磷系统中的EPS特性,以不具有明显除磷能力的全程好氧活性污泥系统(R1)的EPS作为对比,考察了具有良好除磷效果的厌氧/好氧交替下的强化生物除磷系统(R2)中EPS的理化特性.结果表明,相对于R1中的EPS主成分在一个周期内的不固定,R2中的蛋白质含量一直明显高于多糖含量;两者的主要荧光物质均为类蛋白质和类富里酸,但在好氧末期R2中类蛋白质的荧光强度高于R1; R1的EPS中Ca2+> Mg2+,而在R2中, Mg2+>Ca2+,同时R1中的Ca2+含量平均值为8.67mg/gMLSS,大于R2中Ca2+的平均值2.40mg/gMLSS;在好氧末期,R2中的TP为21.65mg/gMLSS,明显高于R1中的TP含量(13.83mg/g-MLSS).此外,R1和R2的zeta电位平均值分别为-36mV和-25mV.由此可见, EBPR系统中的EPS具有与全程好氧活性污泥中的EPS不同的特征.
强化生物除磷;胞外聚合物;三维荧光激发-发射光谱;金属离子;zeta电位
强化生物除磷(EBPR)工艺采用厌氧/好氧的方式运行,以系统中富集的聚磷菌(PAOs)所具有的“超量”吸磷特性来达到将污水中磷去除的目的,因其经济性和高效性在污水处理厂得到了广泛的应用[1].PAOs的生化反应过程包括:1)厌氧条件下,PAOs利用体内多聚磷酸盐(Me-polyP, Me主要为K+,Mg2+,Ca2+)分解所释放的能量及糖原所提供的还原力吸收溶液中的挥发酸(VFA)并将其转化为聚羟基丁酸盐(PHA),同时MepolyP分解所产生的MeHPO4/MeH2PO4被转移到体外,表现为,溶液中的COD降低,正磷酸盐(Pi)和K+,Mg2+,Ca2+含量增加;2)好氧条件下, PAOs体内储存的PHA氧化分解产生能量,将污水中的Pi及K+,Mg2+,Ca2+吸收到体内并合成Me-polyP,从而去除污水中磷[2].
细菌的胞外聚合物(EPS)作为污水生物处理系统污泥中的重要组成部分,具有维持絮体污泥及颗粒污泥结构的稳定性,对系统的处理效果具有重要的作用[3].通常关于EPS特性的研究主要集中在EPS的组成成分及含量比例、荧光光谱特性和带电性,以及这些特性的改变对絮体污泥的沉降性,颗粒污泥的形成情况及膜组件的污染情况的影响[4].研究发现EPS中主要以多糖和蛋白质为主,多糖和蛋白质的比例变化可能会影响到EPS的疏水性及带电性,改变污泥的物理特性[5].近年来一些研究发现在生物除磷系统中污泥的EPS中贮存有一定量的磷,认为除PAOs对P的去除作用外, EPS对P也有一定的去除[6-7].目前针对EBPR系统中EPS特性的研究较少, 鉴于生物除磷独特的生化反应过程,其中的EPS特性也会有所不同,因此有必要对生物除磷系统中EPS的理化特性进行深入研究.本研究以不具有明显除磷能力的全程好氧活性污泥系统为参照,考察了具有良好除磷效果的EBPR系统中的EPS的理化特性,以期为EBPR系统中EPS的特性研究提供更全面的信息.
1 材料与方法
1.1 试验装置及运行方式
采用两个相同构型的小试SBR反应器(R1,R2),反应器为有机玻璃圆柱体,高400mm,直径150mm,总容积为6L.两个反应器每周期6h,每天运行4个周期,每周期进水3L,周期末排水3L.R1的运行方式为全程好氧(295min),R2以厌氧(85min)/好氧(210min)交替的方式运行,进水时间均为5min,沉淀30min、排水10min、静置10min.由时间控制器控制反应器具体的运行程序.每天在第二个周期末排出泥水混合物100mL.全程采用搅拌器进行混合搅拌,转速为150~180r/min.曝气采用微孔曝气砂头进行,曝气量控制在0.16m3/h.温度控制在(23±2)℃.
1.2 试验用水及接种污泥
采用人工模拟废水作为反应器进水.进水以丙酸钠和乙酸钠作为碳源,氯化铵作为氮源,磷酸二氢钾作为磷源,硫酸镁和无水氯化钙分别作为镁源和钙源.每升配水中各个成分的投加量及相应的指标浓度如表1所示.同时每升水中加入1mL的微量元素液[8].接种污泥取自哈尔滨市某城市污水处理厂.
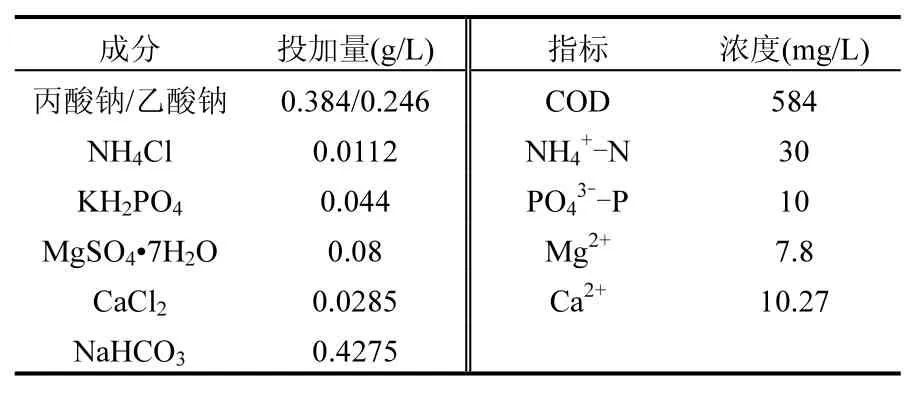
表1 试验模拟废水成分含量及指标浓度Table 1 Quantity and concentration of synthetic wastewater in the experiment
1.3 检测指标及分析方法
1.3.1 常规指标的测定 MLSS、SVI 及水溶液中PO43--P的测定采用国家标准测定方法[9].
1.3.2 EPS的提取及测定 EPS的提取采用热提取法,具体方法参考蔡春光等[10]的研究,在一个周期的不同反应阶段取10mL污泥混合液,在 4℃,2000g下离心10min,弃去上清液后,加入去离子水至原体积,混合均匀后将混合液80℃恒温水浴中60min,每隔一段时间摇晃一下.加热结束后12000g离心10min.离心后的上清液经0.45µm的滤膜过滤,过滤后的上清液作为提取后的EPS溶液进行成分测定分析.
EPS中多糖的测定采用苯酚-硫酸法[11],蛋白质的测定采用修订的Lowery法[12].
1.3.3 离子的测定 EPS溶液中Ca2+、Mg2+及TP的测定采用电感耦合等离子体发射光谱仪(Perkin Elmer, Wellesley, MA, USA, Optima2000).
1.3.4 三维荧光光谱分析 对于EPS中荧光物质的测定采用日立FP-6500三维荧光光谱仪进行,激发光以5nm为间隔在220~450nm光谱范围内进行扫描,发射光以1nm为间隔在250~ 600nm的光谱范围内进行扫描.
1.3.5 Zeta电位的测定 Zeta电位的测定采用zeta电位测定仪(Zetasizer 2000, Malvern, UK).
2 结果与讨论
2.1 反应器的运行情况
如图1所示,一个稳定周期内R1溶液中的PO43--P的浓度一直在12mg/L左右波动,反应末期出水中的PO43--P的浓度为11.63mg/L,系统几乎没有除磷能力,这是因为R1全程好氧,不具有富集PAOs的优势运行条件.而R2中厌氧/好氧的运行方式与PAOs的代谢特性相符,有利于富集PAOs,溶液中的PO43--P的浓度表现为厌氧段增加,好氧段减少的趋势.厌氧末溶液中PO43--P达到了75.47mg/L,好氧90min后溶液中的PO43--P含量降低为0.3mg/L,好氧末期出水中几乎没有PO43--P的存在.R1和R2系统分别具有了全程好氧的活性污泥特征和良好的EBPR污泥特征,具备了本研究所需要的条件.
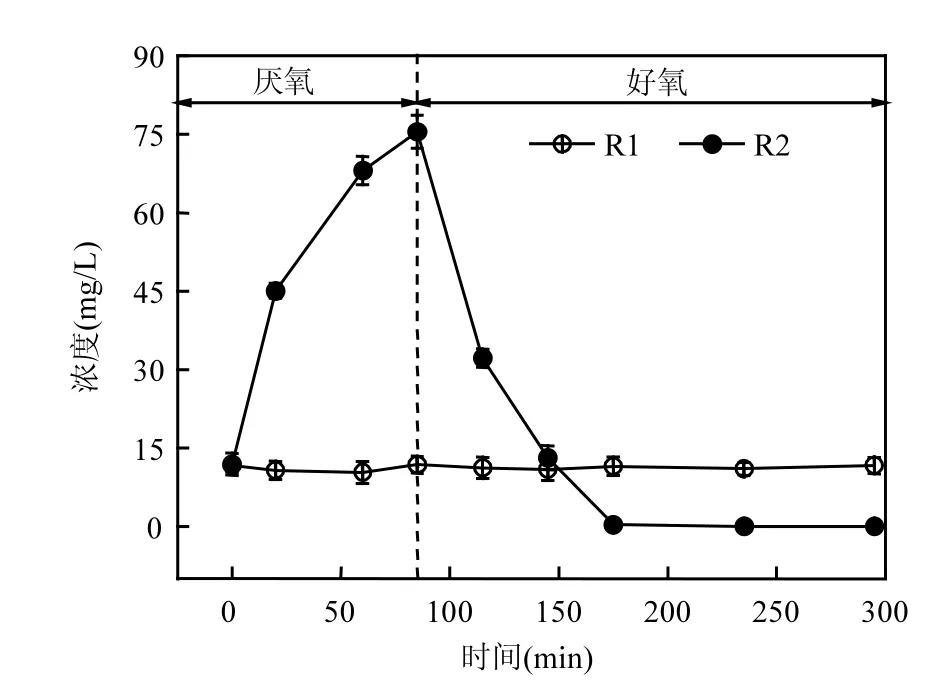
图1 一个周期内R1和R2溶液中的PO43--P的变化情况Fig.1 Variations of PO43--P concentration in R1 and R2 solution during one cycle
2.2 EPS中多糖和蛋白质含量的对比
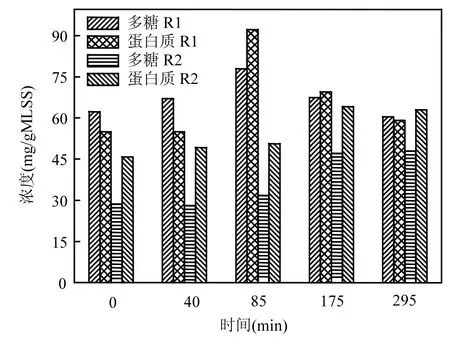
图2 R1和R2中一个周期内EPS中多糖和蛋白质的变化情况Fig.2 Variations of protein and polysaccharides in EPS from R1and R2 during one cycle
为对比研究R1和R2系统中的EPS特征,对R1和R2两个系统稳定周期内污泥中EPS的变化情况进行了测定.如图2所示,整体上R1中的EPS主成分(多糖和蛋白质)不固定,而R2中EPS的蛋白质含量明显高于多糖含量.一个周期内的具体变化情况为,在R1的反应初期,EPS中的蛋白质含量(54.95mg/gMLSS)低于多糖含量(62.22mg/gMLSS),在40min时多糖的含量稍有增加,在85min时,多糖和蛋白质的含量均明显增加,分别为77.90,92.17mg/gMLSS,此时,蛋白质的含量高于了多糖的含量.此后两者的含量均有所减少,到反应末期,蛋白质的含量为59.08mg/ gMLSS,略低于多糖的量60.42mg/gMLSS. R1中整个周期内EPS变化情况可能与微生物在饱食情况下分泌EPS,而在饥饿条件下消耗EPS有关.而在整个周期内R2中蛋白质的含量一直高于多糖含量,厌氧末期(85min),多糖和蛋白质的含量分别为31.75,50.58mg/gMLSS,相对于反应初期只有少量的增加,此后好氧段的多糖和蛋白质含量有了明显的增加,反应末期多糖和蛋白质的含量分别为47.93,62.89mg/gMLSS.由此可见,R1和R2两个系统中的EPS在一个周期内的变化情况不同.由于R2系统具有良好的生物除磷效果,而EBPR过程EPS作为细胞体与水溶液进行离子(Ca2+,Mg2+,K+,各种形态的磷)传递的通道,离子的转移过程需要更多转移蛋白,或需要一些酶参与聚磷酸盐在体外的后期的分解或初步合成反应等,故而会有更多的蛋白质分泌到体外EPS中参与转移过程.
2.3 EPS的三维荧光特性的对比
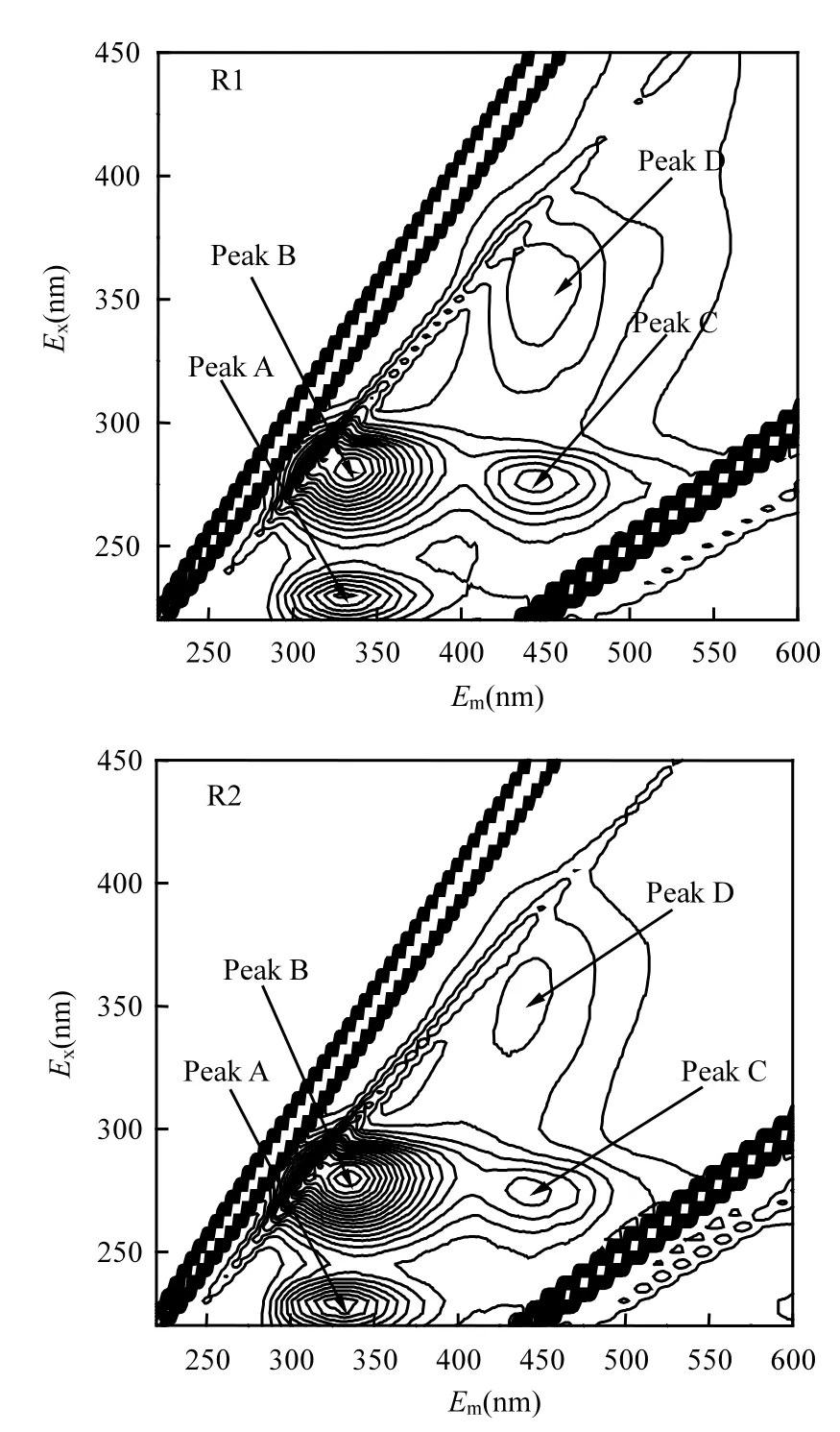
图3 R1和R2中EPS的三维荧光光谱特性对比Fig.3 3D EEM spectra of EPS from R1 and R2
由图3可知, R1和R2反应末期的EPS三维荧光光谱中都有3个明显的荧光峰,其中,Peak A: Ex/Em=225~240/340~350(类蛋白荧光峰), Peak B: Ex/Em=260~290/300~350(色氨酸类荧光峰),这两种荧光峰与胞外聚合物中的芳环氨基酸结构有关; Peak C: Ex/Em=240~300/420~470(类富里酸荧光峰),Peak D:Ex/Em=330~360/400~450(类胡敏酸荧光峰),与EPS中的羧基和羰基结构有关[13].这说明,虽然R1和R2的运行情况不同,但其EPS中的组分和物质结构是基本相同的.从各荧光峰的荧光强度看,两者中的荧光物质主要成分均为类蛋白质物质,其次为类富里酸.但R2中类蛋白质荧光峰所对应的荧光强度要高于R1中EPS所对应的荧光强度,说明R2中EPS所含有的荧光物质浓度更高.这与上文R1和R2在好氧末期EPS中的蛋白质含量大小相符合.此外在强化生物除磷系统的EPS中的富里酸荧光峰的强度低于全程好氧系统中EPS的荧光强度,关于这一现象还没有相关的报道,至于富里酸在强化生物除磷系统中的作用还有待进一步深入研究.
2.4 EPS中Ca2+,Mg2+和TP含量的对比
由图4可见,在整个周期内R1的EPS中的Mg2+变化并不明显,而Ca2+在反应前期逐渐增加,在85min时达到最高(Ca2+=13.31mg/gMLSS, Mg2+=3.05mg/gMLSS),此时也是EPS含量最多的时期(图2),也就是说Ca2+会随着EPS含量的增加而增加,而Mg2+只有微弱的增加.在此后的反应过程中Ca2+和Mg2+的浓度逐渐降低,分别为5.78,2.16mg/gMLSS,TP的含量为13.83mg/ gMLSS.在整个变化过程中Ca2+的含量一直高于Mg2+.这可能与进水中的Ca2+浓度大于Mg2+浓度有关,因为EPS对金属离子具有一定的吸附作用,且金属离子在EPS具有架桥作用可维持EPS的三维空间结构构型.在R2中前85min内(厌氧段),EPS中的Ca2+, Mg2+和TP的含量几乎没有变化,厌氧末它们的含量分别为2.02,2.34, 12.13mg/gMLSS.在接下来的好氧段,EPS中的Ca2+,Mg2+的量均有所增加,分别为2.89,4.28mg/ gMLSS, TP的含量可达到21.65mg/gMLSS.在整个变化过程中Ca2+的含量始终低于Mg2+的含量.通常,活性污泥系统的EPS中的Ca2+浓度高于Mg2+[14-15],而该EBPR系统EPS中的Mg2+含量却高于Ca2+,其背后的原因可能与PAOs的代谢过程有关,PAOs代谢过程中Mg2+的需要量大于Ca2+[16],而MeHPO4的释放及吸收都要经过EPS转移到细胞外或进入到细胞内,此过程中可能会有部分Me被截留在了EPS中,由于MgHPO4的量大于CaHPO4,那么Mg2+的截留量可能会高于Ca2+.同时这也可能与EBPR系统中EPS的特性有关,如EBPR系统中EPS的主成分为蛋白质,其含量明显高于多糖,而全程好氧的活性污泥系统中EPS以多糖为主.另外,R1中的Ca2+含量平均值为8.67mg/gMLSS,大于R2中Ca2+含量的平均值2.40mg/gMLSS,这表明Ca2+在两个系统中的作用有所不同,或由于两个系统中的EPS的成分含量不同,其对Ca2+的吸附量也不同.确切原因还需后期进一步的研究.同时,在好氧末期EPS中储存的P含量为21.65mg/gMLSS,明显高于R1中的TP含量(13.83mg/gMLSS).由此表明,EBPR系统中好氧段有一部分P聚集在了EPS中,而不是完全转移到聚磷菌细胞体内.
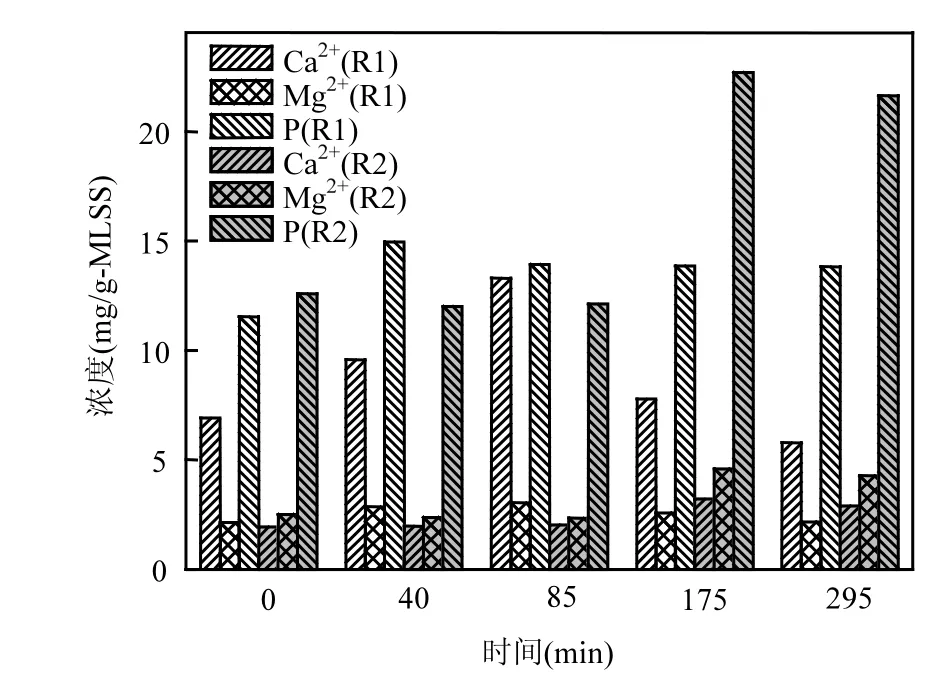
图4 R1和R2中EPS内的Ca2+,Mg2+和P的情况Fig.4 The contents of Ca2+, Mg2+and P in the EPS matrix from R1 and R2
2.5 EPS的zeta电位在一个周期内的变化情况
EPS是包裹在微生物表面的一种黏性物质,其zeta电位的高低会改变微生物之间的静电斥力,影响到微生物之间的聚集特性[17].由图5可以看出,两个系统中的zeta电位均呈负值, R1的zeta电位平均值为-35mV,明显低于R2的 zeta电位平均值(-23mV).由于蛋白质中氨基基团带有正电荷,可以中和一些多糖中的羟基和磷酸根基团所带的负电荷[18],王浩宇等[19]研究也发现zeta电位与EPS中的蛋白质/多糖的比值呈正相关.而本研究中R2的蛋白质/多糖比值大于R1中的蛋白质/多糖比值,这与R2的zeta电位高于R1的测定结果相一致.由于电位的差别,与R1相比,R2中EPS将降低污泥表面的静电斥力有利于污泥之间的聚集. 本试验中R1和R2中的污泥容积指数分别为108,67mL/g.由此看来,EBPR系统中的污泥聚集特性更好一些,这可能是由于该系统中的EPS中以蛋白质为主,且其zeta电位值较高,有利于污泥的聚集.
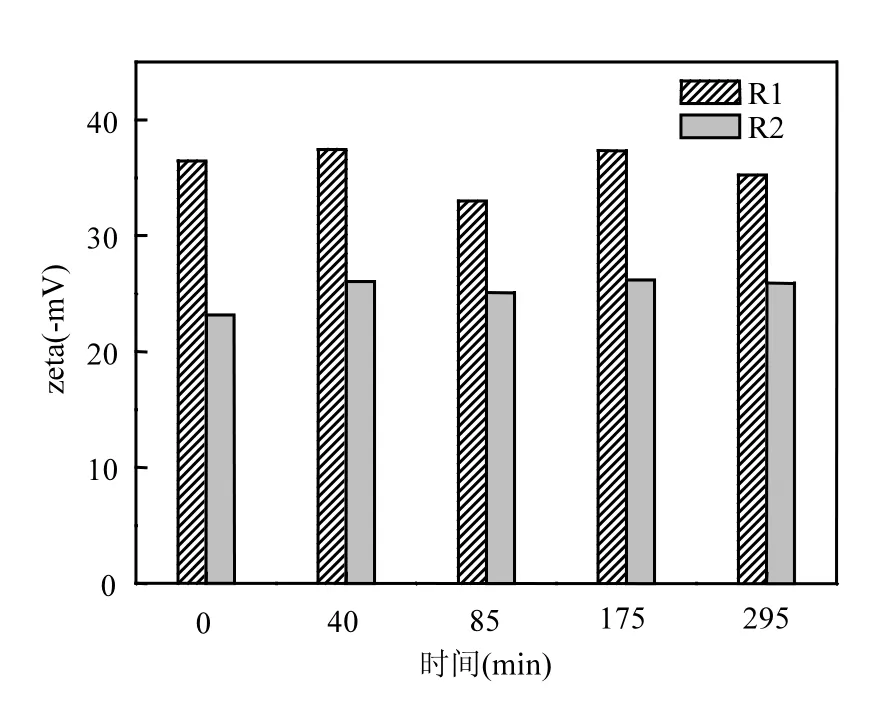
图5 R1和R2中EPS的zeta电位Fig.5 Zeta potential of EPS from R1 and R2
3 结论
3.1 EBPR系统中的EPS主成分比较稳定,以蛋白质为主,其中的主要荧光物质为类蛋白质和类富里酸.
3.2 EBPR系统的EPS中Mg2+含量高于Ca2+,其中的Ca2+含量相对较低,且其中积聚有一定的磷,好氧末EPS中的TP含量为21.65mg/g-MLSS;
3.3 EBPR系统中EPS的zeta电位为-23mV,污泥SVI为67mL/g,其污泥聚集沉降性能优于全程好氧不具有明显生物除磷能力的系统.
[1] Oehmen A, Lemos P C, Carvalho G, et al. Advances in enhanced biological phosphorus removal: From micro to macro scale [J]. Water Research, 2007,41:2271-2300.
[2] van Veen H W, Abee T, Kortstee G J J, et al. Generation of a proton motive force by the excretion of metal-phosphate in the polyphosphate-accumulating Acinetobacter johnsonii strain 210A [J]. The Journal of Biological Chemistry, 1994,269(47):29509-29514.
[3] 倪丙杰,徐得潜,刘绍根.污泥性质的重要影响物质-胞外聚合物(EPS) [J]. 环境科学与技术 [J], 2006,29(3):108-110.
[4] Raszka A, Chorvatova M. Wanner J. The role and significance of extracellular polymers in activated sludge. Part I: literature review [J]. Acta Hydrochimica et Hydrobiologica, 2006,34:411-424.
[5] Arabi S and Nakhla G. Impact of protein/carbohydrate ratio in the feed wastewater on the membrane fouling in membrane bioreactors [J]. Journal of Membrane Science, 2008,324:142-150.
[6] Li N, Ren N Q, Wang X H, et al. Effects of temperature on intracellular phosphorus absorption and extra-cellular phosphorus removal in EBPR process [J]. Bioresource Technology, 2010, 28(9):1758-1762.
[7] Zhang H L, Fang W, Wang Y P, et al. Phosphorus removal in an enhanced biological phosphorus removal process: roles of extracellular polymeric substances [J]. Environmental Science and Technology, 2013,47:11482-11489.
[8] Saito T, Brdjanovic D, van Loosdrecht M C M, et al. Effect of nitrite on phosphate uptake by phosphate accumulating organisms [J]. Water Research, 2004,38:3760-3768.
[9] 国家环保总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2003.
[10] 蔡春光,刘军深,蔡伟民.胞外多聚物在好氧颗粒化中的作用机理 [J]. 中国环境科学, 2004,24(5):623-626.
[11] Adav S S, Lee D J. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure [J]. Journal of Hazardal Material, 2008,154:1120-1126.
[12] Frølund B, Keiding K, Nielsen P H. Enzymatic activity in the activated sludge flocs matrix. [J]. Applied Microbiology and Biotechnology, 1995,43(4):755-761.
[13] 高景峰,郭建秋,陈冉妮,等.三维荧光光谱结合化学分析评价胞外多聚物的提取方法 [J]. 环境化学, 2008,27(5):662-668.
[14] Yu G H, He P J, Shao L M. Characteristics of extracellular polymeric substances (EPS) fractions from excess sludges and their effects on biofloculability [J]. Bioresource Technology, 2009, 100:3193-3198.
[15] Bourven I, Joussein E, Guibaud G. Characteristics of the mineral fraction in extracellular polymeric substances (EPS) from activated sludges extracted by eight different methods [J]. Bioresource Technology, 2011,102:7124-7130.
[16] Choi H J, Yu S W, Lee S M. Effects of potassium and magnesium in the enhanced biological phosphorus removal process using a membrane bioreactor [J]. Water Environment Research, 2011,83: 613-621.
[17] Wang L L, Wang L F, Ren X M, et al. pH dependence of structure and surface properties of microbial EPS [J]. Environmental Science and Technology, 2012,46:737-744.
[18] Wang Z P, Liu L L, Yao J, et al. Effects of extracellular polymeric substances on aerobic granulation in sequencing batch reactors [J]. Chemosphere, 2006,63:1728-1735.
[19] 王浩宇,苏本生,黄 丹,等.好氧污泥颗粒化过程中Zeta电位与EPS的变化特性 [J]. 环境科学, 2012,33(5):1614-1620.
《中国环境科学》获评“2012中国最具国际影响力学术期刊”
2012年12月,《中国环境科学》被评为“2012中国最具国际影响力学术期刊”.
“中国最具国际影响力学术期刊”是中国科学文献计量研究中心、清华大学图书馆依据《CAJ国际引证报告》,按2011年度中国学术期刊被SCI期刊、SSCI期刊引用的总被引频次排序并经40多位期刊界专家审议,遴选出的TOP5%期刊.获评“中国最具国际影响力学术期刊”的科技类期刊共156种.统计分析结果表明,从定量分析的角度看,“中国最具国际影响力学术期刊”的国际影响力已经达到国际中等以上水平,跨入了国际品牌学术期刊行列.
《中国环境科学》编辑部
Characteristics of EPS taken from an enhanced biological phosphorus removal system.
WNAG Ran-deng1, CHENG Zhan-li1, PENG Yong-zhen1,2*, WANG Shu-ying2(1.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China;2.Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering, Engineering Research Center of Beijing, Beijing University of Technology, Beijing 100124, China). China Environmental Science, 2014,34(11):2838~2843
EPS could act as a reservoir for phosphorus in biological phosphorus removal process. To better understand the physicochemical properties of EPS in the biological phosphorus removal system, two types of EPS taken from the systems that operated complete aerobically with little phosphorus removal ability (R1) and alternative anaerobically/aerobically with excellent phosphorus removal efficiency (R2) were studied. Results showed that protein was predominant in the EPS of R2, while the EPS from R1 was dominated by polysaccharides. Protein-like fluorophores and fulvic acid-like fluorophores were the main EEM spectra in both EPS types, whereas the fluorescence intensity of protein-like substances in R2 was higher than that of R1 at the end of aerobic phase. The content of Ca2+was higher than Mg2+in R1, while it was opposite in R2. Meanwhile, the average value of Ca2+in R1 was 8.67mg/g-MLSS, higher than that of R2 (2.40mg/gMLSS) and the TP contents of R2 (21.65mg/gMLSS) was much higher than that in R1 (13.83mg/gMLSS) at the end of aeration. In addition, the zeta potential of R1 (-35mV) was more negative than that in R2 (-23mV).These results demonstrated that the characteristics of EBPR system was different from the complete-aerobic sludge system.
enhanced biological phosphorons removal;extracellular pohymeric substances;three-dimensional excitation-emission matrix;metal cations;zeta potential
X703.1
A
1000-6923(2014)11-2838-06
王然登(1985-),女,河南洛阳人,哈尔滨工业大学博士研究生,主要从事污水生物除磷及好氧颗粒污泥研究.发表论文4篇.
2014-02-28
国家“863”项目
* 责任作者, 教授, pyz@bjut.edu.cn
