全自养脱氮颗粒污泥的培养及脱氮性能的恢复与强化
2014-04-28张代钧丁佳佳重庆工程职业技术学院矿业与环境工程学院重庆40007重庆大学环境科学系重庆40000重庆市环境科学研究院重庆401147
蔡 庆,张代钧,丁佳佳(1.重庆工程职业技术学院,矿业与环境工程学院,重庆 40007;.重庆大学环境科学系,重庆 40000;.重庆市环境科学研究院,重庆 401147)
全自养脱氮颗粒污泥的培养及脱氮性能的恢复与强化
蔡 庆1*,张代钧2,丁佳佳3(1.重庆工程职业技术学院,矿业与环境工程学院,重庆 400037;2.重庆大学环境科学系,重庆 400030;3.重庆市环境科学研究院,重庆 401147)
采用交替限氧-厌氧和低充放比(30%)运行模式,在SBR反应器中成功启动全自养脱氮(CANON)工艺,启动过程经历常规硝化主导阶段、短程硝化主导阶段和全自养脱氮阶段,总氮去除速率和总氮去除效率分别达到(312±15)mg/(L·d)和(71.2±4.3)%.培养得到的污泥中颗粒污泥(粒径≥300µm)和絮状污泥(粒径<300µm)体积分别占污泥总体积的39%和61%.在自养脱氮性能恶化的SBR反应器进水中长期添加适量N2H4,反应器脱氮性能得以恢复甚至强化,反应器总氮去除速率升高到(480±34)mg/(L·d),颗粒污泥的比例增加到污泥总体积的51%.
全自养脱氮;颗粒污泥;N2H4;恢复;强化
结合短程硝化和厌氧氨氧化的全自养脱氮(CANON)工艺[1]与传统的硝化反硝化工艺相比,理论上可节省62.5%的硝化需氧量和100%的反硝化需COD量,在处理高氨氮、低COD废水方面具有良好的应用前景[2-3].CANON工艺已在众多特定结构的反应器内得以实现[1,4-8],但富集的多为絮状污泥[1,6-8]或提供填料后附着生长的生物膜[4-5,9],培养CANON颗粒污泥的报道[10-11]并不多见.
相关研究报道表明,CANON工艺均能达到较高的氮去除速率和去除效率[2,8,12],但采用CANON工艺的污水处理厂运行不稳定导致出水硝态氮(NO3--N)升高、系统脱氮性能恶化的事件[2,13]常有发生,且常规的调控手段难以恢复系统性能.Joss等[2]报道了一个采用CANON工艺的污水处理厂稳定运行2a后出水NO3--N浓度从15mg/L逐步上升到200mg/L,不通过排泥无法洗脱亚硝酸盐氧化菌(NOB)[2,14];Cho等[13]在升流式生物膜反应器中启动CANON过程,总氮去除速率为350mg/(L·d),NO3--N产生量与NH4+-N去除量的比值高达0.47±0.26,减少曝气量无法降低此比值.N2H4具有生物毒性,对好氧氨氧化菌(AOB)和NOB存在抑制作用[15];N2H4又是厌氧氨氧化过程中间产物[16],添加适量N2H4可快速恢复NO2-对厌氧氨氧化的抑制[15],甚至强化厌氧氨氧化过程[17-18].Yao等[19]发现添加适量N2H4可在强化CANON系统自养脱氮性能的同时减少NO3-的产生,适宜的N2H4添加浓度为3.99mg/L.而N2H4对脱氮性能恶化的CANON系统的恢复作用目前几乎未见报道[19].本文在SBR反应器中采用交替限氧-厌氧模式保持适宜的充放比培养全自养脱氮颗粒污泥,转换为持续限氧模式系统脱氮性能恶化后,研究不同的策略特别是添加适量N2H4对CANON反应器的恢复和强化作用.
1 材料与方法
1.1 试验装置、污水及污泥
利用大高径比(内径11cm,高50cm,有效体积2.5L)的SBR反应器(SBR1、SBR2),控制低的充放比(30%)培养CANON颗粒污泥.反应器内的温度通过恒温水浴层控制在(31±1)℃;曝气段DO通过转子流量计控制.试验污水为人工合成废水,基质为(NH4)2SO4,以NaHCO3为无机碳源(浓度1.5g NaHCO3/L),微量元素参考相关文献报道[20-21]分2类配置(微量元素液Ⅰ和微量元素液Ⅱ),微量元素液Ⅰ的组分为(g/L):EDTA,15.0; (NH4)6Mo7O24·4H2O,1.1;MnCl2·4H2O,0.99; CaCl2· 2H2O,4.2;CoCl2·6H2O,0.24;H3BO4,0.014;微量元素液Ⅱ的组分为(g/L):MgSO4·7H2O,5.0; FeSO4· 7H2O,5.0;ZnSO4·7H2O,0.43; CuSO4·5H2O, 0.25; NiSO4.6H2O,0.21.1L合成废水各加入1.25mL微量元素液Ⅰ和微量元素液Ⅱ.反应器SBR1接种污泥取自重庆市某污水处理厂和实验室EGSB反应器[22];反应器SBR2的接种污泥取自成功启动CANON工艺后的SBR1反应器.
1.2 试验方案
反应器SBR1采用交替限氧-厌氧运行模式启动CANON过程,运行周期240min,其中进水12min、限氧曝气138min、厌氧66min、沉淀12min、出水12min;每周期进水0.75L,使充放比保持在30%;限氧曝气段通过玻璃转子流量计控制曝气速率使DO保持在0.2~0.4mg/L;反应器启动的各个阶段选定典型运行周期,测定NH4+-N、NO2--N、NO3--N浓度、DO浓度和pH值的变化,同时观察污泥形态,并测定粒径分布.反应器SBR2采用与SBR1相同的交替限氧-厌氧运行模式快速启动CANON过程,稳定运行33d后,转换为持续限氧模式,脱氮性能恶化后研究CANON系统的恢复策略.持续限氧模式运行周期90min,其中进水5min、限氧曝气76min、沉淀4min、出水5min.SBR2反应器的运行分为7个阶段:第Ⅰ阶段(1~33d),交替限氧-厌氧模式稳定运行;第Ⅱ阶段(34~80d),持续限氧模式运行;第Ⅲ阶段(81~87d),进水添加少量NO2-并排泥;第Ⅳ阶段(88~95d),进水添加NO2-、降低曝气量并排泥;第Ⅴ阶段(96~104d),降低曝气量并排泥;第Ⅵ阶段(105~119d),进水添加N2H4并增加曝气量;第Ⅶ阶段(120~188d),进水添加N2H4并保持适宜的曝气量.SBR2反应器各阶段的运行条件详见表1.
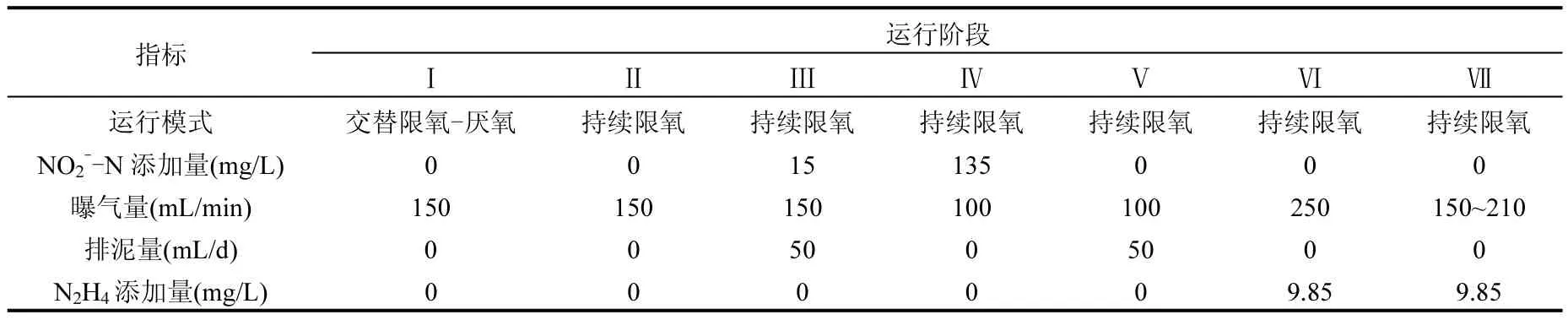
表1 反应器SBR2的运行条件Table 1 The operational conditions of SBR2
1.3 分析方法
pH值采用pH在线电极(pH2100e, METTLER TOLEDO)测定,DO采用便携式溶氧仪(JPBJ-608,上海精科)测定;污泥粒径采用激光粒度分析仪(S3500,美国Microtrac公司)测定;采用透反偏光显微镜(XPV-600E,上海长方光学仪器有限公司)对污泥形态进行观察;NH4+-N、NO2--N和NO3--N浓度的测定均采用文献[23]方法;N2H4浓度采用分光光度法测定[24],NO2-的干扰通过添加5%的氨基磺酸消除[25].理想的CANON系统(不存在NOB)中NO3--N产生量与NH4+-N去除量的比值为0.11[14],硝化系统中为1,NO3--N产生量与NH4+-N去除量的比值越高表明CANON系统NOB的活性越好,因此本文采用NO3--N产生量与NH4+-N去除量的比值这一指标评价CANON系统的稳定性[19].
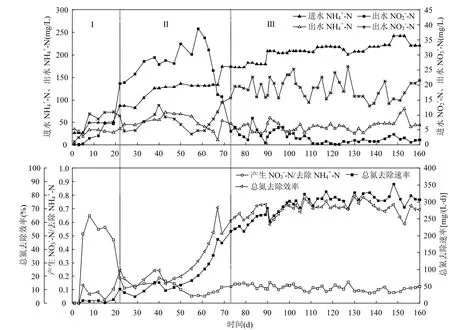
图1 SBR1反应器脱氮性能Fig.1 The nitrogen removal rate in SBR1
2 结果与讨论
2.1 反应器运行效果
由图1可知,CANON工艺的启动过程经历3个阶段:常规硝化主导阶段、短程硝化主导阶段和全自养脱氮阶段.从启动第1d到第22d为常规硝化主导阶段(图1Ⅰ),此阶段氧化的NH4+-N大部分转化为NO3--N,仅有少量的NO2--N积累,几乎不存在总氮去除,表明此阶段的主导微生物过程为常规硝化过程.从启动第23d到第73d为短程硝化主导阶段(图1Ⅱ),此阶段第34d的典型运行周期内NH4+-N、NO2--N、NO3--N浓度、DO浓度和pH值的变化见图2.此阶段NO2--N大量积累,出水NO3--N浓度较低(图1Ⅱ和图2),表明NOB的生长受到抑制;曝气段短程硝化消耗碱度使pH值降低,厌氧段厌氧氨氧化产生碱度使pH值略有升高(图2);总氮去除速率和总氮去除效率均逐步升高(图1Ⅱ),表明厌氧氨氧化菌(ANAOB)开始生长繁殖.从启动第74d到第160d为全自养脱氮阶段(图1Ⅲ),此阶段第103d的典型运行周期内NH4+-N、NO2--N、NO3--N浓度、DO浓度和pH值的变化见图3.此阶段NO2--N积累现象消失(图1Ⅲ),典型运行周期内NH4+-N迅速降低,NO3--N浓度略有升高;曝气段pH值略微降低,短程硝化消耗碱度和厌氧氨氧化产生碱度几乎达到平衡;厌氧段厌氧氨氧化产生碱度使pH值显著升高(图2).反应器内总氮去除速率稳定在312mg/(L·d)左右,高于任宏洋等[22]和Sliekers等[1]报道的CANON絮状污泥的总氮去除速率,但低于Vlaeminck等[11]和De Clippeleir等[10]培养的CANON颗粒污泥总氮去除速率.
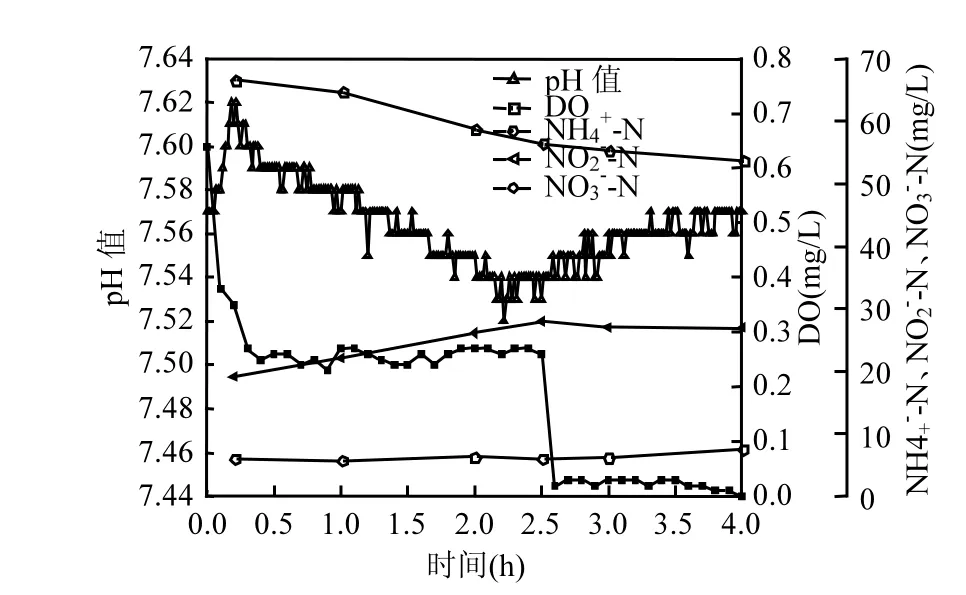
图2 短程硝化主导阶段典型运行周期内(第34d)NH4+浓度、NO2-浓度、NO3-浓度、DO浓度和pH值变化Fig.2 Variations of NH+concentration, NO-42concentration, NO3-concentration, DO and pH during a typical cycle at partitial-nitritationleading phase on day 34
全自养脱氮工艺启动历经的三个阶段与反应器内微生物演替过程相对应.接种污泥中AOB和NOB为其主导微生物,硝化过程为其主导微生物过程;限氧条件下运行使NOB受到抑制,短程硝化逐渐成为主导微生物过程;运行后期AOB和ANAOB成为反应器中的主导微生物,二者协同作用完成自养脱氮.
AOB中存在NO2-还原酶(Nir)和NO还原酶(Nor),可在氧化NH4+的同时还原NO2-和NO3-进行反硝化[26],进而完成氮去除,且硝化菌反硝化在限氧条件下更易发生[26-27],因此AOB的硝化菌反硝化现象也可能对SBR1反应器中的总氮去除存在贡献.SBR1反应器第Ⅲ阶段中NO3--N产生量与NH4+-N去除量的比值为0.105±0.021 (图1Ⅲ,取113~160d的平均值),与CANON系统的理论值(0.11)[14]接近,表明反应器中氮去除主要由ANAOB完成.
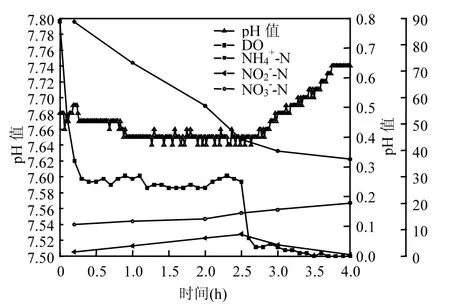
图3 全自养脱氮阶段典型运行周期内(第103d)NH4+浓度、NO2-浓度、NO3-浓度、DO浓度和pH值变化Fig.3 Variations of NH+concentration, NO-42concentration, NO3-concentration, DO and pH during a typical cycle at CANON phase on day 103
2.2 污泥的形态特征
50倍放大的光学显微镜观察结果显示,反应器SBR1初始接种污泥(第1d)为絮状(图4b),体积平均粒径为91.28μm,粒径呈正态分布(图4a);经过34d的培养,短程硝化主导阶段污泥粒径增加到108.8μm,粒径分布见图4c,污泥形态未发生明显变化,仍为絮状(图4d);第103d反应器处于全自养脱氮阶段,污泥体积平均粒径达到387.6μm,污泥粒径分布出现明显的双峰(图4e),表明反应器中存在两种形态的污泥,一种为粒径在15~300μm之间的絮状污泥,占污泥总体积的61%;另一种为粒径在300~1600μm之间的颗粒污泥,平均粒径在1mm左右,占污泥总体积的39%.显微照片观察也发现了絮状污泥(图4f)和颗粒污泥(图4g、4h),与粒径分布测试结果一致.显微照片中颗粒污泥呈暗红色,与De Clippeleir等[10]的报道一致.絮状污泥(图4f)也存在明显的红色区域,表明培养的污泥中存在丰富的ANAOB[10].
强烈的水力选择压力是CANON颗粒污泥形成的先决条件[28];但过高的水力选择压力又会洗脱反应器内生长缓慢的ANAOB,因此保持合适的最小沉降速率和充放比显得尤为重要[10], Vlaeminck等[11]控制低的充放比(25%)成功培养出与本文相似的CANON颗粒污泥和絮状污泥的混合物,颗粒污泥平均粒径1.8mm,占污泥总体积的57%;100μm以下的絮状污泥占污泥总体积的43%.
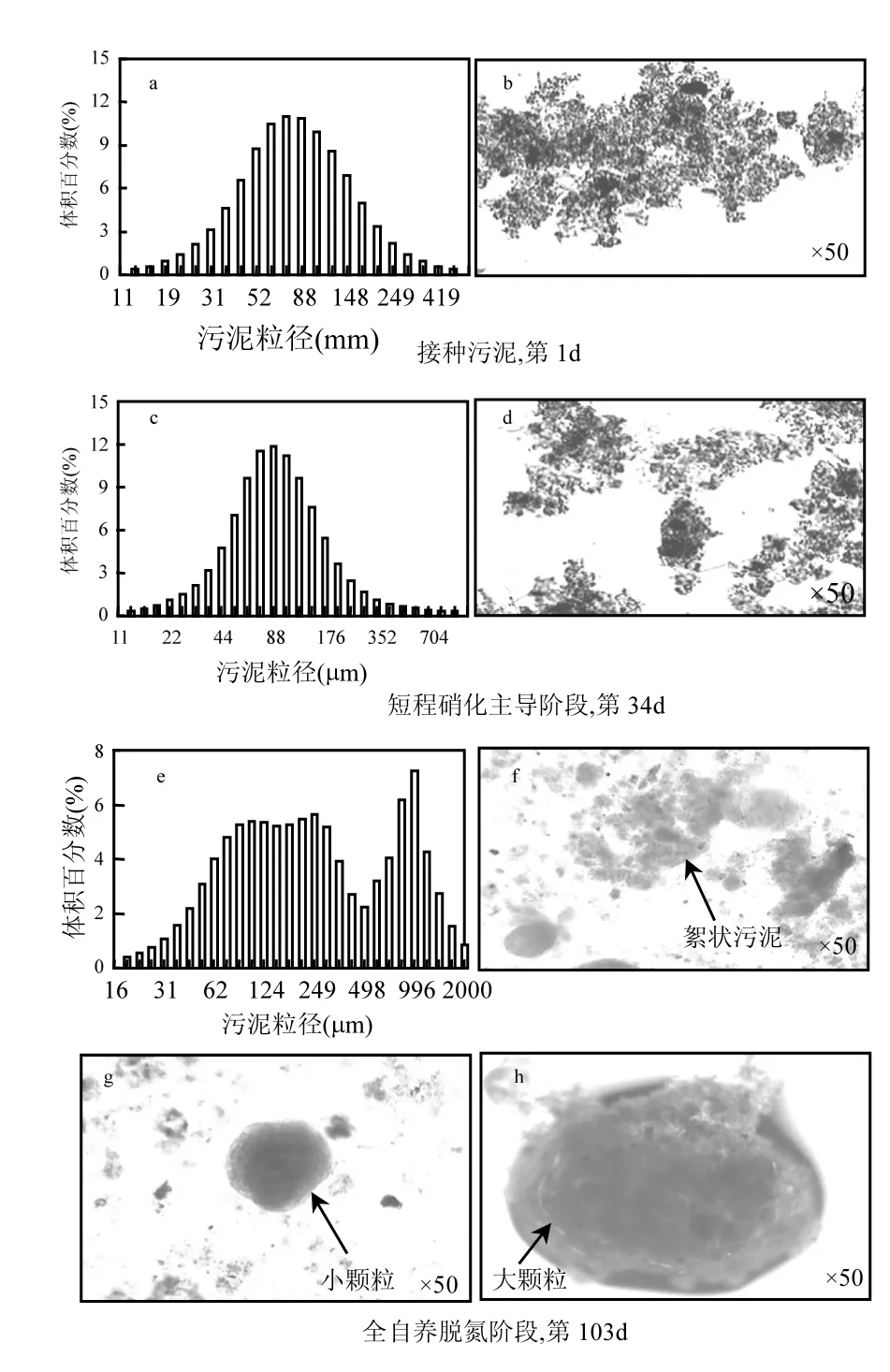
图4 不同阶段污泥粒径分布和显微照片Fig.4 Granule size distribution and micrograph of sludge at different phases
2.3 反应器脱氮性能的恢复与强化
反应器SBR2中,以交替限氧-厌氧模式运行的第Ⅰ阶段(图5Ⅰ,1~33d),总氮去除平均速率为(283±18)mg/(L·d),总氮去除平均效率为(65.0± 6.3)%,略低于反应器SBR1;NO3--N产生量与NH4+-N去除量的比值在0.128左右,接近理论值0.11,表明此阶段SBR系统运行良好.
第Ⅱ阶段(图5Ⅱ,34~80d),将交替限氧-厌氧模式转换为持续限氧模式,出水NO3--N浓度逐步升高,总氮去除速率和总氮去除效率均逐步降低.第80d出水NO3--N浓度高达92.9mg/L,总氮去除速率为156mg/(L·d),总氮去除效率仅为29.7%,此时ANAOB活性受到抑制,常规硝化过程逐渐成为系统的主导微生物过程,系统脱氮性能恶化.
第Ⅲ阶段(图5Ⅲ,81~87d),在进水中添加15mg/L左右的NO2--N并每天排泥,总氮去除速率和总氮去除效率比第Ⅱ阶段略有降低,出水NO3--N浓度仍保持在较高水平,NO3--N产生量与NH4+-N去除量的比值(0.49左右)变化不显著,仍远高于0.11,系统脱氮性能未得到恢复.
第Ⅳ阶段(图5Ⅳ,88~95d),进水中添加135mg/L左右的NO2--N,曝气段曝气量降低至100mL/min,同时每天排泥.此阶段由于进水添加了大量的NO2-基质,同时曝气量减少,大大降低了DO对ANAOB的抑制,系统总氮去除速率最高达428mg/(L·d),但出水NO3--N浓度进一步升高,NO3--N产生量与NH4+-N去除量的比值有所升高(0.55左右),表明此策略仍无法有效抑制NOB的生长.
第Ⅴ阶段(图5Ⅴ,96~104d),曝气段曝气量保持在100mL/min,每天排泥50mL.系统总氮去除效率和总氮去除速率均显著降低,NO3--N产生量与NH4+-N去除量的比值(0.48左右)仍远高于0.11,表明系统NOB并未得到有效抑制.DO是控制全自养脱氮工艺启动与运行的关键因子[3].DO可逆抑制厌氧氨氧化过程[29],同时对AOB和NOB影响显著.絮状CANON污泥系统中DO浓度超过0.2mg/L时,ANAOB活性受到抑制,导致NO2-积累,但ANAOB活性在停止曝气数分钟内迅速恢复[2].第Ⅴ阶段实验结果显示,在持续限氧运行模式下,系统脱氮性能恶化后,随着DO(0.1mg/L以下)浓度的降低,总氮去除速率迅速降低,表明虽然DO对ANAOB的抑制作用得到缓解,但DO降低导致AOB的生长代谢受到抑制,NO2-产生速率过低,ANAOB仍受到抑制.第Ⅵ阶段(图5Ⅵ,105~119d),向反应器进水中添加9.85mg/L的N2H4,曝气量增加到250mL/min,此时SBR2曝气段的DO浓度升高到0.4mg/L左右.此阶段总氮去除速率有所升高,出水NO3-浓度增加,但这一阶段末期NO3--N产生量与NH4+-N去除量的比值出现降低趋势.
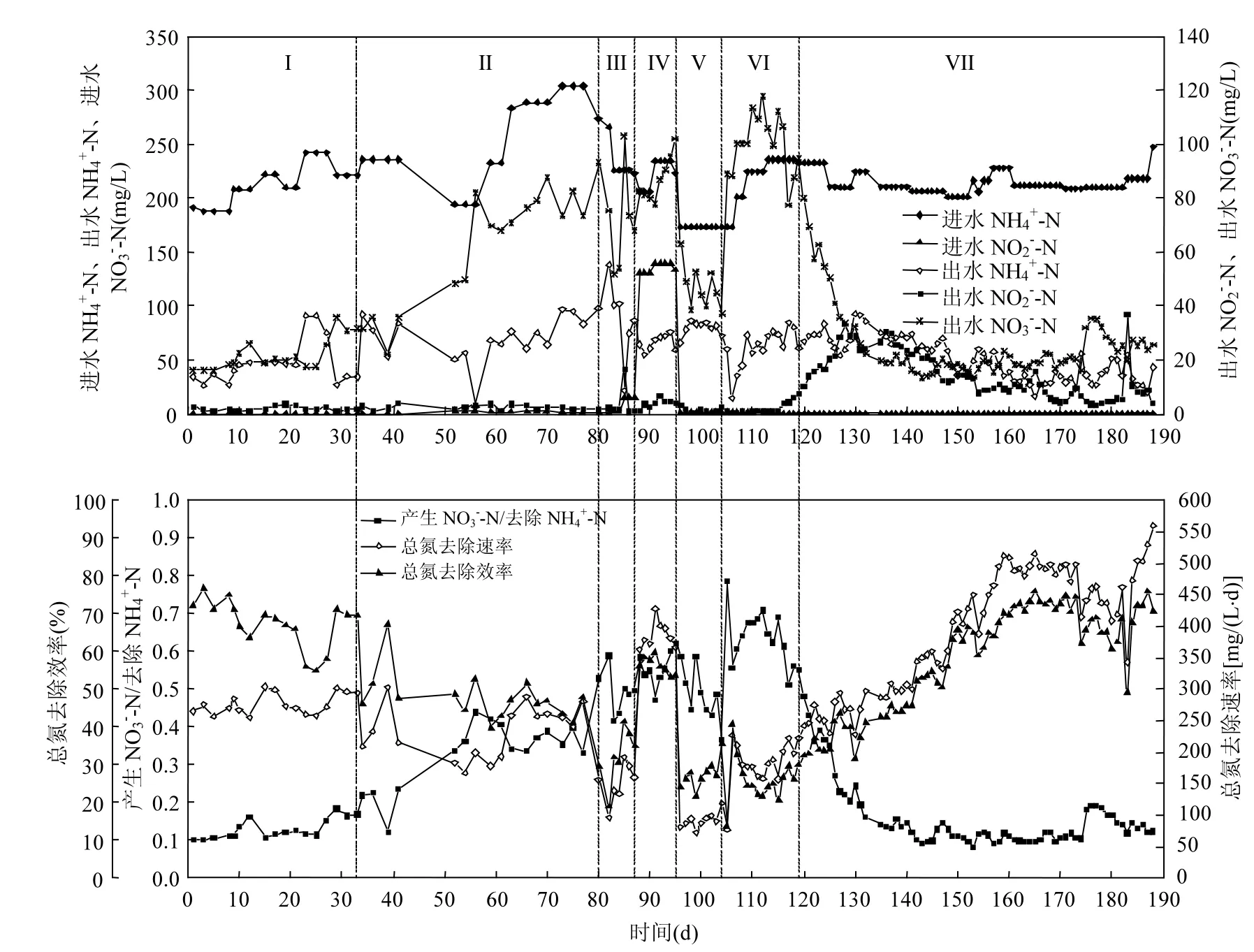
图5 不同恢复策略下SBR2反应器的性能Fig.5 The performances of SBR2 with different recovery strategies
第Ⅶ阶段(图5Ⅶ,120~188d),反应器进水中添加9.85mg/L N2H4,先将曝气量降低到150mL/min,再逐步升高到230mL/min,最终稳定在210mL/min.此阶段出水NO3-浓度逐步降低,NO3--N产生量与NH4+-N去除量的比值迅速降低,最终稳定在0.12左右,与全自养脱氮NO3--N产生量与NH4+-N去除量的理论比值(0.11)接近,表明系统中NOB活性受到抑制.此阶段前期出现NO2-的积累,随后虽然逐步增大曝气量,出水NO2-却降到较低水平;系统总氮去除速率和去除效率均逐步增加,总氮去除速率由第120d的242mg/(L·d)上升到188d的560mg/(L·d),总氮去除效率由第120d的32.5%逐步上升到188d的70.7%.N2H4作用下持续限氧运行模式获得的平均总氮去除速率为(480±34)mg/(L·d),远高于SBR1反应器交替限氧-厌氧模式下的总氮去除速率;平均总氮去除效率为(69.3±5.4)%(取158~188d稳定运行数据的平均值),系统自养脱氮性能得以恢复并强化.SBR2反应器运行第Ⅶ阶段第186d粒径分布结果见图6,污泥显微照片与图4全自养脱氮阶段类似(未给出). 污泥体积平均粒径增加到481.5μm,污泥粒径分布仍出现明显的双峰特征,粒径在300μm以上的颗粒污泥占污泥总体积的51%.添加N2H4强化后的污泥体积平均粒径和颗粒污泥占污泥总体积的比例均有所增加.
持续限氧模式运行理论上可比交替限氧-厌氧模式获得更高的总氮去除速率,但运行模式改变后系统总氮去除性能恶化(SBR2反应器的第Ⅰ、Ⅱ阶段),表明交替限氧-厌氧模式比持续限氧模式更有利于CANON工艺的稳定运行;进水添加NO2-、降低曝气量和排泥等常规策略(第Ⅲ、Ⅳ、Ⅴ阶段)均不能恢复SBR2的自营养脱氮性能;进水长期添加N2H4(第Ⅵ、Ⅶ阶段),自营养脱氮性能得以迅速恢复甚至强化.N2H4强化的反应器SBR2获得总氮去除速率在480mg/(L·d)左右,远高于采用交替限氧-厌氧模式运行的SBR1反应器的总氮去除速率.
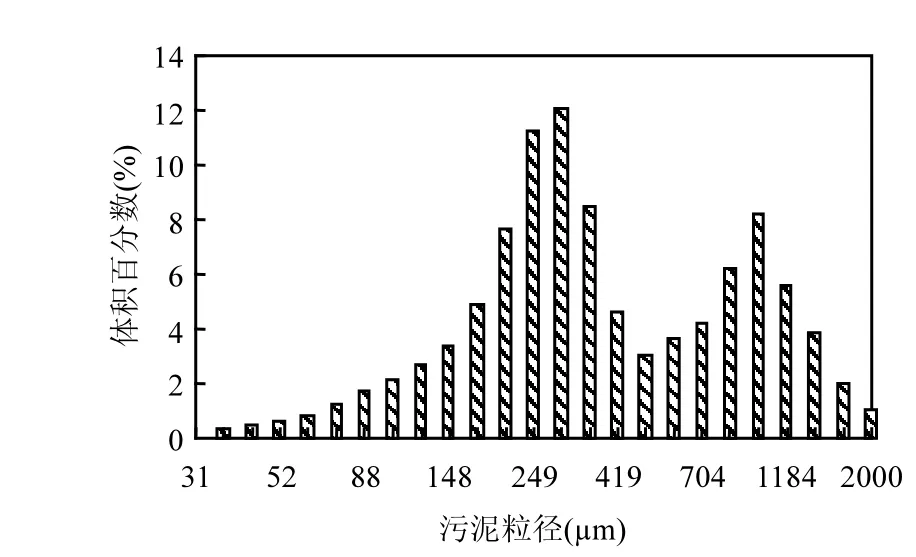
图6 SBR2反应器添加N2H4强化后污泥粒径分布(第186d)Fig.6 Granule size distribution with N2H4addition on day 186 in SBR2
N2H4具有生物毒性,对AOB和NOB均存在抑制作用[15].好氧氨氧化过程中,NH4+在AMO酶的作用下首先氧化为NH2OH,然后NH2OH在HAO酶的作用下氧化为NO2-,而N2H4和NH2OH均可作为HAO酶的基质,因此N2H4强烈竞争性抑制HAO催化氧化NH2OH[18,30],从而抑制AOB活性.反应器SBR2进水长期添加N2H4时,自营养脱氮系统中NOB活性几乎被完全抑制,总氮去除速率反而有所增加,似乎表明N2H4对AOB的抑制作用并不明显,且远低于NOB.N2H4抑制AOB和NOB的动力学特性还需进一步研究[19].
N2H4是厌氧氨氧化中间产物,N2H4在联氨脱氢酶(HDH)作用下脱氢氧化释放出的能量可用于ANAOB的合成代谢[16],同时其释放出的电子(-0.75V)可通过铁氧化还原蛋白(FD)转移到乙酰辅酶A合成酶/CO脱氢酶中用于固碳[31],外部添加N2H4可提供更多的能量和电子用于细胞合成,促进ANAOB的生长[19],而ANAOB是CANON系统脱氮的主要功能微生物,因此CANON系统中添加N2H4可加速恢复甚至强化自养脱氮性能.
3 结论
3.1 SBR反应器中交替限氧-厌氧模式下保持低的充放比(30%)成功启动CANON过程,启动经历常规硝化主导阶段、短程硝化主导阶段和全自养脱氮阶段,总氮去除速率达到(312±15)mg/(L·d),总氮去除效率为(71.2±4.3)%;培养得到颗粒污泥和絮状污泥混合物,颗粒污泥(粒径≥300μm)占污泥总体积的39%,絮状污泥(粒径<300μm)占污泥总体积的61%.
3.2 在脱氮性能恶化的以持续限氧模式运行的全自养脱氮 SBR反应器进水中添加适量N2H4,可有效抑制NOB的活性,加速自养脱氮性能恢复,系统的总氮去除速率增加到(480±34)mg/(L·d).颗粒污泥(粒径≥300μm)占污泥总体积的比例增加到51%.
[1] Sliekers A O, Derwort N, Gomez J L C , et al. Completely autotrophic nitrogen removal over nitrite in one single reactor [J]. Water Research, 2002,36(10):2475-2482.
[2] Joss A, Derlon N, Cyprien C, et al. Combined nitritationanammox: Advances in understanding process stability [J]. Environmental Science and Technology, 2011,45(22):9735-9742.
[3] 蔡 庆,张代钧,肖芃颖,等.完全自营养脱氮过程中的影响因素[J]. 环境工程学报, 2013,7(10):3895-3899.
[4] Siegrist H, Reithaar S, Koch G, et al. Nitrogen loss in a nitrifying rotating contactor treating ammonium-rich wastewater without organic carbon [J]. Water Science and Technology, 1998,38(8): 241-248.
[5] Pynaert K, Smets B F , Wyffels S, et al. Characterization of an autotrophic nitrogen-removing biofilm from a highly loaded lab-scale rotating biological contactor [J]. Applied and Environmental Microbiology, 2003,69(6):3626-3635.
[6] Zhang Z J , Chen S H , Wu P , et al. Start-up of the Canon process from activated sludge under salt stress in a sequencing batch biofilm reactor (SBBR) [J]. Bioresource Technology, 2010, 101(16):6309-6314.
[7] Jeanningros Y, Vlaeminck S E, Kaldate A, et al. Fast start-up of apilot-scale deammonification sequencing batch reactor from an activated sludge inoculum [J]. Water Science and Technology, 2010,61(6):1393-1400.
[8] Wett B. Solved upscaling problems for implementing deammonification of rejection water [J]. Water Science and Technology, 2006,53(12):121-128.
[9] 廖德祥,李小明,曾光明,等.单级SBR生物膜中全程自养脱氮的研究 [J]. 中国环境科学, 2005,25(02):222-225.
[10] De Clippeleir H, Vlaeminck S E, Carballa M, et al. A low volumetric exchange ratio allows high autotrophic nitrogen removal in a sequencing batch reactor [J]. Bioresource Technology, 2009,100(21):5010-5015.
[11] Vlaeminck S E, Cloetens L F F, Carballa M, et al. Granular biomass capable of partial nitritation and anammox [J]. Water Science and Technology, 2009,59(3):609-617.
[12] Siegrist H, Salzgeber D, Eugster J, et al. Anammox brings WWTP closer to energy autarky due to increased biogas production and reduced aeration energy for N-removal [J]. Water Science and Technology, 2008,57(3):383-388.
[13] Cho S, Fujii N, Lee T, et al. Development of a simultaneous partial nitrification and anaerobic ammonia oxidation process in a single reactor [J]. Bioresource Technology, 2011,102(2):652-659.
[14] Joss A, Salzgeber D, Eugster J, et al. Full-Scale Nitrogen removal from digester liquid with partial nitritation and anammox in one SBR [J]. Environmental Science and Technology, 2009,43(14): 5301-5306.
[15] Strous M, Kuenen J G, and Jetten M S M. Key physiology of anaerobic ammonium oxidation [J]. Applied and Environmental Microbiology, 1999,65(7):3248-3250.
[16] Kartal B, Maalcke W J, de Almeida N M, et al. Molecular mechanism of anaerobic ammonium oxidation [J]. Nature, 2011, 479(7371):127-130.
[17] Hu A, Zheng P, Mahmood Q, et al. Characteristics of nitrogenous substrate conversion by anammox enrichment [J]. Bioresource Technology, 2011,102(2):536-542.
[18] Zakker I, Kroon K, Rikmann E, et al. Accelerating effect of hydroxylamine and hydrazine on nitrogen removal rate in moving bed biofilm reactor [J]. Biodegradation, 2012,23(5):739-749.
[19] Yao Z B, Cai Q, Zhang D J, et al. The enhancement of completely autotrophic nitrogen removal over nitrite (CANON) by N2H4addition [J]. Bioresource Technology, 2013,146:591-596.
[20] Kuai L, Verstraete W. Ammonium removal by the oxygen-limited autotrophic nitrification-denitrification system [J]. Applied and Environmental Microbiology, 1998,64(11):4500-4506.
[21] Kimura Y, Isaka K, Kazama F. Effects of inorganic carbon limitation on anaerobic ammonium oxidation (anammox) activity [J]. Bioresource Technology, 2011,102(6):4390-4394.
[22] 任宏洋,张代钧,丛丽影.EGSB反应器中实现完全自营养脱氮与运行优化 [J]. 环境科学, 2009,30(5):1454-1460.
[23] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[24] Watt G W and Chrisp J D. Spectrophotometric method for determination of hydrazine [J]. Analytical Chemistry, 1952,24(12): 2006-2008.
[25] George M, Nagaraja K, Balasubramanian N. Spectrophotometric determination of hydrazine [J]. Talanta, 2008,75(1):27-31.
[26] Schmidt I, van Spanning R J M, Jetten M S M. Denitrification and ammonia oxidation by Nitrosomonas europaea wild-type, and NirK- and NorB-deficient mutants[J]. Microbiology-Sgm, 2004,150:4107-4114.
[27] Zhang D J, Cai Q, Zu B, et al. The influence of trace NO2on the kinetics of ammonia oxidation and the characteristics of nitrogen removal from wastewater[J]. Water Science and Technology, 2010,62(5):1037-1044.
[28] Liu Y, Wang Z W, Qin L, et al. Selection pressure-driven aerobic granulation in a sequencing batch reactor [J]. Applied Microbiology and Biotechnology, 2005,67(1):26-32.
[29] Strous M, vanGerven E, Kuenen J G, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing (Anammox) sludge[J]. Applied and Environmental Microbiology, 1997,63(6):2446-2448.
[30] Hooper A B and Terry K. Hydroxylamine oxidoreductase of Nitrosomonas: production of nitric oxide from hydroxylamine [J]. Biochim. Biophys. Acta, 1979,571(1):12-20.
[31] Strous M, Pelletier E, Mangenot S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome [J]. Nature, 2006,440(7085):790-794.
The cultivation of completely autotrophic nitrogen removal over nitrite granular sludge and the recovery and enhancement of nitrogen removal.
CAI Qing1*, ZHANG Dai-jun2, DING Jia-jia3(1.Mining and Environmental Engineering, Chongqing Vocational Institute of Engineering, Chongqing 400037, China;2.Department of Environmental Science, Chongqing University, Chongqing 400030, China;3.Chongqing Academy of Environmental Science, Chongqing 401147, China). China Environmental Science, 2014,34(11):2805~2812
Complete autotrophic nitrogen removal over nitrite (CANON) process was successfully startedup with a low volumetric exchange ratio (30%) under alternative limited-oxygen/anaerobic mode in SBR, and the total nitrogen removal rate as well as the total nitrogen removal efficiency reached (312±15)mg/(L·d) and (71.2±4.3)%, respectively. The startup of CANON SBR experienced nitrification-leading phase, partitial-nitritation-leading phase and CANON phase in general. Granular biomass and floccular biomass were both found in SBR. The volume of granular biomass (radius≥300µm) and floccular biomass (radius<300µm) made up 39% and 61% of total sludge volume, respectively. The long-term N2H4addition recovered and enhanced their autotrophic nitrogen removal capacity, with the total nitrogen removal rate increased to (480±34)mg/(L·d). The proportion of granular biomass increased to 51% of total sludge volume.
completely autotrophic nitrogen removal;granular sludge;N2H4;recovery;enhancement
X703
A
1000-6923(2014)11-2805-08
蔡 庆(1985-),男,湖北荆门人,讲师,博士,主要从事废水处理理论与技术方面的研究.发表论文8篇.
2014-02-12
国家自然科学基金资助项目(51078365);重庆市教委科学技术研究项目(KJ1403202)
* 责任作者, 讲师, cai-q1985@163.com
