藻源性黑水团环境效应Ⅲ:对水-沉积物界面处Fe-S-P循环的影响
2014-04-28刘国锋,范成新,张雷等
藻源性黑水团环境效应Ⅲ:对水-沉积物界面处Fe-S-P循环的影响
刘国锋1,2,3,范成新2*,张 雷2,申秋实2,王兆德2,韩士群3**(1.中国水产科学研究院淡水渔业研究中心,江苏无锡 21408;2.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008;3.江苏省农业科学院农业资源与环境研究所,江苏 南京 210014)
利用静态模拟实验装置研究了藻源性黑水团发生过程中沉积物表层上覆水和沉积物间隙水中 Fe-S-P的变化过程.结果表明:加入藻细胞后很快形成厌氧、还原环境,使得沉积物中Fe-S-P发生强烈的生物地球化学变化;实验第1d,表层上覆水中的Fe2+、SO42-、S2-含量高达4.993,242.0,387.57mg/L,为对照样柱中的1.8倍、2.2倍和18.8倍;在沉积物4cm处其浓度分别为8.5,40.0,65.3mg/L.随后,沉积物表层上覆水中 Fe2+、S2-含量表现出一个先快速增加、随后降低的趋势,其浓度分别在实验的第 3,2d达到最大值为 11.1,634.6mg/L. 沉积物中PO43--P浓度受Fe-P解析等具有滞后性,从实验的第2d后开始直至实验结束时表现为其含量持续增加,到实验结束时其浓度为39.450mg/L,为对照样柱中的242倍.上覆水和间隙水中Fe-S-P含量的变化,反映了藻华聚集形成的厌氧环境中发生了剧烈的生物地球化学反应,从而使得沉积物中形成的Fe2+、S2-和 PO43--P不断向上覆水体中扩散,对形成黑水团的水体生态系统的恢复造成阻碍和不良影响.
黑水团;水-沉积物界面;铁硫磷循环;环境效应
2007年无锡太湖南泉水厂和2008年太湖竺山湖发生的大面积藻源性黑水团现象[1]造成了严重的水危机事件[2].藻源性黑水团现象的发生,也使得蓝藻水华对水体的污染产生了质的变化.虽然藻源性黑水团现象在国外部分湖泊及河流中有过较早出现[3-4],在国内众多河道受到严重的工农业污染产生“黑臭”现象[5],但在像太湖水体出现大面积藻源性黑水团现象尚不多见.
藻源性黑水团现象是由于藻细胞大量堆积、受高温和溶氧影响快速沉降到沉积物表面死亡后引起的.在该过程中往往会出现一个藻类快速死亡过程,沉积物表面处的溶解氧和氧化还原电位将会出现快速的变化.Fe、S、P作为重要的生物地球化学元素,其在生源要素的生物地球化学循环中占有重要地位,同时因其对周围环境条件的变化较为敏感和相互关系较为密切[6];且在水体富营养化中磷还是重要营养元素之一[7],在各种水体和沉积物的研究中都处于较为突出的地位. 藻体细胞沉降、死亡后引起局部水体处于强还原状态[3,8],沉积物中对氧化还原电位影响较为敏感的 Fe-P(铁结合态磷)会出现解析而向上覆水体中释放磷酸根;同时沉积物环境处于还原状态,将会使硫元素向低价态转化,在沉积物中富集比平常高得多的 S2-;由于其具有挥发性,将产生含硫气体(如H2S等)对水体生态环境造成危害[3].
藻源性黑水团是一种新的水污染现象,目前缺少对其相应的认识,同时加之缺少相应的模拟手段,对藻源性黑水团现象在发生过程中相关生源要素循环变化的研究较少.因此深入了解Fe、S、P在藻源性黑水团现象发生过程中的循环变化,对认识和揭示藻源性黑水团现象的环境效应具有重要意义.本文以从太湖发生过黑水团区域采集原状湖水、沉积物和新鲜藻体为实验材料,利用自制静态模拟装置研究藻体大量堆积、死亡过程中对水~沉积物界面处 Fe、S、P含量变化的影响,以期为了解和明确藻源性黑水团现象发生机理及其产生的严重环境后果提供理论依据.
1 材料及方法
1.1 实验材料
为了减少人为影响及外界对实验效果的干扰,并能更好的与实际情况更符合,本实验中实验材料全部取自太湖鼋头渚附近样点(31°31′33.9″N, 120°12′35.2″E),用重力采样器采集若干扰动极小的柱状沉积物样,用橡胶塞密封保存;用浮游生物网现场捞取蓝藻细胞快速运回实验室.
1.2 实验方法
把取回的沉积物柱状样小心的切掉底层沉积物,保留表层 20cm的沉积物于管子中;同时保持表层底泥被上覆水覆盖以防氧化,然后在无扰动下添加上覆水的高度 30cm.随后把具有良好空气致密性的沉积物间隙水抽滤装置(Rhizon,荷兰)小心的插入每根管子中预留的小孔中,保证所取试验样品不受空气影响,每相邻两个小孔的垂直间隔距离为1cm.然后静置2h,以使保留在管子中的沉积物及上覆水达到一个动态平衡.整个实验温度控制在25℃±1℃.
把取回来的藻液小心的装入离心杯中,然后1500r/min离心 5min,去掉湖水,取出经过离心的新鲜藻体装入 3根沉积物柱状样中,每根柱子加藻量为25.0g;另取3根没有加藻的柱状沉积物设为对照组.从添加藻细胞开始,在 N2的保护下每天定时用Rhizon抽滤间隙水,用Eppendorf移液枪移取4mL水样于小离心管中,加入一滴1mol/L HCl溶液保存,用来测定间隙水中Fe2+和S2-的含量;做好编号后进行保存,实验结束后一并测试.根据上覆水中藻细胞的变化及水体发黑、发臭的程度确定实验进程.实验结束后,沉积物样品在N2保护下利用便携式氧化还原电位计(Eh)测定沉积物的氧化还原电位值,其他按照文献[9]所述的操作方法进行,每个处理3个平行.
1.3 样品分析
溶解性 Fe2+用 Ferrozine比色法测定[10];S2-的含量测定按照《水和废水监测分析方法》[11]测定;SO42-用离子色谱(Dionex~100)法测定. PO43--P含量采用注射式流动分析仪(Skalar-SA 3000/5000,Netherlands)测定.数据分析采用Excel 2007和SPSS19.0进行,绘图用Origin 8.0进行处理.实验结果以其平均值来表示,实验误差控制在10%以内,其他处理均同文献[9].
2 结果与分析
2.1 水-沉积物界面处Fe、P含量变化

图1 第1阶段水-沉积物界面处Fe2+、PO43--P含量变化Fig.1 Fe2+、PO43--P content changes in water-sediment interface during the first stage
加入藻细胞后,0~1cm处沉积物表层上覆水和沉积物中Fe2+与PO43--P含量变化情况可以分为两个阶段.第1阶段为实验的1~4d:沉积物表层0~1cm处的上覆水中Fe2+含量首先出现较为明显的变化(图1).在实验的第1d,沉积物表层上覆水中Fe2+含量就高达 4.993mg/L;而沉积物中不同深度下Fe2+含量表现为随深度增加其含量上升,在4cm深处含量最高,为 8.462mg/L,同期对照样中0~1cm、4cm 处 Fe2+含量分别为 2.706mg/L、6.691mg/L.根据加入藻细胞后对水-沉积物界面处溶氧含量的测定[9]可知,大量藻细胞沉降后会出现一个快速耗氧过程,同时在较高温度(25℃)作用下,水-沉积物界面处的微生物活性较高[12],也使得耗氧作用大大增加,加入藻细胞50min后水-沉积物界面处的溶氧就已消耗殆尽,从而使得表层沉积物处于厌氧状态.此时因Fe-P尚没有表现出明显的解析现象,在 0~1cm处沉积物表层上覆水及沉积物中PO43--P含量变化不是很大.到了实验的第2d,沉积物间隙水中Fe2+含量继续增加,而0~1cm处上覆水中 Fe2+含量反而有降低趋势;受氧化还原环境变化影响,沉积物中PO43--P含量已开始表现出增加趋势,在 1~2cm处已从第 1d的0.09mg/L增加为第2d的1.11mg/L,含量增加了11倍.到了实验的第3d,0~1cm处上覆水和沉积物中Fe2+含量变化较大,0~1cm处上覆水中Fe2+含量高达11.051mg/L,为同期对照样的4倍;沉积物4cm处Fe2+含量反而下降为0.979mg/L.实验进行到第4d,0~1cm处沉积物表层上覆水中 Fe2+含量下降,而沉积物中 Fe2+含量开始增加;同时,0~1cm处上覆水和沉积物间隙水中PO43--P含量表现为缓慢增加,到实验第4d时,上覆水中PO43--P含量高达4.485mg/L,1~4cm沉积物间隙水PO43--P含量分别增加为4.71,4.17,1.245,1.44mg/L,这种变化趋势可能是沉积物中 Fe-P在厌氧环境中出现缓慢的解析,同时结晶态的Fe氧化物向无机态的铁转化[13],且在厌氧条件下被还原为低价态的Fe向上覆水中快速扩散[2],使得0~1cm处上覆水中Fe2+含量快速增加;同时,间隙水中部分 Fe-P解析后以PO43--P形式通过浓度梯度向上覆水中扩散,相关分析表明,Fe2+含量变化与PO43--P含量具有显著相关性(r=0.742),从而引起上覆水中PO43--P含量增加.

图2 第2阶段水-沉积物界面处Fe2+、PO43--P含量变化Fig.2 Fe2+、PO43--P content changes in water-sediment interface during the second stage
实验进行到第2阶段(也即在加入藻细胞后第5d,图2),0~1cm处沉积物表层上覆水和沉积物间隙水中Fe2+含量有一定的波动变化,但上覆水中Fe2+含量基本处于4.00mg/L左右,在第6d为4.182mg/L,随后其含量开始下降;同时沉积物间隙水中Fe2+含量也表现下降趋势;同时上覆水中Fe2+与沉积物中厌氧还原后的S2-结合形成黑水沉淀,也降低了Fe2+在上覆水中的浓度.上覆水和沉积物间隙水中PO43--P含量表现为持续增加趋势,到实验结束时,上覆水中PO43--P含量高达39.450mg/L,为同期对照样和实验第1d时的242倍和7.9倍;1~4cm处间隙水中 PO43--P含量分别为 35.4,14.295,12.54, 10.74mg/L,分别为对照的71.7倍、9.4倍、7.9倍和4.2倍.这种快速增加的趋势表明在厌氧、强还原环境下沉积物中吸附态P发生了剧烈的解析反应,使得间隙水中大量的PO43--P向上覆水中扩散,造成表层水体中 PO43--P含量快速增加.这与Rozan[6]通过对沉积物中 Fe-S-P进行一年的研究结论相同,即厌氧条件下会使得可溶性Fe增加,同时会引起沉积物中的PO43--P向上覆水中释放,为藻华的再次发生提供了磷源.
2.2 水-沉积物界面处SO42-、S2-含量变化
加入藻细胞于表层沉积物第1d(图3),水-表层沉积物界面处已处于厌氧状态[9],0~1cm处上覆水中SO42-含量就高达242.0mg/L,0~4cm沉积物间隙水中SO42-含量分别为10,20,30,40,50mg/L,表现为随深度增加其含量递增的变化趋势,而同期对照样中的含量分别为 108,104,102,105,80mg/L,表现为从上覆水体到深层沉积物中逐渐递减的趋势.根据对照中 SO42-含量变化,可以看出加藻样柱的上覆水体中 SO42-含量出现一个极高值,而在沉积物间隙水中反而是表层沉积物中含量较低.

图3 第1阶段水-沉积物界面处S2-、SO42-含量变化Fig.3 S2-、SO42-content changes in water-sediment interface duing the first stage
有研究发现小球藻可以快速转运SO42-至其细胞中[14],当其细胞死亡、分解后可能释放出大量的 SO42-于水体中,造成沉积物表层上覆水体中 SO42-含量快速增加;加藻后的沉积物间隙水中出现与对照样相反的变化趋势,这种情况可能是因为藻细胞沉降到表层沉积物快速消耗掉溶氧后造成其在厌氧条件下快速还原而产生无机态的S2-,受SO42-的浓度影响,在其含量增加、特别是在厌氧条件下可以显著刺激SO42-的还原速率并能明显改变沉积物中碳、氮、磷、铁的环境地球化学行为[15];这与前面研究结果相同,也即在厌氧藻体分解过程中,沉积物间隙水中高价态铁以低价态 Fe2+离子形式并向上覆水体中扩散(图1、图2).随后沉积物及0~1cm沉积物表层上覆水中 SO42-含量开始表现出下降趋势,直至实验结束时均保持较低含量(图4).
加入藻细胞第1d,0~1cm处沉积物表层上覆水中S2-含量在加入藻细胞后其含量高达387.57mg/L,在5cm以上沉积物间隙水中则表现为随深度增加其含量升高.到实验第2d时,沉积物表层上覆水和沉积物间隙水中S2-含量开始持续增加,间隙水中、特别是在2cm深的沉积物中S2-含量增加迅速,上覆水中含量增加至634.62mg/L,1~4cm深沉积物间隙水中的 S2-含量分别为 766.44,1088.75,251.86, 393.23mg/L,分别为同期对照样中S2-含量的31倍、42倍、56倍、11倍、6倍.到实验的第3,4d,上覆水和沉积物间隙水中S2-都表现出下降趋势,0~1cm处沉积物上覆水中 S2-含量分别下降为 353.64, 291.44mg/L,而沉积物间隙水中 S2-含量都在105.0mg/L以下.

图4 第2阶段水-沉积物界面处S2-、SO42-含量变化Fig.4 S2-、SO42-content changes in water-sediment interface during the second stage
实验进行到第2阶段(实验的第5~8d,图4),上覆水体和沉积物间隙水中SO42-、S2-含量持续下降,同时沉积物中其他形态硫也转化为无机硫并以 S2-形式向表层沉积物中扩散[2,15].在加入藻体后形成的厌氧环境中,由于藻细胞残体沉降后形成了大量的有机质(以 CH2O表示),沉积物中的SO42-会出现如下反应[2,16]:

大量的SO42-的还原产生大量的HS-,从而使得表层沉积物及水体中S2-含量增加[3],而且输入的有机质对黑水团现象的发生程度及持续时间有很大的影响作用,也即在加入的藻体分解时,藻体细胞输入的有机质含量高,对 SO42-的还原及S2-的产生有较强的促进作用,在实验后期 SO42-的含量下降;但厌氧环境中硫细菌活性增强[17],可以产生以 S2-形式为主的硫化物.Burton等[18]研究发现,细菌还原作用下使得单独以 Fe3+还原为主转变为Fe3+和SO42-共同还原为主,可以产生大量的Fe2+和S2-.在沉积物中重金属与有机质、铁锰氧化物及硫化物的结合是其主要结合形态[19],在厌氧环境中,沉积物中发生还原反应后,部分重金属有可能变成游离态从而提高了沉积物中重金属的生态风险[15,19].
3 讨论
在像太湖这样风浪扰动强烈的大型浅水湖泊中[20-21],高温季节大量藻华的出现已经成为一种常见现象[22];而出现藻源性黑水团现象则使得其对水体的污染产生了质的变化.在太湖梅梁湾的观测发现,在 4月份就有藻细胞的大量聚集体出现,其群体直径可达到 30µm,其生物量常常超过 50mg/L[23],在适宜气象条件时就可以形成藻华并在适宜地点聚集后而形成黑水团现象[24].藻细胞在高温下大量聚集后,在细胞的代谢作用及微生物活动增强下,会很快消耗掉水体中的溶氧,从而造成水体和表层沉积物处于缺氧、甚至厌氧状态,使得沉积物表面出现一个从好氧到厌氧的快速转变过程,对上覆水和表层沉积物中生源要素的生物地球化学循环产生极大的影响[25].
利用室内模拟研究为快速、定量了解此种情况下沉积物间隙水和上覆水中相应物质循环变化的有效方法;本实验通过向沉积物表层上覆水体中加入 25.0g新鲜藻体模拟实际湖体发生严重藻华的现象[22],发现藻体沉降到沉积物表面后在50min内就完全消耗掉水-沉积物界面处的溶氧,使得沉积物和上覆水体向厌氧状态转变.藻细胞在沉积物表面沉降、死亡、分解过程中,水-沉积物界面处首先成为一个低溶氧、Eh值的强厌氧、还原环境(图5).实验结束后测得0~4cm处的沉积物中 Eh值分别为-150.47,-182.12, -184.2,-184.45,-186.49mV,远低于对照样柱中的Eh值,表明藻细胞聚集处的水-沉积物系统处于强还原环境. 大量输入的藻体细胞也带来了丰富的有机质,为在厌氧条件下厌氧菌的活性增强提供了物质基础,从而使得沉积物中高价态的铁和硫酸根产生快速还原反应,以Fe2+和S2-离子形式向上覆水中扩散;向上扩散的间隙水也阻止了向下扩散的溶氧;产生的自由S2-离子是一种对水体生态系统产生毒害作用的物质,在有机质的厌氧矿化过程中较高含量的 S2-也造成了沉积物表面微型生物的减少[26],厌氧环境也使得底栖生物活性丧失,减少了因生物扰动而产生的水流或空气流[27],使得 Fe-P产生解析反应;同时沉积物中较高含量的 S2-也会促使沉积物中 Fe-P的溶解[28],使得间隙水中PO43-- P浓度快速增加(图1和图2). 0~1cm处上覆水和沉积物不同深度处间隙水中 Fe2+、S2-含量的快速增加,也表明此时沉积物中正发生着剧烈的氧化还原反应和有机质的矿化[15].对于在产生黑水团现象下有机质的矿化和沉积物表面微型生物及微型藻类的变化,需要做进一步的研究,才能给出明确的证据.
沉积物间隙水和表层上覆水中 S2-含量在实验的1~3d含量快速增加,从第3d到第7d呈下降趋势,但到了实验的末期,也就是实验的第 8d,其含量又表现出增加的趋势.沉积物间隙水中的SO42-一直为下降趋势,这有可能是因为实验初期较高含量的 S2-含抑制硫细菌的活性从而阻碍了SO42-的快速还原[29].研究发现,当 S2-浓度>20mmol时,将会抑制SO42-的还原[28],而在本实验进行到第2d时,S2-浓度超过20mmol,随后SO42-和S2-的浓度都表现为快速下降的趋势(图1、图2),这与其研究结果类似.同时,金属离子和 S2-向上覆水体中扩散时,在沉积物表面会发生化合反应形成黑色金属硫化物,并在沉积物表面形成沉淀(数据待发表),这也是藻源性黑水团或黑臭现象出现后,水体发黑的原因.
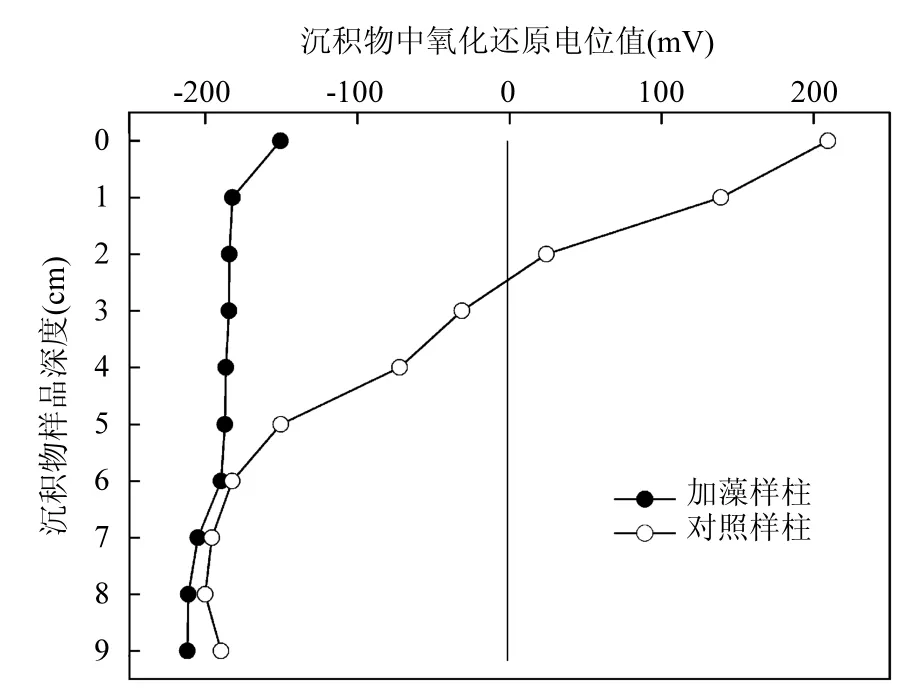
图5 沉积物不同深度处氧化还原电位值Fig.5 Redox potential changes in sediment depth
4 结论
4.1 藻体细胞大量聚集在沉积物表面后,在较高温度作用下,很快消耗掉水体中的溶氧,使得水~沉积物从有氧向厌氧状态转变,水~沉积物界面处的氧化还原电位值从对照组的200mV下降为~180mV,呈现强还原环境.
4.2 厌氧、强还原条件下大量铁氧化物还原为低价态;在还原环境中 Fe-P出现解析,使得沉积物中无机磷以PO43--P形式从间隙水中向上覆水体中扩散,造成水-沉积物界面处的 Fe2+、S2-、SO42-和 PO43--P含量分别从 2.71,20.58,108.00, 0.09mg/L变化为 4.99,291.44,37,4.49mg/L;在藻细胞死亡分解后,不但引起强还原环境,使得水体中S2含量急剧升高,且释放大量营养盐于水体后,加重了上覆水营养盐浓度.
4.3 藻源性黑水团现象出现后,由沉积物向上覆水体中释放大量S2-并以H2S的形式逸散到水体中;黑水团产生区形成的厌氧、强还原环境,沉积物中重金属等有害物质也存在释放到水体中的风险,从而对水体生态环境造成危害;黑水团形
成后,水体溶氧一般在短期内很难恢复到原来状态,对构建健康的水体生态系统更是造成了阻碍.
[1] Lucie G. Doing battle with the green monster of Taihu Lake [J]. Science, 2007,317:1166.
[2] Yang M, Yu J, Li Z L, et al. Taihu Lake not to blame for Wuxi's woes [J]. Science, 2007,31(317):1166.
[3] Rusch A, Tǒpken H, Bǒttcher M E, et al. Recovery from black spots: results of a loading experiment in the Wadden Sea [J]. Journal of Sea Research, 1998,40:205-219.
[4] Diaz R J, Rosenberg R. Spreading dead zones and consequences for marine ecosystems [J]. Science, 2008,321:926-929.
[5] 金承翔,孙建军,黄民生,等.组合生物技术对黑臭水体净化修复研究 [J]. 净水技术, 2005,24(4):1-4.
[6] Rozan T F, Taillefert M, Trouwborst R E, et al. Iron—sulfur—phosphorus cycling in the sediments of a shallow coastal bay: Implications for sediment nutrient release and benthic macroalgal blooms [J]. Limnololgy and Oceanography, 2002,47(5):1346-1354.
[7] Schelske C L. Eutrophication: Focus on Phosphorus [J]. Science, 2009,324:722.
[8] Morse J W, Eldridge P M. A non~steady state diagenetic model for changes in sediment biogeochemistry in response to seasonally hypoxic/anoxic conditions in the “dead zone” of the Louisiana shelf [J]. Marine Chemistry, 2007,106:239-255.
[9] 刘国锋,何 俊,申秋实,等.藻源性黑水团静态模拟下对水-沉积物界面氮磷状态和行为的驱动作用 [J]. 环境科学, 2010, 31(11):2652-2660.
[10] Stookey L L. Ferrozine: A new spectrophotometric reagent for iron [J]. Analytical Chemistry, 1970,42:779-781.
[11] 水和废水监测分析(第四版) [M]. 北京:中国环境出版社, 2002.
[12] 杨 磊,林逢凯,胥 峥,等.底泥修复中温度对微生物活性和污染物释放的影响 [J]. 环境污染与防治, 2007,29(1):22-25,29.
[13] Thamdrup B, Fossing H, Jørgensen B B. Manganese, iron and sulfur cycling in a coastal marine sediment, Aarhus Bay, Denmark [J]. Geochimica et Cosmochimica Acta, 1994,58(23):5115-5129.
[14] Matsuda Y, Colman B. Characterization of Sulfate Transport in the Green Alga Chlorella ellipsoidea [J]. Plant and Cell Physiology, 1995,36(7):1291-1296.
[15] 尹宏斌.太湖沉积物形态硫赋存及其与重金属和营养盐关系研究 [D]. 南京:中国科学院南京地理与湖泊研究所, 2008.
[16] Burton E D, Bush R T, Sullivan L A. Fractionation and extractability of sulfur, iron and trace elements in sulfidic sediments [J]. Chemosphere, 2006,64:1421-1428.
[17] Burton E D, Bush R T, Sullivan L A. Reduced Inorganic Sulfur Speciation in Drain Sediments from Acid Sulfate Soil Landscapes [J]. Environmental Science and Technology, 2006,40(3):888-893.
[18] Burton E D, Bush R T, Sullivan L A, et al. Reductive transformation of iron and sulfur in schwertmannite~rich accumulations associated with acidified coastal lowlands [J]. Geochimica et Cosmochimica Acta, 2007,71(18):4456-4473.
[19] Wolfenden S, Charnock J M, Hilton J, et al. Sulfide Species as a Sink for Mercury in Lake Sediments [J]. Environmental Science and Technology, 2005,39:6644-6648.
[20] 尤本胜,王同成,范成新,等.风浪作用下太湖草型湖区水体N、P动态负荷模拟 [J]. 中国环境科学, 2008,28(1):33-38.
[21] 范成新,张 路,秦伯强,等.风浪作用下太湖悬浮态颗粒物中磷的动态释放估算 [J]. 中国科学D辑 地球科学, 2003,33(8):760-768.
[22] 孔繁翔,吴庆龙,范成新,等.太湖梅梁湾2007年蓝藻水华形成及取水口污水团成因分析与应急措施建议 [J]. 湖泊科学, 2007, 19(4):357-358.
[23] 陈宇炜,高锡云,陈伟民,等.太湖微囊藻的生长特征及其分离纯培养的初步研究 [J]. 湖泊科学, 1999,4:351-356.
[24] 太湖流域水资源保护局.太湖湖区“黑水团”成因及危害分析[EB/OL]. 健康太湖, 2009:http://www.tba.gov.cn:89/news/news_ show.jsp?fileId=196805.
[25] 孔 明,张 路,尹洪斌,等.高俊峰.蓝藻暴发对巢湖表层沉积物氮磷及形态分布的影响 [J]. 中国环境科学, 2014,34(5):1285-1292.
[26] Kennett D M, Hargraves P E. Benthic diatoms and sulfide fluctuations: Upper basin of Pettaquamscutt River, Rhode Island [J]. Estuarine, Coastal and Shelf Science, 1985,21(4):577-586.
[27] Aller R C, Aller J Y. Meiofauna and solute transport in marine muds [J]. Limnology and Oceanography, 1992,37:1018-1033.
[28] Jordan T E, Cornwell J C, Boynton W R, et al. Changes in phosphorus biogeochemistry along an estuarine salinity gradient: The iron conveyer belt [J]. Limnololgy and Oceanography, 2008,53(1):172-184.
[29] Reis M A M, Almeida J S, Lemos P C, et al. Effect of hydrogen sulfide on growth of sulfate reducing bacteria [J]. Biotechnology and Bioengineering, 2004,40(5):593-600.
Environment effects of algae-caused black spots Ⅲ: Impacts on Fe- S- P cycle in water-sediment interface.
LIU
Guo-feng1,2,3, FAN Cheng-xin2*, ZHANG Lei2, SHEN Qiu-shi2, WANG Zhao-de2, HAN Shi-qun3**(1.Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China;2.State Key Laboratory of Lake and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;3.Institute of Agricultural Resource and Environment, Jiangsu Academy of Agricultural Science, Nanjing 210014, China). China Environmental Science, 2014,34(12):3199~3206
The process of biogeochemical cycle change of Fe-S-P in overlying water, sediment pore water was studied in a laboratory using a static simulating device which simulated the algae- caused black-spots. Drastic biogeochemical changes of Fe-S-P happened in an anaerobic and reducing sediment environment after algae cells were added. Concentration of Fe2+, SO42-and S2-in interface of sediment-water was 4.993, 242.0, 387.57mg/L, respectively at 1st day after algae cells added, and it was the 1.8, 2.2and 18.8times higher than the contrast experiments in the same period; and the concentration of Fe2+, SO42-and S2-was 8.5mg/L, 40.0mg/L and 65.3mg/L, respectively in 4cm deep sediments. Then, Fe2+and S2-concentration in overlying water showed a rapid increase and followed a falling trend, and its concentration reached maximum at the 2nd and 3rd day, value of 11.1mg/L and 634.6mg/L. Concentration of PO43--P in sediment increased slowly due to Fe-P desorption, and its content increased continuously from the 2nd day until the end of experiment. After adding algae cells, the concentration reached 39.450mg/L which was 242times higher than the control experiment; and also up to 10.74mg/L in 4cm deep sediment. The rapid changes of Fe-S-P indicated biogeochemical reaction in an anaerobic and reducing sediment environment after algae cells were added, and caused the Fe2+, S2-and PO43--P to diffuse into the overlying water. The algae-caused black-spot posed huge difficulties to the restoration of water ecosystems.
black spots;water-sediment interface;Fe-S-P cycle;environment effects
X142
A
1000-6923(2014)12-3199-08
刘国锋(1979-),男,河南人,博士,副研究员,主要从事水环境污染生态治理研究.发表10篇论文.
2014-03-26
国家自然科学基金(41101525);江苏省自主创新资金(CX(12)5057);国家重大科技专项巢湖水专项(2012ZX07103-005) * 责任作者, 范成新, 研究员, cxfan@niglas.ac.cn
** 责任作者, 韩士群, 研究员, shqunh@126.com
