抗生素致全身多系统出血:1例报告并文献复习
2014-04-28肖飞,彭艳,孙杰
肖 飞,彭 艳,孙 杰
(1广州军区广州总医院老年重症医学科,广州 510010;2广州中医药大学研究生院,广州 510006)
在引起药源性出血的药物种类中,占首位的是抗生素类,其中包括临床应用广泛的头孢菌素类抗生素[1]。在1项对住院患者抗生素药物不良反应的前瞻性研究[2]中发现,抗生素的药物不良反应发生率高达24.1%,其中血液系统损害占32.7%,包括血小板减少和凝血时间异常。药物不良反应引起的出血部位各异,大量出血导致的低血容量性休克和重要脏器的出血(如颅内出血等)可能危及患者生命。广州军区广州总医院老年重症医学科近期收治1例使用“头孢哌酮舒巴坦”致全身多系统出血的病例,报道如下。
1 临床资料
患者,男性,84岁,因“肺炎”入院。既往有冠心病、糖尿病、慢性肾功能不全氮质血症期等基础病。入院查体:双肺呼吸音偏低,双肺可闻及散在痰鸣音。化验血常规:白细胞11.4×109/L,中性粒细胞92.6%,红细胞4.92×1012/L,血红蛋白126g/L,血小板67×109/L,生化:尿素氮61.2mmol/L,肌酐415µmol/L,降钙素原2.86µg/L,凝血四项:国际标准化比值(international normalized ratio,INR)1.30,活化部分凝血活酶时间(activated partial thromboplastin time,APTT)44.5s,凝血酶原时间(prothrombin time,PT)17.3s,纤维蛋白原3.0g/L,白蛋白30.6g/L、D−二聚体4268.99µg/L;胸部X线提示双肺感染,双侧胸腔积液(图1A)。诊断:双侧肺炎。因患者近期多次住院,按医院内获得性肺炎治疗,故经验性选用抗生素“头孢哌酮舒巴坦钠”(cefoperazone sodium and sulbactam sodium,1.5g,3/d)覆盖常见非发酵类菌,并间断行血液净化肾脏替代治疗,同时予祛痰、维持水电解质及酸碱平衡等对症治疗。抗感染治疗1周,病情改善,咳嗽、咯痰明显好转,复查胸片见双侧肺炎有所吸收(图1B)。拟继续用该抗生素至2周后停药。用药至第10天时,患者先后出现皮下淤斑、持续肉眼血尿、咯血、大量黑便;当时未行血液净化,仍用鱼精蛋白对症治疗,但凝血功能无明显改善,多部位出血无法纠正,再次复查胸片提示双肺渗出阴影明显增加(图1C)。随后出现血压下降,血氧饱和度下降,立即予紧急气管插管,保持气道通畅,应用升压药物维持血压。
进一步化验。血常规:白细胞13.9×109/L,中性粒细胞87.2%,血红蛋白85g/L,血小板计数84×109/L;尿常规:尿蛋白3+,1.5g/L,白细胞776.60/µl,红细胞20831.3/µl;粪常规:潜血阳性(+);乳酸2.0mmol/L;凝血4项:INR1.60,APTT 96.4s,PT 23.0s,纤维蛋白原2.1g/L,D−二聚体1446.46µg/L。患者血红蛋白由12g迅速下降至8g,提示存在危及生命的活动性大出血,估计出血量超过1000ml,伴血流动力学不稳定。出血部位为全身多系统出血,包括皮下、消化道、泌尿道、呼吸道。化验见凝血功能显著异常,考虑为内科性大出血,尝试使用鱼精蛋白无效。立即申请红细胞悬液、血浆输注,考虑到可能由于上述抗生素引起全身性多系统出血,停用抗生素并加用维生素K治疗后凝血功能明显好转。
2 讨 论
2.1 分析
患者因“肺炎”入院,存在弥散性血管内凝血(disseminated intravascular coagulation,DIC)发生的诱因,但患者血小板、纤维蛋白原、D−二聚体变化不支持DIC诊断;在已行血液净化后出现出血,尿毒症毒素本身引起出血可能性不大;患者凝血功能指标INR和APTT均升高,可能由肝素引起,但出血加重时患者未行血液净化,且应用鱼精蛋白后凝血功能无改善,故此原因可排除。从患者使用药物上排查发现头孢哌酮舒巴坦钠对维生素K有抑制作用,停用该药,加用维生素K治疗后凝血功能明显好转,故考虑主要为药物影响。
头孢哌酮钠舒巴坦钠是临床应用较多的第三代头孢类广谱抗生素,其经肝脏代谢,由胆道及肾脏双通路排泄,其中约84%的舒巴坦和25%的头孢哌酮经肾脏排泄,其余的头孢哌酮大部分经胆汁排泄[3]。通常情况下该药耐受良好,主要的不良反应包括胃肠道反应、皮肤过敏、肝酶异常、凝血功能异常等,另与乳酸林格液、万古霉素等存在配伍禁忌[4]。有研究认为[5],头孢哌酮舒巴坦钠引起凝血功能异常与肝病、肾功能不全、进食情况、药物剂量有关。现将其导致凝血功能障碍和出血并发症的机制总结如下。
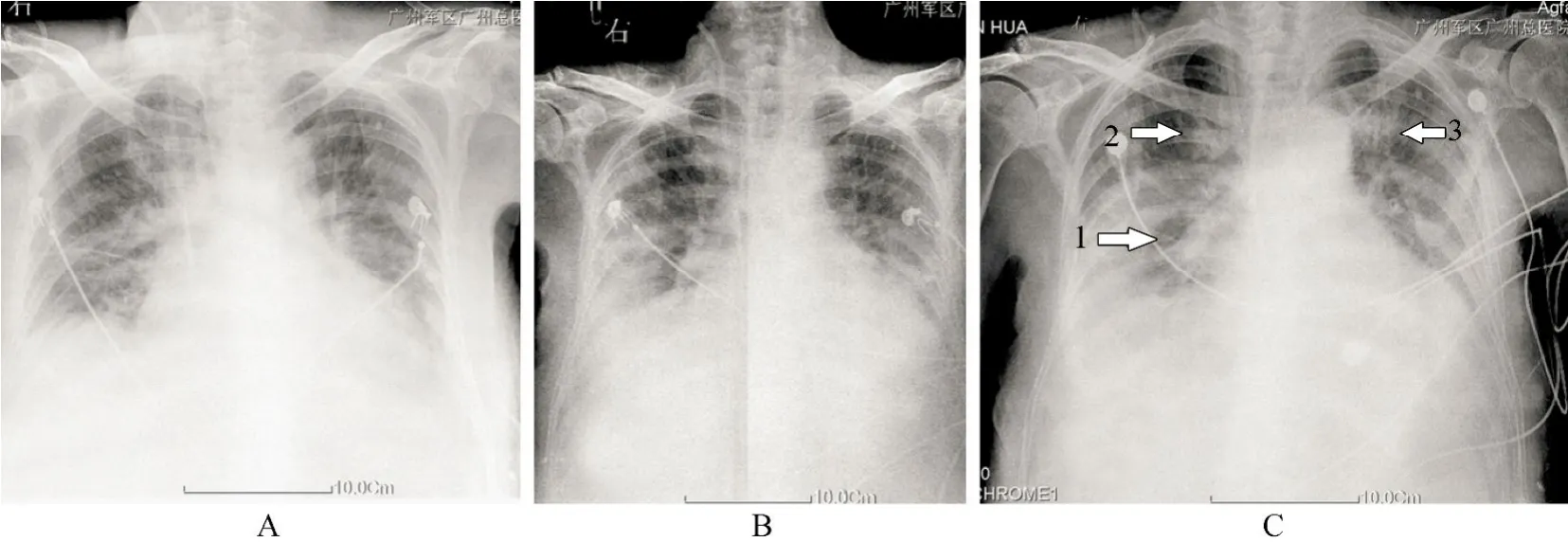
图1 患者治疗前后胸片改变Figure 1 Chest radiography before and after treatment
(1)化学诱导引起维生素K依赖性凝血过程阻断所致的出血。维生素K是肝细胞微粒体羧化酶必需的辅助因子,参与凝血酶原前体中谷氨酸的γ羧化反应。维生素K1是人类维生素K的主要来源,由饮食摄入,而维生素K2需在结肠腔微粒体中合成。因此当饮食摄入的维生素K缺乏时,这种内源性维生素K2就成为维生素K的重要来源。β内酰胺类抗生素可以诱导结肠内大肠杆菌和拟杆菌属细菌的降解,使体内合成维生素K2减少,进而使凝血酶原的合成减少和依赖维生素K的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ等的水平降低,引起凝血功能异常而导致出血。
(2)含有N−甲基硫化四氮唑侧链的头孢类如头孢美唑、头孢哌酮、头孢曲松等在人体内代谢会消耗维生素K,引起凝血酶原及凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的减少。其作用机制主要是N−甲基硫化四氮唑侧链结构与谷氨酸相似,可以抑制维生素K依赖性羧基化反应,使肝脏中的还原型谷胱甘肽发生改变,导致与剂量相关的氧化型谷胱甘肽的增加,进而抑制微粒体酶等一系列反应,使维生素K减少[6]。在这些头孢类中,头孢哌酮引起出血较多见,主要是因为肠道大肠杆菌对头孢哌酮极为敏感,≤0.25mg/L的头孢哌酮可抑制近80%的大肠杆菌[7],大肠杆菌的抑制引起维生素K的合成显著减少。王艳宁等[8]也报道,有4例老年患者使用头孢哌酮舒巴坦钠导致PT最高达60.1s,并有血尿、便血等临床出血表现。刘铁民[9]报道静注头孢哌酮引起上消化道出血2例。方忠联等[10]报道头孢哌酮致上消化道出血7例。祝雄等[11]报道头孢哌酮的不良反应引起消化道出血。Schafer等[12]对含有N−甲基硫化四氮唑侧链的头孢菌素引起的止血功能异常的患者进行研究,结果发现,14例住院患者(年龄≥50岁,泌尿系感染,用药前PT正常),5例用拉氧头孢,5例用头孢哌酮,4例用头孢噻肟,治疗7d后,2例使用头孢哌酮的患者出现凝血酶原时间显著延长,并伴有凝血酶原诱导的维生素K缺乏;4例使用头孢哌酮的患者和3例使用拉氧头孢的患者出现内源性维生素K的1,2,3−环氧化物,而对照组(头孢噻肟组)没有上述现象。这证实了含有N−甲基硫化四氮唑侧链的头孢菌素是肝维生素K环氧化物降解酶的抑制物,这与临床上发现的低凝血酶原血症密切相关。
(3)诱导血小板功能障碍。头孢类引起出血的另一个重要原因是诱导血小板功能障碍,使血小板的聚集及黏附功能受损和由于药物对骨髓的毒性损害及免疫性血小板破坏过多而致血小板数量减少而发生出血。梁晓丽等[13]报道了1例高龄男性患者因胆道感染使用头孢哌酮舒巴坦钠,用药6d后血小板由164×109/L下降至68×109/L,停药1周后血小板恢复。头孢类抗生素可抑制骨髓中的巨核细胞系统,造成血小板的生成减少,并使血小板的聚集及黏附功能受损,从而引起出血。另外,抗生素还可以因过敏反应诱发机体的免疫反应,导致免疫反应性的血小板减少。本例患者血小板通常低于正常水平,用药后未见血小板进行性下降,未发生血小板功能障碍。
2.2 防治
(1)维生素K缺乏导致的出血,可每周2次予维生素K110mg肌注,或静脉滴注,并监测出血时间和PT。对于进食少,营养不良或肾功能不良的患者更应注意监测凝血功能。一旦发生出血,除立即停用相关抗生素外,应给予大剂量维生素K1静脉滴注,出血量大时,应予输血。
(2)血小板功能障碍引起的出血不能用维生素K预防,需要停止使用相关药物并输注新鲜血小板。
(3)抗生素与抗凝剂合用可加重出血和凝血障碍。抗维生素K的药物(如双香豆素类药物)与抗生素合用时,可加速维生素K缺乏,加重出血危险性;某些血小板抑制剂(如阿司匹林)与抗生素合用,可加重出血的潜在危险。故在临床上抗生素不宜与抗凝血药物联合使用。
(4)有维生素K缺乏者、出血倾向者,有慢性病或营养不良的患者慎用。
3 体 会
该患者为高龄老人,血小板水平通常低于正常,并有慢性肾功能不全,药物排泄延迟,有多个出血的危险因素。同时,患者血清白蛋白水平低下,有研究显示β内酰胺类抗生素所致血小板凝集抑制的作用与白蛋白水平呈负相关关系[14],增加了使用β内酰胺类抗生素后出血的概率。应当注意的是,由于年龄是动脉粥样硬化的危险因素,而该患者高龄且有“冠状动脉粥样硬化性心脏病”的直接证据,可以认为存在全身性的动脉粥样硬化。而在药物不良反应导致广泛的多系统出血过程中,动脉粥样硬化是否是一个独立的危险因素,仍有待进一步证实。
总之,抗生素导致凝血功能障碍的原因是多样的,与抗生素本身的代谢作用机制有关,同时又与患者自身的营养、器官功能、合并其他用药密切相关[15]。β内酰胺类抗生素引起的出血以血尿、皮下淤斑较为常见[16],发生致命性多系统出血的相关报道不多。因此临床使用广谱抗生素时,应对有关药物的作用方式有深入了解,尤其要熟悉对出血和凝血机制的影响,同时应严密观察凝血指标的变化,尤其是合并使用抗凝、抗血小板药物的患者更应慎重选择抗生素,预防致死性出血事件的发生。
【参考文献】
[1]Yang SM,Li M,Yang JZ.Analysis of 1139 cases of drug-induced hemorrhage[J].China Pharm,2005,16(15):1173−1174.[杨树民,李 鸣,杨继章.药源性出血1 139例分析[J].中国药房,2005,16(15):1173−1174.]
[2]Sun HY,Chen YC,Wang YW,et al.A prospective study of antimicrobial-related adverse drug reactions in hospitalized patients[J].J Microbiol Immunol Infect,2008,41(2):151−159.
[3]Zhu AH,Shi J,Ni JN,et al.Cefoperazone sodium/sulbactam sodium induced coagulation abnormalities[J].Adverse Drug React J,2011,13(6):373−374.[朱爱华,时 晶,倪敬年,等.头孢哌酮钠/舒巴坦钠致凝血功能异常[J].药物不良反应杂志,2011,13(6):373−374.]
[4]Li L.Literature analysis of 104 cases of adverse reaction of cefoperazone sodium and sulbactam sodium[J].China Pharm,2010,19(6):43−44.[李 岚.104例头孢哌酮钠舒巴坦钠不良反应文献分析[J].中国药业,2010,19(6):43−44.]
[5]Dai XQ,Ma CX,Cai Y,et al.Analysis of risk factors of coagulation abnormalities induced by cefoperazone sodium and sulbactam sodium and nursing[J].J Nurs,2013,20(5A):59−61.[戴晓琴,马纯雪,蔡 月,等.头孢哌酮钠舒巴坦钠致凝血功能异常的危险因素分析及护理[J].护理学报,2013,20(5A):59−61.]
[6]Alagozlu H,Cindoruk M,Unal S.Severe INR elevation in a patient with choledocholithiasis receiving cefoperazone[J].Clin Drug Investig,2006,26(8):481−484.
[7]Gu ZP,Zhu YH,Lu HP.Literature analysis of 454 cases of adverse reaction caused by cefoperazone[J].Herald Med,2007,26(2):204−205.[顾正平,朱亚虹,陆惠平.头孢哌酮致不良反应454例文献分析[J].医药导报,2007,26(2):204−205.]
[8]Wang YN,Zhong H.Four cases of dysfunction of blood clotting induced by cefoperazoned/sulbactam[J].China Pharm,2005,16(17):1329−1330.[王艳宁,钟 慧.头孢哌酮/舒巴坦钠致凝血功能异常4例[J].中国药房,2005,16(17):1329−1330.]
[9]Liu TM.Two cases of upper digestive tract hemorrhage caused by intravenous injection of cefoperazone[J].J Pediatr Pharm,2001,7(3):38.[刘铁民.静注头孢哌酮引起上消化道出血2例报告[J].儿科药学,2001,7(3):38.]
[10]Fang ZL,Zhang F,Dai J.Seven cases of upper gastrointestinal hemorrhage induced by cefoperazone[J].Heilongjiang Med Pharm,2000,23(3):99.[方忠联,张芳,代 建.头孢哌酮致上消化道出血7例[J].黑龙江医药科学,2000,23(3):99.]
[11]Zhu X,Wang RZ.The adverse reaction of cefoperazone[J].Herald Med,1999,18(5):377−378.[祝 雄,王瑞珍.头孢哌酮的不良反应[J].医药导报,1999,18(5):377−378.]
[12]Schafer H,Naber K,Adam D.Hemostasis disturbance caused by cephalosporins with an N-methylthiotetrazole side chain. A randomized pilot study[J].Arzneimittelforshung,1989,39(9):1156−1162 .
[13]Liang XL,Song JH,Pei YF.Thrombocytopenia due to cefoperazone sodium/sulbactam sodium[J].Adverse Drug React J,2007,9(5):367−368.[梁晓丽,宋建华,裴艺芳.头孢哌酮钠/舒巴坦钠致血小板减少[J].药物不良反应杂志,2007,9(5):367−368.]
[14]Wu YH.Inhibition of albumin to beta lactam antibiotic induced platelet aggregation effect[J].J Int Intern Med,1993,20(12):555.[吴永华.白蛋白对β-内酰胺类抗生素所致血小板凝集抑制的效果[J].国外医学·内科学分册,1993,20(12):555.]
[15]Liu SP.Effects of broad spectrum antibiotics on coagulation function in patients with cerebrovascular disease[J].China Pharm,2010,21(2):147−149.[刘水平.广谱抗生素对部分脑血管病患者凝血功能的影响[J].中国药房,2010,21(2):147−149.]
[16]Fan M.Literature analysis of adverse reactions of cephalosporins[J].Chin J Pharmacovigilance,2012,9(2):119−123.[范 铭.头孢菌素类药物不良反应文献分析[J].中国药物警戒,2012,9(2):119−123.]
