miRNA-106a在肝癌中的表达及其作用
2014-04-27西安交通大学医学院西安710061陈双江姚英民
西安交通大学医学院(西安710061) 陈双江 王 铮 姚英民 郭 雄
肝癌是发病率较高的肿瘤之一,其恶性程度高、进展快、病死率高,确诊时大部分已属中晚期,从而失去治疗的最佳时机,复发和转移是影响肝癌预后的主要因素。微核糖核酸(miRNA)是一类进化上高度保守、内源性的非编码单链小RNA,可以通过抑制或降解靶基因mRNA从而达到抑制靶基因的作用[1]。有研究显示大概有60%编码蛋白的基因受到miRNA的调控[2]。miRNA-106a(miR-106a)作为一种上调的致癌基因在许多肿瘤中被证实[3-4]。我们通过实时定量PCR技术检测miR-106a在20例肝癌手术标本与其对应的癌旁组织中的表达情况,并通过人工合成miR-106amimics或inhibitors转染肝癌细胞株HepG-2,观察其对肝癌细胞增殖和侵袭能力的影响,并探讨其内在分子机制。
材料与方法
1 材 料 西安交通大学医学院第一附属医院外科手术切除的肝癌组织及其对应癌旁正常组织20例(男14例,女6例,平均年龄56.7岁),术后均经病理检查确认。标本收集后置于-80℃冰箱保存,所有患者术前均未经放疗、化疗。人肝癌细胞HepG-2由西安交通大学医学院生物医学研究实验中心提供并保存。DMEM培养基及胎牛血清购自美国Gibco公司。TRIzol试剂购自美国ambion公司,逆转录试剂盒购自日本TaKaRa公司,所有引物委托北京鼎国昌盛公司设计并合成,实时定量PCR试剂SYBR Green Realtime PCR Master Mix购自日本TaKaRa公司,脂质体2000转染试剂购自美国Invitrogen公司,miR-106 mimics/inhibitors及 NC对照购自上海吉玛公司,MTT购自美国Sigma公司,DMSO购自美国Sigma公司,transwell小室购自美国 Millipore公司;Matrigel基质胶购自美国BD公司,GAPDH、TGFBR2、E-cadherin、N-cadherin和 Vimentin抗体均购自美国Santa cruze公司。其他试剂均为国产分析纯。
2 总RNA提取 称取保存在-80℃冰箱中的组织10mg,在冰上用一次性研磨皿磨碎,并加入1ml Trizol,按说明书继续操作提取总RNA,用Nanodrop-2000测量总RNA浓度及A260/280比值,取比值为1.8~2.0之间的RNA进行下一步实验。细胞RNA提取按每孔加1ml Trizol,其余步骤同组织提取RNA。
3 引物及寡义核苷酸合成 引物序列见附表,miR-106amimics:AAAAGUGCUUACAGUGCAGGUAG, miR-106ainhibitors:CUACCUGCACUGUAAGCACUUUU。

附表 引物设计序列及产物大小
4 miR-106a反转录 取1μl总RNA,加入特异性茎环引物,按试剂盒说明书操作逆转录cDNA,反应温度:42℃15min,85℃5s。
5 QRT-PCR实验 使用iQ5Multicolor Real-Time PCR Detection System(CA)检测 miR-106a在肝癌中的表达情况(以U6做内参),并检测转染后肝癌细胞中 TGFBR2、E-cadherin、N-cadherin和 Vimen-tin的表达情况(以GAPDH做内参)。反应条件:变性95℃30s,退火60℃30s,延伸72℃30s,共40个循环,72℃延伸5min终止反应。所有反应均设立3个复孔,用2-△△Ct计算癌组织比癌旁组织的相对表达量。
6 细胞培养及分组 细胞株用含10%小牛血清和双抗的DMEM培养基在37℃,5%CO2的培养箱中培养。实验将肝癌细胞分为3组,mimics组(即转染miR-106amimics组)、NC组(转染无意义寡核苷酸组)、inhibitors组(即转染 miR-106ainhibitors组)。细胞接种于6孔板中,待融合度为50%时按Lipo2000说明书分别转染。每组分别干预培养24、48、72、96h用于MTT实验,转染后48h用于检测侵袭力、提取总RNA及总蛋白。
7 MTT实验 将干预过的细胞用胰酶消化,计数,分别制成5×105个/ml的单细胞悬液,按每孔100μl接种于96孔板,分别在24、48、72、96h孵育后避光分别加入 MTT 20μl(5mg/ml),37℃孵育箱孵育4h,弃去上清,加入200μl DMSO,摇床震荡,酶标仪检测480nm的OD值,取5孔平均值。
8 Transwell侵袭实验 在冰上融化Matrigel基质胶过夜,稀释后加100μl于上室,37℃孵育4h使Matrigel胶凝固,将分组干预48h后的细胞用胰酶消化,含1%FBS的DMEM培养基重悬细胞,按1×105个/ml的浓度种入上室200μl细胞,下室加入含20%FBS的DMEM培养基600μl。在37℃、5%CO2的培养箱中孵育24h后,用棉签轻轻拭去滤膜上表面未穿过的细胞,4%多聚甲醛固定,0.1% 结晶紫染色,PBS洗净后显微镜下高倍视野计算细胞数,每小室随机取5个视野,并记录每个视野细胞数。以计数穿膜细胞数目来间接反映肿瘤细胞侵袭能力大小。
9 蛋白印迹实验 用PBS洗细胞,去掉残留培养基,每孔细胞加入200μl RIPA裂解液,吹打,冰上裂解1h,用细胞刮刀将细胞收集入离心管,12000r/min离心,收集上清液,加loading buffer,100℃5min使蛋白变性,每孔上样10μl后用 SDS-PAGE 电泳,转PVDF膜,5%脱脂牛奶封闭,一抗4℃孵育过夜,PBST洗膜后孵育二抗2h,洗膜,化学发光法检测,暗室内压片曝光。应用ChemiImage 5500自动电泳凝胶成像分析仪照相。
10 统计学处理 数据采用SPSS13.0软件分析,测定结果均以±s表示。应用单因素方差分析,组间均数的比较采用t检验,检验水准α=0.05。
结 果
1 miR-106a在肝癌组织中的表达 PCR用于20对肝癌组织及其癌旁组织miR-106a的表达情况检测,结果显示,miR-106a在14/20(70%)的肝癌组织中高表达(上调超过2倍);与正常癌旁组织相比平均上调3.76倍(见图1)。

图1 miR-106a在肝癌组织中的表达上调
2 miR-106a对HepG-2细胞增殖的影响 通过转染 miR-106amimics上调 HepG-2内的 miR-106a成熟体的水平,并在转染24h后通过qRT-PCR确认转染效率,结果显示终浓度为50nm/L的mimics明显促进肝癌细胞增殖,并在48h效应基本达到顶峰,而转染100nm/L的inhibitors可以明显抑制肝癌细胞的增殖,差异有统计学意义(P<0.05)(见图2)。
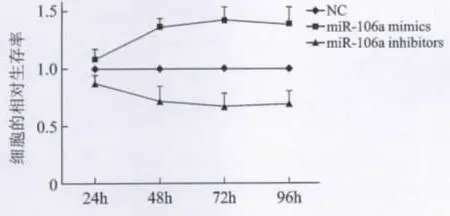
图2 miRNA-106a对肝癌细胞HepG-2增值率的影响
3 miR-106a对HepG-2细胞侵袭的影响 miR-106amimics干预细胞48h后,肝癌细胞株HepG-2的侵袭能力明显增强,结果显示穿过基底膜的细胞数量增加,与NC对照组相比,结果差异具有显著性(P<0.05)(见图3);而对 HepG-2中的 miR-106a进行抑制后,则侵袭能力明显降低。

图3 miR-106a对肝癌细胞HepG-2侵袭力的影响
4 miR-106a对 HepG-2 细胞 TGFBR2、E-cadherin、N-cadherin和 Vimentin表达的影响 根据miRNA预测软件(TargetScan)预测TGFBR2在肝癌中可能为miR-106a的靶基因。因此,我们使用实时定量PCR 技术检测了 TGFBR2及 E-cadherin、N-cadherin和Vimentin的mRNA的表达水平变化,并且通过western blot技术检测了这四个基因的蛋白质表达水平变化。结果显示,mimics干预组的TGFBR2在mRNA及蛋白水平下降,而抑制细胞内源性miR-106a成熟体的水平后,可以观察到TGFBR2的表达水平升高,因此,提示TGFBR2可能为肝癌细胞中miR-106a的靶基因。在检测了肿瘤细胞EMT指标E-cadherin、N-cadherin和Vimentin后,可以发现间质指标N-cadherin和Vimentin的mRNA及蛋白水平都在mimics干预后得到提升,而上皮指标E-cadherin的表达受到抑制。在抑制miR-106a水平后,N-cadherin和Vimentin的表达水平均有下降,而E-cadherin的表达则上调(见图4)。这些结果说明miR-106a可以增强肝癌细胞株HepG-2的EMT过程,从而增强其侵袭力。
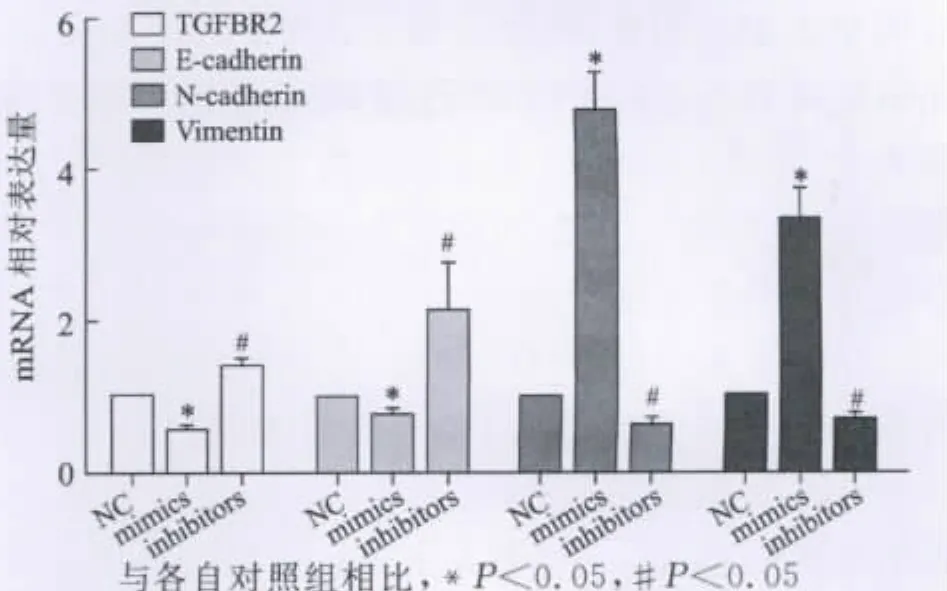
图4 miR-106a对 HepG-2TGFBR2、E-cadherin N-cadherin和Vimentin表达的影响
讨 论
近年来,miRNA作为一种内源性调控基因表达的非编码小RNA分子受到广泛关注,尤其是在肿瘤研究中更是备受瞩目,其通过癌基因或抑癌基因调控下游靶基因,从而参与肿瘤发生发展,在肿瘤增殖、周期、耐药及侵袭转移等生物学特性方面都有重要的调控作用[5]。而miRNA与肿瘤的相关性及其对多个靶基因的调控作用为研究肿瘤发生发展的机制提供了新的方法途径,使肿瘤分子生物学研究有了新的突破口。在本实验中,我们使用了茎环法来反转录cDNA,即使用特异性的反转录茎环引物,与普通的加尾法相比,使反转录的灵敏度和特异性提高[6]。
在肝癌的发生发展过程中,多基因的相互作用使其机制异常复杂,而miRNA对其任何一个靶基因的调控都可能对肿瘤的发生发展起着重要作用。转化生长因子βⅡ型受体(TGFBR2)是TGFβ信号的直接受体,被认为是抑癌基因,TGFBR2的表达下调可以使肿瘤细胞逃逸其负调控而增殖,促使了肿瘤的发生发展[7]。我们通过实时定量PCR在肝癌中发现miRNA-106a表达上调,结合miRNA靶基因预测软件分析,在调控 miRNA-106a后,TGFBR2mRNA、蛋白水平的变化证实其可能为miRNA-106a靶基因,从而可以认为在肝癌细胞HepG-2中,miRNA可能通过TGFBR2来调控肝癌的发生发展,并且,在其他的报道中也观察到TGFBR2作为一种抑癌基因在多种肿瘤中都表达下调[8-9]。文 献 报道[10-11],miRNA-106a也可作用于肿瘤细胞调控其靶基因RB1使肿瘤细胞凋亡减少,增殖加强,这与我们的实验结果也是一致的。
上皮间质转化(EMT)是上皮细胞向间充质细胞转化的现象,使上皮细胞失去极性,细胞骨架重塑获得移动能力,现有大量研究证实该过程与肿瘤的侵袭转移密切相关[12]。实时定量PCR与 Western blot实验结果显示N-cadherin和Vimentin作为肿瘤间质指标在mimics干预后的HepG-2细胞明显上调,E-cadherin明显下调。因此,可以认为miRNA-106a促进了肝癌细胞株HepG-2的EMT过程,增强了肿瘤细胞的侵袭能力,并且transwell实验也观察到肝癌细胞的穿膜数量增加,侵袭力增强,可以认为miRNA-106a使肝癌细胞的侵袭力增强。
在本研究中,我们在肝癌组织中检测到miR-106a的表达水平明显升高,而在对肝癌细胞内源性miR-106a的水平干预后,结果显示miR-106a可以促进肝癌细胞增殖、侵袭,而抑制其水平后可以得到相反的结果,实时定量PCR及western blot结果提示抑癌基因TGFBR2可能是miR-106a的靶基因,并且EMT指标E-cadherin、N-cadherin 和 Vimentin 的 水 平 也 受 到miR-106a调控。以上结果说明miR-106a在肝癌细胞中对增殖和侵袭有重要作用,而miR-106a在肝癌中其他的靶基因需要进一步研究,以确认其促进肿瘤发生发展具体机制,为miRNA的临床治疗提供基础理论依据。
[1] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[2] Friedman RC,Farh KK,Burge CB,et al.Most mammalian mRNAs are conserved targets of microRNAs[J].Genome Res,2009,19(1):92-105.
[3] Catela IT,Aralica G,Cacev T,et al.miR-106aoverexpression and pRB downregulation in sporadic colorectal cancer[J].Exp Mol Pathol,2013,94(1):148-154.
[4] 王 欢,翁国星,陈智群,等.早期非小细胞肺癌组织中miR-106a的表达变化及意义[J].山东医药,2010,50(22):51-52.
[5] Zhang B,Pan X,Cobb GP,et al.microRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302(1):1-12.
[6] 时宿妹,张 越,张传宇,等.2种微小RNA实时定量PCR检测方法的比较[J].生物技术通讯,2010,21(3):377-384.
[7] Derynck R,Akhurst RJ,Balmain A.TGF-beta signaling in tumor suppression and cancer progression[J].Nat Genet,2001,29(2):117-29.
[8] Mamiya T,Yamazaki K,Masugi Y,et al.Reduced transforming growth factor-beta receptor II expression in hepatocellular carcinoma correlates with intrahepatic metastasis[J].Lab Invest,2010,90(9):1339-1345.
[9] Tan AR,Alexe G,Reiss M.Transforming growth factorbeta signaling:emerging stem cell target in metastatic breast cancer[J].Breast Cancer Res Treat,2009,115(3):453-95.
[10] Jiang Y,Wu Y,Greenlee AR,et al.miR-106a-mediated malignant transformation of cells induced by anti-benzo[a]pyrene-trans-7,8-diol-9,10-epoxide[J].Toxicol Sci,2011,119(1):50-60.
[11] Catela IT,Aralica G,Cacev T,et al.miR-106aoverexpression and pRB downregulation in sporadic colorectal cancer[J].Exp Mol Pathol,2013,94(1):148-154.
[12] 张 斌,黄洪章.miRNA调控EMT与口腔癌化疗耐药关系的研究进展[J].中国口腔颌面外科杂志,2011(5):435-438.
