姜黄素对胃癌细胞放疗增敏作用的研究*
2014-04-27西电集团医院普外科西安710077闫国诚王双全牟亚刚
西电集团医院普外科(西安710077) 吴 宏 闫国诚 王双全 王 凯 牟亚刚 张 毅
临床上一些肿瘤对放疗敏感性较差,而放射剂量的增加多会伴随较为严重的副作用。通过有效放射增敏剂来提高肿瘤细胞的放射敏感性,改善放疗效果,降低放射剂量是解决这一问题的有效手段之一。姜黄素是从姜科植物的根茎中提取出的一种酚类色素,具有抗氧化、抗炎、抗肿瘤和降血脂等多种作用,能够诱导肿瘤细胞的凋亡[1]、抑制肿瘤细胞的转移和侵袭[2]并能够逆转肿瘤细胞耐药、增强放、化疗敏感性[3-5]。本研究以胃癌细胞株SGC-7901为研究对象,旨在探讨姜黄素是否对胃癌细胞株SGC-7901有放射增敏作用,为胃癌的放化疗综合治疗提供有益的实验依据。
材料与方法
1 药物与细胞培养 姜黄素购自SIGMA公司,以二甲基亚砜(DMSO)溶解制成10mmol/L的储存液备用。人胃癌细胞株(SGC-7901)为本实验保有,细胞培养采用DMEM培养基(10%胎牛血清、青霉素80U/ml、链霉素100U/ml),置于37℃,5%CO2培养箱中培养。
2 MTT实验 96孔培养板中每孔接种1×104细胞,培养至贴壁,更换为含姜黄素的培养液200μl,使终浓度分别为0、5、10、15、20、40、60、80μmol/L,每一浓度设5个复孔,并设空白调零组,培养24h,培养结束后每孔加入MTT试剂20μl,继续培养4h。酶标仪检测吸光度值,并计算抑制率。
3 Annexin V荧光染色检测细胞凋亡 参照朱青[6]等的实验方法检测姜黄素对细胞凋亡的影响。细胞分为3组,姜黄素浓度分别为0、5、10μmol/L。取生长指数期细胞,分别加入姜黄素后继续培养24h,胰酶消化并收集细胞,离心10min,弃上清液。4℃预冷PBS洗涤2遍,按试剂盒说明书操作,检测细胞凋亡情况。重复实验3次。
4 姜黄素对胃癌细胞细胞周期的影响 实验分组情况:空白对照组(DMSO),单纯药物组(DMSO和姜黄素),单纯照射组(DMSO和照射)和姜黄素加照射组(DMSO、姜黄素和照射),利用文献[7]等的方法检测姜黄素和放射治疗对细胞周期的影响。
结 果
1 姜黄素对胃癌细胞株SGC-7901的抑制作用及浓度选择 姜黄素能够抑制胃癌细胞株SGC-7901的增殖,且这种作用随着浓度的升高而增强(见表1)。在低于10μmol/L浓度时,姜黄素对胃癌细胞的抑制率低于10%,根据放疗增敏剂的筛选原则,故本实验选用5、10μmol/L浓度为放疗增敏浓度。
2 姜黄素对胃癌细胞的放疗增敏作用 姜黄素预处理后的存活分数均低于单纯照射组 (F浓度=5.63,P<0.05,表2)。
3 姜黄素对胃癌细胞株SGC-7901凋亡的影响姜黄素能够诱导胃癌细胞株SGC-7901的凋亡,这种作用随着药物浓度的增加而增强。5和10μmol/L姜黄素处理后,细胞的凋亡率是8.9±0.67% 和11.9±0.93%(附图)。与对照相比具有统计学差异(P<0.05),且10μmol/L姜黄素干预组凋亡率高于5μmol/L组(P<0.05)。
4 姜黄素对细胞周期分布的影响 见表3。单纯药物组和单纯照射组细胞的G2/M其细胞的较对照明显升高(P<0.05)。而姜黄素加照射组G2/M期细胞比例明显高于姜黄素组和单纯照射组(P<0.05)。

表1 姜黄素对人胃癌细胞株SGC-7901增殖的抑制作用(μmol/L,24h)
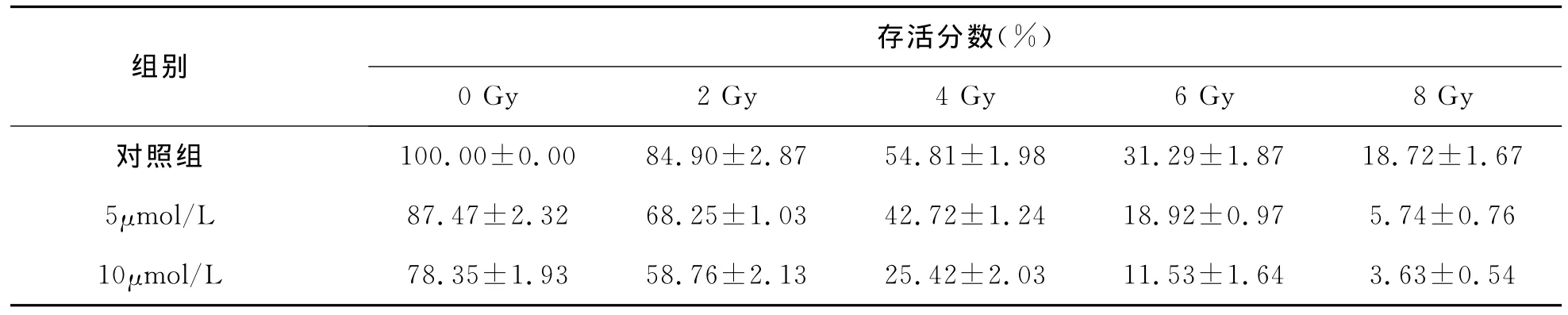
表2 姜黄素对不同剂量X射线照射后胃癌细胞株SGC-7901存活分数的影响
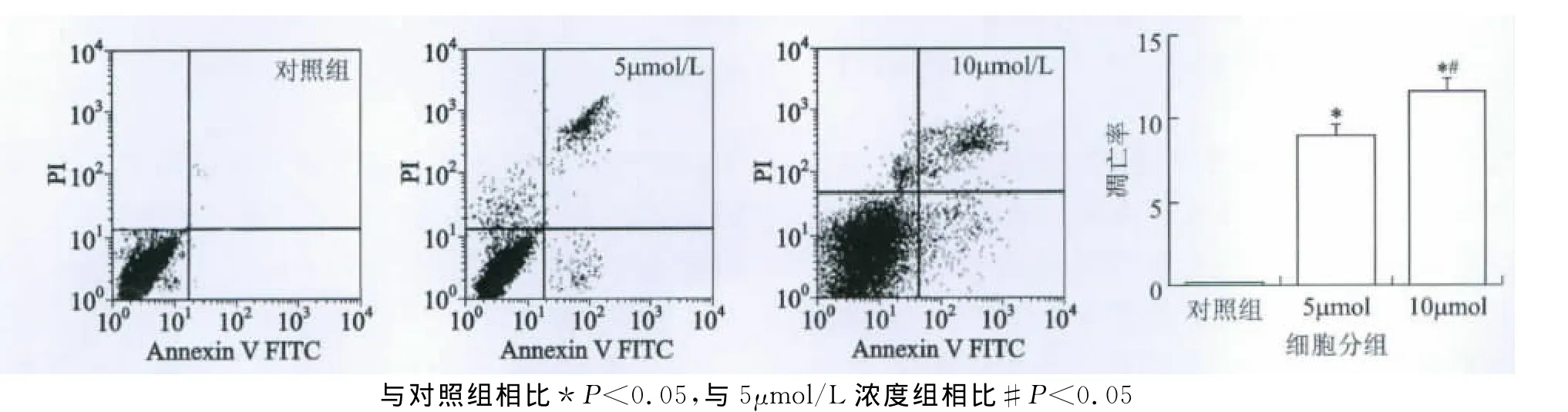
附图 三组细胞的凋亡率及对三组细胞的凋亡的统计结果
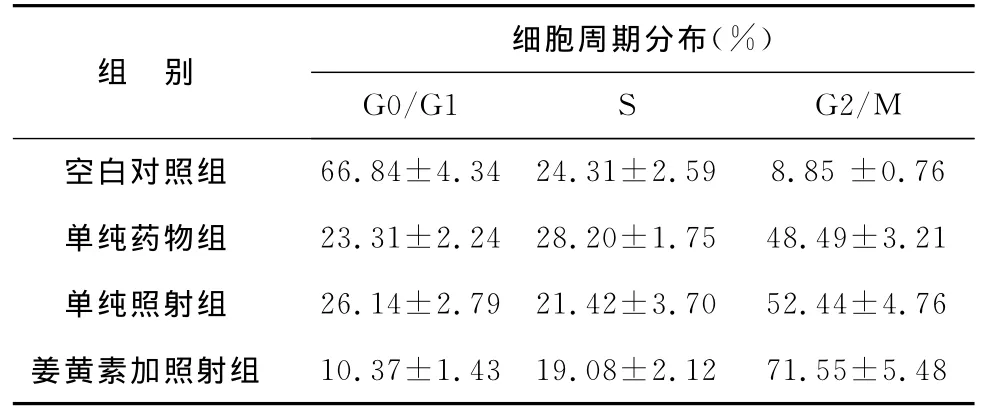
表3 各组细胞周期分布情况
讨 论
既往研究发现,姜黄素具有抗肿瘤[8]作用,也有研究发现姜黄素具有放疗增敏作用[3-5],但是在胃癌的相关研究中尚未见相关报道,本研究发现,姜黄素能够明显提高胃癌细胞株SGC-7901的放疗敏感性,且具有明显的疗效关系。本研究的结果表明姜黄素作用细胞24h后,在相同X射线照射剂量下,实验组集落数和细胞存活分数较空白对照组降低,高浓度实验组的降低更为明显。
肿瘤细胞的放射敏感性与与凋亡密切相关,研究表明凋亡在放射治疗中发挥至关重要的作用,促进细胞凋亡的药物往往具有放疗增敏的作用[9]。本研究发现姜黄素能够促进胃癌细胞株SGC-7901的凋亡,且这种作用随着药物浓度的增加而增强。
除凋亡外,细胞的周期分布也与细胞的放疗敏感性密切相关。各周期的细胞的敏感性从高到低排列如下:G2后期和 M 期,G1/S边界,S后期及G1早期。研究发现促使肿瘤G1/S期细胞向G2/M期的转换,是提高肿瘤放射敏感性的重要途径之一[10]。本研究发现,单纯的姜黄素或放射干预均会引起细胞中G2/M期比例增高,与对照组相比这种差异具有统计学意义。姜黄素联合放射干预后,细胞中G2/M的比例进一步增高,与姜黄素和放射单纯干预组相比这种差异具有统计学意义。说明姜黄素对胃癌细胞的周期分布有明显影响,具有G2/M期阻滞作用。这提示姜黄素对胃癌细胞株SGC-7901的放疗增敏作用可能与其能够促进细胞的G1/S期向G2/M期的转换相关。
本研究证实姜黄素对人胃癌细胞株SGC-7901具有明显的放疗增敏作用,细胞对射线诱导凋亡的敏感性提高、细胞周期G2/M期阻滞作用在其作用机制中发挥了重要的作用。
[1] Yang CW,Chang CL,Lee HC,et al.Curcumin induces the apoptosis of human monocytic leukemia THP-1cells via the activation of JNK/ERK pathways[J].BMC Complement Altern Med,2012,12:22.
[2] Gradisar H,Keber MM,Pristovsek P,et al.MD-2as the target of curcumin in the inhibition of response to LPS[J].J Leukoc Biol,2007,82(4):968-974.
[3] Sandur SK,Deorukhkar A,Pandey MK,et al.Curcumin modulates the radiosensitivity of colorectal cancer cells by suppressing constitutive and inducible NF-kappaB activity[J].Int J Radiat Oncol Biol Phys,2009,75(2):534-542.
[4] Park EJ,Yoon J,Choi K,et al.Induction of chronic inflammation in mice treated with titanium dioxide nanoparticles by intratracheal instillation[J].Toxicology,2009,260 (1-3):37-46.
[5] Shi HS,Gao X,Li D,et al.A systemic administration of liposomal curcumin inhibits radiation pneumonitis and sensitizes lung carcinoma to radiation[J].Int J Nanomedicine,2012,7:2601-2611.
[6] 朱 青,张王刚,刘苏虎,等.姜黄素诱导肿瘤细胞凋亡的实验研究[J].陕西医学杂志,2005,34(10):1185-1186.
[7] 邓怀慈,韩苏夏,陈 谦,等.姜黄素对人宫颈癌Hela细胞放射敏感性影响的实验研究[J].陕西医学杂志,2004,33(5):393-394.
[8] 韩苏夏,张晓智,陈 葳,等.姜黄素抗肿瘤作用及其机制研究进展[J].陕西医学杂志,2002,31(11):1006-1008.
[9] Tofilon PJ,Camphausen K.Molecular targets for tumor radiosensitization[J].Chem Rev,2009,109(7):2974-2988.
[10] Simoens C,Vermorken JB,Korst AE,et al.Cell cycle effects of vinflunine,the most recent promising Vinca alkaloid,and its interaction with radiation,in vitro[J].Cancer Chemother Pharmacol,2006,58(2):210-218.
