应用免疫荧光技术推断皮肤烫伤时间
2014-04-27郑吉龙
任 鹏 郑吉龙 单 迪
(中国刑警学院 辽宁 沈阳 110035)
应用免疫荧光技术推断皮肤烫伤时间
任 鹏 郑吉龙 单 迪
(中国刑警学院 辽宁 沈阳 110035)
制作小鼠皮肤烫伤模型,应用免疫荧光技术分别对小鼠皮肤烫伤后不同时间标记MPO、F4/80及α-SMA,以此统计中性粒细胞、巨噬细胞及肌成纤维细胞的表达情况。结果发现综合此3种细胞表达时序性变化可更加准确推断皮肤烫伤时间,与HE染色结果比较,免疫荧光技术更加敏感可靠。
免疫荧光染色 皮肤烫伤 MPO F4/80 α-SMA
1 材料与方法
1.1 小鼠皮肤烫伤模型制作与分组
健康成年昆明系SPF级小鼠35只,雌雄不限,体质量25g~35g,随机分为7组,其中1个对照组,6个烫伤组,每组5只。小鼠背部皮肤备皮,戊巴比妥钠(50mg/kg)腹腔麻醉后,将小鼠四肢伸展俯卧状固定。室温下(20℃~24℃),使沸水与烫伤组小鼠皮肤持续接触10s,接触面积(烫伤面积)为直径1cm圆形。烫伤后小鼠不给予任何处理实验条件下,分笼饲养并分别于伤后1d、3d、5d、7d、10d及14d乙醚麻醉处死,以背部烫伤区为中心取材2cm×2cm皮肤,用4%多聚甲醛中性液固定后,常规脱水、透明、浸蜡、包埋,制作5μm石蜡切片。
1.2 免疫荧光染色
常规脱蜡、脱苯、水化;5%BSA封闭1h;滴加用抗体稀释液稀释的兔抗小鼠MPO(1∶200)、大鼠抗小鼠F4/80(1∶200)、兔抗小鼠α-SMA(1∶200)IgG多克隆抗体,保湿盒内4℃孵育过夜;滴加FITC标记的山羊抗兔IgG、Alexa Fluor 488-山羊抗大鼠IgG二抗,室温下保湿盒内避光孵育2h;滴加Hoechst33258,室温下避光保湿盒内3min;滴加抗荧光淬灭剂封片,荧光显微镜观察;染色过程中以PBS替代一抗作为阴性对照,常规做HE染色。
1.3 阳性细胞计数分析
普通光学显微镜×400下,烫伤区及烫伤周边区每张切片中随机选择10个视野,分别计数中性粒细胞及巨噬细胞的细胞总数,并计算这两种细胞占视野内细胞总数的百分比。荧光显微镜×400下,烫伤区及烫伤周边区每张切片中随机选择10个视野,分别计数MPO+细胞、F4/80+细胞及α-SMA+细胞的细胞总数,并计算这三种细胞占视野内细胞总数的百分比。采用SPSS13.0 for Windows软件,计量资料用均数±标准差(X±s)表示,进行单因素方差分析。
2 结果
2.1 烫伤宏观所见
小鼠皮肤烫伤后局部皮肤呈淡红色,无红斑及水泡,切开内面观可见水肿、充血,背部肌肉未见损伤。伤后1d,烫伤区界限清晰,表面干燥;伤后3d,创缘皮肤收缩,界限清晰;伤后5d~7d,痂皮形成,表面淡棕黄色,烫伤区域缩小;伤后10d,烫伤区痂皮开始脱落,烫伤区明显缩小;伤后14d烫伤区痂皮大部分脱落,烫伤区进一步缩小。
2.2 HE染色
经常规HE染色,伤后1d,可见大量炎性细胞浸润,以中性粒细胞为主;伤后3d,损伤周边上皮角形成明显,巨噬细胞增多;伤后5d,可见梭形成纤维细胞和大量巨噬细胞,可见较明显肉芽组织;伤后7d,肉芽组织内可见梭形成纤维细胞和新生毛细血管;伤后10d~14d,见大量梭形成纤维细胞,间质增多,毛囊增多。HE染色后中性粒细胞和巨噬细胞统计学分析参见表1。

表1 烫伤后各时间段的HE染色中性粒细胞和巨噬细胞百分率
2.3 烫伤区及周边区MPO+细胞、F4/80+细胞、α-SMA+细胞表达
MPO+主要在多型核粒细胞中表达,皮肤烫伤1d~7d,MPO+细胞表达逐渐减低,伤后10d~14d,MPO+细胞消失,1d MPO+细胞表达高峰。F4/80+主要在单个核细胞中表达,皮肤烫伤1d~5d,F4/80+细胞逐渐增高,伤后7d~14d,F4/80+细胞表达逐渐减低,5d F4/80+细胞表达高峰。α-SMA+主要在单个核长梭形细胞中表达,伤后1d,未见α-SMA+细胞,3d~14d α-SMA+细胞表达逐渐增高,14d α-SMA+细胞表达高峰。小鼠皮肤烫伤后各时间段的MPO+细胞、F4/80+细胞、α-SMA+细胞百分率见图,统计学分析见表2。

图 烫伤后各时间段的MPO+细胞、F4/80+细胞、α-SMA+细胞百分率
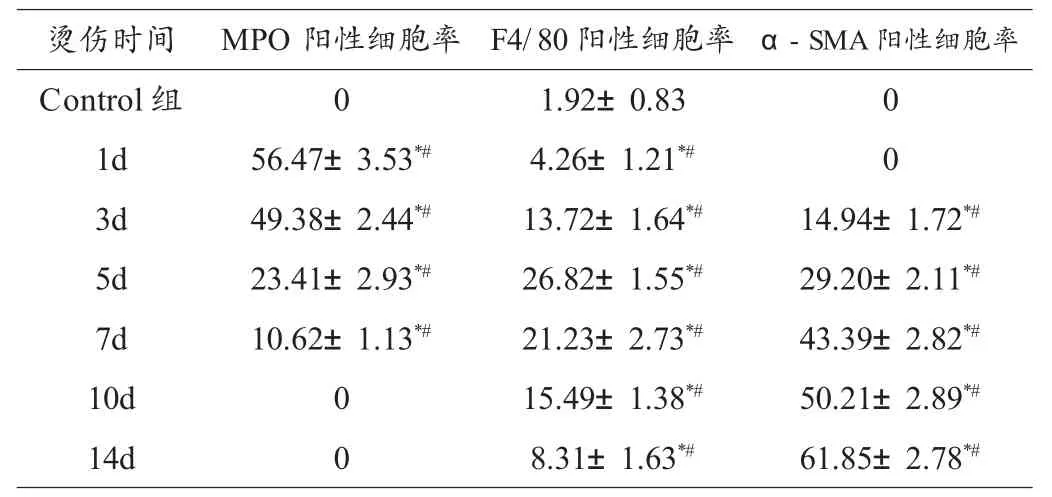
表2 烫伤后各时间段的荧光染色MPO+细胞、F4/80+细胞、α-SMA+细胞百分率
2.4 细胞计数及统计学分析
表1为HE染色下中性粒细胞阳性细胞和巨噬细胞计数百分率,经统计学分析,各相邻两组之间中性粒细胞细胞和巨噬细胞计数百分率有统计学差异(P<0.05)。表2为免疫荧光技术染色下MPO+细胞、F4/80+细胞、α-SMA+细胞百分率,经统计学分析,各相邻两组之间MPO+细胞、F4/80+细胞、α-SMA+细胞百分率有统计学差异(P<0.05)。
3 讨论
皮肤烫伤是法医学中经常遇到的损伤,烫伤时间推断也是法医学工作难点。皮肤烫伤愈合是一个连续而又复杂的生理过程,和通常皮肤损伤一样大致可分为三个阶段:急性渗出期、纤维增生期和组织重建期。在急性渗出期,各种类型的炎症细胞,例如中性粒细胞和巨噬细胞,浸润到损伤区域参与清除损伤坏死组织、异物及入侵的病原体等。在纤维增生期,肌成纤维细胞主要参与损伤组织的修复。本文制作小鼠皮肤深Ⅱ°烫伤模型,观察发现早期小鼠皮肤全层烫伤,组织疏松,内面红肿。镜下损伤早期可见炎症细胞浸润,以中性粒细胞为主,并可见少量巨噬细胞。随着损伤时间的延长,可见中性粒细胞逐渐减少,巨噬细胞逐渐增多,并开始出现肌成纤维细胞和成纤维细胞并且数量逐渐增加;随着皮肤愈合过程的进一步延长,肌成纤维细胞和成纤维细胞开始逐渐减少,胶原纤维开始形成,肉芽组织向瘢痕组织转变。
本研究采用免疫荧光技术对中性粒细胞、巨噬细胞和肌成纤维细胞标记,把这3种细胞在皮肤烫伤愈合过程中时序性表达情况统计分析。免疫荧光技术基本原理是抗原抗体反应,对某种特定细胞抗原给予相匹配的抗体,由于抗原抗体之间存在高度特异性,当抗原出现数量或位置变化时,抗体也会出现相应的变化,将荧光素标记在抗体上,在荧光显微镜下观察就会出现特异性的荧光。免疫荧光技术优点在于敏感度高,比较免疫组织化学技术来看,虽同为抗原抗体反应,但其荧光的敏感度远远大于免疫组化的生物素标记。特异性好,利用抗原抗体反应高度特异性,在观察某种特定细胞时,只要标记该细胞的特异性抗原就可以辨别,这一点是HE染色、Masson染色等噬色性染色所无法比拟的。比较分析HE染色和免疫荧光技术对中性粒细胞呈现情况来看,烫伤早期1d和3dHE染色计数中性粒细胞数量要低于免疫荧光技术计数数量,这可能由于炎症早期中性粒细胞多以2~3分叶核细胞为主,在HE染色下比较难以鉴别为中性粒细胞,从而被漏计数;而免疫荧光技术摒弃了这个缺点,只要存在MPO阳性就为中性粒细胞,大大提高了敏感度和特异性。烫伤中期5d和7dHE染色计数中性粒细胞数量和免疫荧光技术计数数量基本相同,这可能是由于HE染色中一些裸核中性粒细胞也被计数其中,裸核中性粒细胞是“死亡”的中性粒细胞没有计数意义,而在免疫荧光技术计数中裸核中性粒细胞无免疫荧光表达而不被计数,此阶段HE染色计数中性粒细胞数量和免疫荧光技术计数数量虽基本一致,但HE染色中把一些死亡中性粒细胞也包括在内,这是一种伪敏感度提高。比较分析HE染色和免疫荧光技术对巨噬细胞呈现情况来看,HE染色中,巨噬细胞表现为细胞较圆较大,核圆大居中,而在免疫荧光技术F4/80阳性的为巨噬细胞,通过多人对2种染色技术中巨噬细胞数量计数,对比两者数据来看,HE染色计数数据的标准差明显高于免疫荧光技术计数数据的标准差,这一点说明免疫荧光技术具有更高的准确性和易辨别性,大大降低不同人对巨噬细胞计数的误差。比较分析HE染色和免疫荧光技术对肌成纤维细胞呈现情况来看,HE染色基本无法确认肌成纤维细胞,α-SMA阳性是肌成纤维细胞,通过免疫荧光技术检测肌成纤维细胞的优势是不言而喻的。
本实验表明,MPO阳性率烫伤愈合过程与时间呈负相关,随着烫伤时间延长其阳性率逐渐下降以至消失,1d表达高峰。F4/80阳性率在烫伤愈合过程中,随着烫伤时间延长呈单峰状分布,5d表达高峰。α-SMA阳性率烫伤过程中呈正相关,随着烫伤时间延长其阳性率逐渐上升,14d表达高峰。皮肤烫伤1d MPO阳性率>50%,F4/80阳性率<5%,无α-SMA表达;皮肤烫伤3d MPO阳性率≈50%,F4/80阳性率和α-SMA阳性率均<5%;皮肤烫伤5d MPO阳性率、F4/80阳性率及α-SMA阳性率三者均<30%;皮肤烫伤7d MPO阳性率<15%,F4/80阳性率<25%,α-SMA阳性率>40%;皮肤烫伤10d无MPO表达,F4/80阳性率<20%,α-SMA阳性率≈50%;皮肤烫伤14d无MPO表达,F4/80阳性率<10%,α-SMA阳性率>60%。通过以上数据综合判断皮肤烫伤时间具有很高准确性。
4 小结
皮肤烫伤时间推断是国内外法医学研究的空白领域。本实验通过免疫荧光技术检测皮肤烫伤愈合过程中急性期、增生期和重建期三种主要的细胞,通过对其阳性率统计和与普通HE染色比较,发现可以大幅度提高烫伤时间推断准确性,检测方法特异性敏感性都显著高于以往方法。
[1]KubiliusD,Smailyte G,Rimdeikiene I,et al. Epidemiology of paediatric burnsin Lithuania:Focus on a vulnerable population exposed to the risk ofscaldsat home withouthottapwatersupply[J].Burns,2013,(13).
[2]任鹏,官大威,赵锐,等.小鼠皮肤烫伤模型的建立[J].法医学杂志,2012,28(2).
[3]FrodlundM,DahlstromO,KastbomA,.etal. Associationsbetween antinuclear antibodystainingpatterns andclinicalfeaturesofsystemiclupuserythematosus:analysis ofaregionalSwedishregister[J].BMJOpen,2013,3(10).
[4]Waugh N,CumminsE,Royle P,et al.Faecal calprotectintestingfordifferentiatingamongstinflammatory and non-inflammatory bowel diseases:systematic review andeconomicevaluation[J].HealthTechnolAssess,2013,17(55).
[5]Khalatbary AR, Ahmadvand H.Effect of oleuropein on tissue myeloperoxidase activity in experimental spinal cord trauma[J].Iran Biomed J,2011,15(4).
[6]Kurashige C,Hosono K,Matsuda H,et al. Roles of receptoractivity-modifying protein 1 in angiogenesis and lymphangiogenesis during skin wound healingin mice[J].FASEBJ,2013,(5).
[7]Serrat N,Sebastian C,Pereira-LopesS,et al. The Response of Secondary Genesto Lipopolysaccharides in Macrophages Depends on Histone Deacetylase and PhosphorylationofC/EBPβ[J].JImmunol,2013,(4).
[8]PillaiMM,HayesB,Torok-StorbB.Inducible transgenes under the control of the hCD68 promoter identifiesmousemacrophageswith adistribution that differs from the F4/80-and CSF-1R-expressingpopulations[J]. ExpHematol,2009,37(12).
[9]Park HH,Park IH,Cho JS,et al.The effect ofmacrolideson myofibroblast differentiation and collagen production in nasal polyp-derived fibroblasts[J].Am J RhinolAllergy,2010,24(5).
[10]VanheuleE,GeertsAM,VanHuysseJ,etal.An intravitalmicroscopicstudyofthehepaticmicrocirculationin cirrhotic mice models:relationship between fibrosis and angiogenesis[J].IntJExpPathol,2008,89(6).
(责任编辑:于 萍)
DF795.4
A
2014-01-05
公安部重点攻关计划项目(编号:2011ZDYJXJXY005);辽宁省博士启动基金项目(编号:20141048)。
任鹏(1985-),男,辽宁锦州人,中国刑警学院法医系助教,硕士,主要从事法医病理学研究。
