改性黏土絮凝海洋原甲藻对水体中氮、磷的影响研究
2014-04-26卢光远宋秀贤俞志明曹西华袁涌铨中国科学院海洋研究所海洋生态与环境科学重点实验室山东青岛26607中国科学院大学北京00049
卢光远,宋秀贤,俞志明,曹西华,袁涌铨(.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东 青岛 26607;2.中国科学院大学,北京 00049)
改性黏土絮凝海洋原甲藻对水体中氮、磷的影响研究
卢光远1,2,宋秀贤1*,俞志明1,曹西华1,袁涌铨1(1.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东 青岛 266071;2.中国科学院大学,北京 100049)
通过对比研究典型有害微藻海洋原甲藻(Prorocentrum micans Ehrenberg)自然消亡(A1组)及改性黏土絮凝(A2组)两种体系,考察两体系中氮、磷等主要水质因子的变化情况.结果表明,改性黏土能有效去除P. micans并影响其后期生长状态,0.4g/L改性黏土添加3.5h后去除率可达60%以上,且藻密度无二次增长.改性黏土絮凝藻华过程中能有效去除水体营养元素, A2组DIP和DIN较A1组分别降低85%和35%.另外,添加改性黏土对水体有机氮、磷影响值得关注,第33d A2组TON和TOP较A1组分别减少约120, 6µmol/L. 改性黏土对有机氮、磷存在一定的埋存保护作用,通过吸附絮凝、螯合等作用使有机氮、磷脱离水体系统,而自然消亡体系中的微藻消亡后将通过分解、矿化等过程快速进入水体参与再循环.该研究系统阐述了改性黏土絮凝P. micans对水体营养环境的影响,以期为现场治理提供理论支持.
有害藻华;改性黏土;有害藻华治理;营养盐去除;海洋原甲藻;生态效应
有害藻华(HABs)是水生环境中时常发生的自然现象[1].近年,受人类活动影响,有害藻华持续时间和范围都有所扩大[1].在众多治理有害藻华的策略中,改性黏土作为经济、高效、环境友好型材料在沿岸和养殖水域治理有害藻华方面应用最为广泛,并在我国近岸开放水域得到多次成功应用[2-3].海洋原甲藻(Prorocentrum micans Ehrenberg)是一种广范分布的特征有害甲藻[4],由该种引起的有害藻华在我国沿岸时有发生[1],最高密度达到 106个/L,占浮游植物总密度的94.6%[5-6].目前,关于P. micans去除方面的研究较少,研究者利用沸石载铜和铁盐增效剂[7]、杀藻剂
[8]、大米草(Spartina anglica)[9]和石莼(Ulva pertusa、Ulva linza、Ulva lactuca)提取物[10-11]、黄杆菌科溶藻细菌[12]来抑制 P.micans.黏土吸附水体中单一营养元素[13-15]、有机物和重金属[16-17]等方面的研究较多;部分研究考察了改性黏土絮凝过程中对滤食生物[18-20]的生长影响及对藻毒素解毒效应[21]的研究.但藻华自然消亡过程中会出现有机物好氧降解影响低氧区的形成;同时大量微藻降解在水体和沉积物表层将发生营养盐输送过程;而改性黏土絮凝有害藻华后期对主要营养元素的循环过程、界面输送、最终归宿及其他治理后期的生态效应等问题迄今尚不清楚.因此,本文针对P.micans自然消亡与改性黏土絮凝微藻两种体系,旨在通过对比研究两体系水环境中主要营养元素氮、磷的差异,对改性黏土絮凝有害藻华后期水环境的生态效应进行初探,为今后该方法野外应用提供数据支持和理论依据.
1 材料与方法
1.1 微藻培养及改性黏土制备
海洋原甲藻(P. micans Ehrenberg)取自中国科学院海洋研究所藻种库.将处于指数增长期的藻种接至2个3L的三角烧瓶中,初始密度约107个/L.藻细胞在温度(20±1)℃,冷白光强 50~60μE/ (m2⋅s),光暗比12h:12h条件下培养,每天定时进行手动摇匀,后期絮凝实验操作相同[23].絮凝实验开始前,所有实验用具进行 5%HCl浸泡 24h处理;0.45μm混合纤维膜预先用1:3HCl浸泡,蒸馏水冲洗备用.天然海水(经 0.45μm混合纤维膜过滤),营养盐试剂,培养器皿均进行121℃下高温灭菌[22].海水的pH值和盐度分别为8.2和30.在灭菌海水中添加无硅的 f/2培养液[23].添加改性黏土絮凝实验前用超纯水临时配制 20g/L的改性黏土使用液,配制方法同俞志明等[24-25].
1.2 实验设计
P. micans培养第 11d将藻液混合均匀分别置于36支50mL具塞比色管中培养.各实验组包括:自然消亡组作为对照组表示为 A1,改性黏土絮凝组作为处理组表示为A2.A2组在第13d添加改性黏土,最终改性黏土浓度为 0.4g/L,分别于第11,13,15,17,19,21,23,25,33d采集样品.
1.3 样品采集及分析方法
每次分别从比色管中采集 50mL未过滤培养液和50mL过滤(0.45μm)水样,其中约10mL用于当日测定基本参数;20mL用于总无机营养盐和溶解态营养盐测定,20mL用于总氮、总磷和总溶解氮磷测定,样品密封冻存于-20℃待分析.A2组需改性黏土添加混匀后静置 3.5h,于液面下3cm 处移取藻液测定活体叶绿素 a荧光值(TD700),并用 Lugol试剂固定样品,在倒置显微镜(Nikon Diaphot)下进行镜检细胞计数,同时测定pH值.PO43--P采用抗坏血酸磷钼蓝法,最低检测限为0.03μmol/L,NH4+-N采用次氯酸钠-苯酚法,最低检测限为0.04μmol/L, NO3--N采用Cd还原为NO2
--N采用盐酸萘乙二胺法,最低检测限为0.07μmol/L;总氮、总磷经过硫酸钾高温消解法处理后,用 San++Skalar-1000营养盐自动分析仪测定.各有机组分为总量与无机组分的差值.
浮游植物细胞比增长率 μ=(lnNt−lnN0)/(t−t0),单位为 d-1[26-27];改性黏土对藻细胞去除率 RE= (1−Nt/N11)×100;单位藻均营养物质浓度 τ=Ct/Nt(单位为μmol/cell).公式中t0、t是实验初始时间和采样时间; N0、N11、Nt分别是初始时间、第11d、第t d的藻密度; C11、Ct分别是第11d、第t d的营养元素物质的量浓度.所有样品(包括藻细胞、pH值、营养盐)数据采用单因子方差分析(SPSS 16.0),显著性差异P<0.05.
2 结果
2.1 海洋原甲藻生长变化情况
A1组前10d P. micans藻细胞生长维持自然指数增长状态,然后藻细胞维持4d高密度(5.70± 0.10)×107个/L,第30d衰减至(0.27±0.06)×107个/L. A2组第 13d藻密度添加改性黏土后减少至(2.33±0.06)×107个/L,此后基本维持低密度(图1).
A1组活体叶绿素荧光值(Fa)表现出与藻密度类似的变化趋势.改性黏土添加后,A2组Fa快速降低到 232.3fsu,第 19d突然增加至 333.9fsu,此后一直维持比A1高的水平(图1).
2.2 不同形态磷营养盐变化特征
A1组TP浓度从第11d的34.98μmol/L逐渐减少为第33d的27.42µmol/L,TDP和DIP表现出相似的变化趋势,第 33d浓度分别达到 5.73, 3.07μmol/L (图2a).然而,添加改性黏土后(A2组) TP浓度不断降低至第33d的15.78μmol/L,较同期A1组降低约12μmol/L(图2a),TDP和DIP浓度较 A1组均迅速下降,分别降至 0.56, 0.42μmol/L,此后分别维持低浓度(图2a).
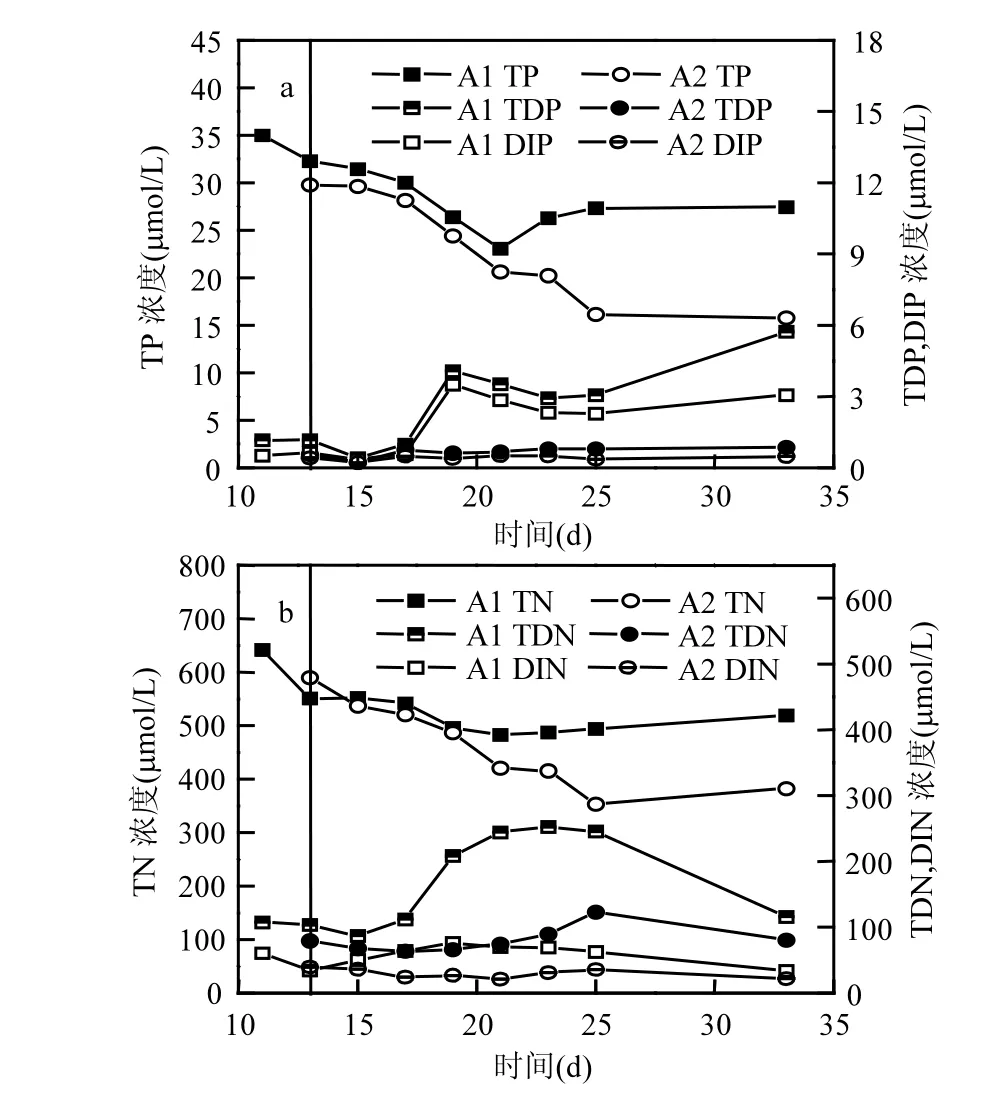
图2 对比体系水体中氮、磷变化特征Fig.2 Variation of phosphorus and nitrogen in experimental treatmentsa:总磷(TP),总溶解态磷(TDP)和溶解无机磷(DIP)浓度变化; b:总氮(TN),总溶解态氮(TDN),溶解无机氮(DIN)浓度变化
2.3 不同形态氮营养盐变化特征
2.3.1 氮营养盐总体变化特征 自然消亡(A1)组TN浓度第21d出现最低值(482.50μmol/L), TDN和DIN浓度均是在19~23d之间出现较高值,第 33d分别降为115.99,33.57μmol/L(图2b).添加改性黏土后(A2组)TN降低至第33d的382.81μmol/L (图2b),TDN和DIN浓度均低于A1组.
2.3.2 溶解态无机氮各组分变化特征 A1组DIN中NO3
--N从第11d的23.99μmol/L迅速降低至第 13d的 3.93μmol/L至第 33d浓度2.50μmol/L;NH4+-N与NO2--N变化类似,第19d出现高浓度67.85,4.39μmol/L而后降为第33d的30.14,0.94μmol/L(图3).第13d改性黏土使A2组中NH4+-N和NO3--N略升至29.94,5.98μmol/L,第33d降为20.53,0.76μmol/L,NO2--N浓度变化较A1组缓和,末期降为0.49μmol/L (图3).
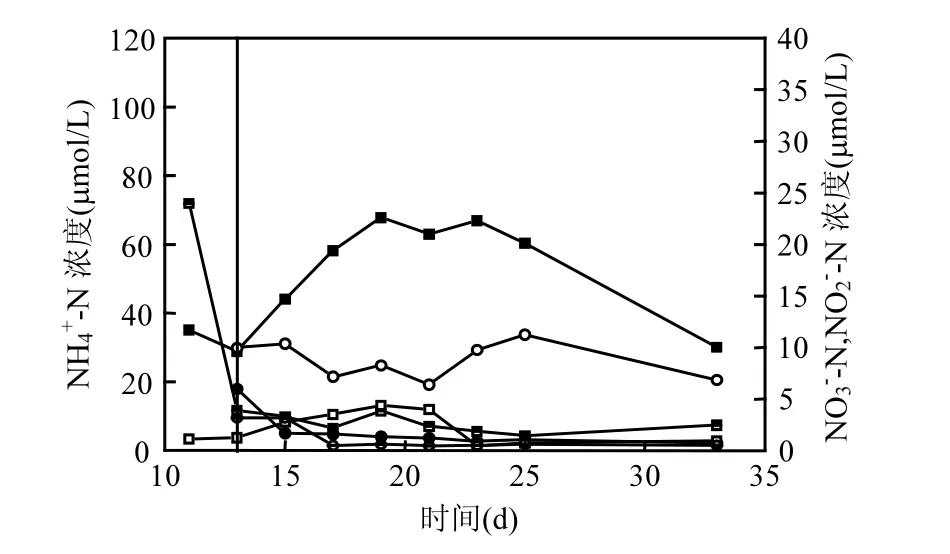
图3 对比体系水体中溶解态无机氮变化特征Fig.3 Variation of dissolved inorganic nitrogen in experimental treatments
3 讨论
3.1 海洋原甲藻自然消亡沉降及改性黏土影响A1组P. micans藻细胞比增长率μ最大值为0.27d-1,第15d后进入消亡期,与王正方等的结果一致[5].A1组不同生长期 Fa值与细胞密度均呈现出显著的正相关关系(指数期:R2=0.8430, P=0.0098;消亡期:R2=0.9584,P<0.0001) (图4a),由此可知相同藻密度下消亡期Fa值较指数增长期有所增加,可能是消亡期藻细胞释放出胞内叶绿素荧光有机物并未在短时间内完全分解,从而出现相同藻密度下 Fa值较高的现象.A2组第13d添加改性黏土后藻细胞去除率达到 60%,第 15d后去除率达到80%,第23d后藻细胞进入加速消亡过程,而A2组Fa值与藻密度正相关趋势不变(R2=0.9083,P=0.0003;图 4a),但在相同藻密度下,A2组较A1组具有更高的活体叶绿素荧光值.
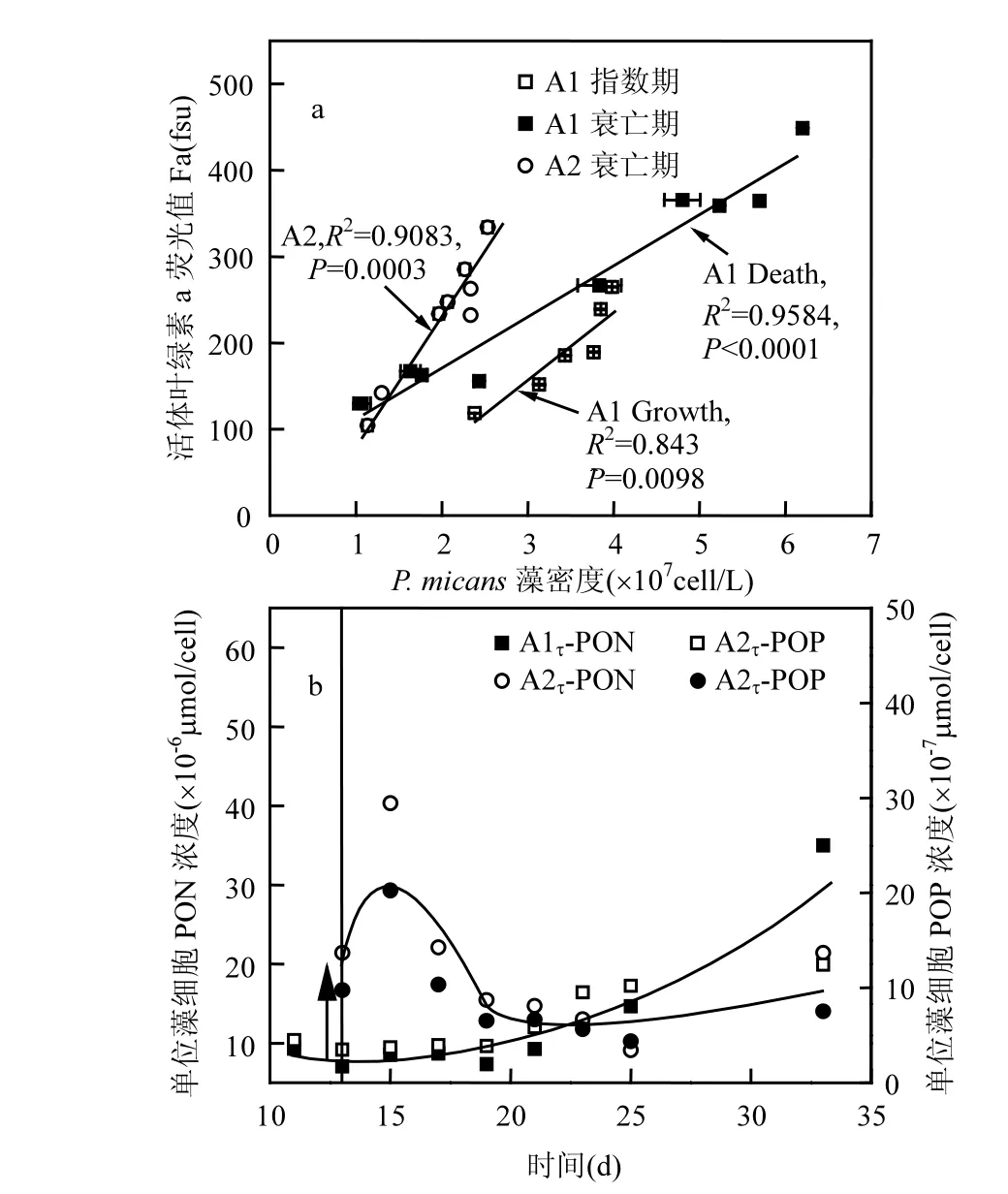
图4 藻细胞密度与活体叶绿素荧光值相关曲线(a)和单位藻细胞有机氮、磷含量变化特征(b)Fig.4 Changes of microalgae cell concentrations with in vivo chlorophyll fluorescence (a) and organic nitrogen and phosphorus per algal cell (b)
任保卫等[28]发现P. micans藻液中溶解有机物荧光强度在细胞消亡期有所增强,但藻密度与荧光强度的正相关关系未变,这与本研究结果一致(图 4a).同时,该文指出甲藻在指数期主要产生的溶解态荧光物质以类蛋白为主,消亡期类蛋白和类腐殖质荧光强度均迅速升高,说明不同生长阶段微藻会产生不同特性的荧光物质[28].本研究中相同藻密度下消亡期Fa值高于指数期的现象(图 4a),即反映出甲藻的该种特性;而添加改性黏土可能在短时间改变了藻细胞生存微环境,有效抑制了残留藻细胞生长,单位藻源有机氮和有机磷短时间内迅速升高佐证了这一现象(图 4b).据此可推断改性黏土一方面影响藻细胞代谢,“刺激”藻细胞合成荧光有机物质,另外在絮凝去除微藻过程中改性黏土促使藻细胞破裂释放出胞内有机物质至水体中,且并未在短时间内快速降解,该研究中溶解态营养盐实验后期无二次增加的现象证明了这点,因此出现第19d后A2组Fa值比A1组更高的现象(图1).了解改性黏土对藻细胞微环境突变的生态影响,将为该治理手段在有害藻华防控中的有效利用提供科学依据.
3.2 改性黏土对不同形态磷的影响
自然消亡A1组中TP浓度在第21d出现低值,随后有所回升,说明消亡期中有部分藻细胞碎片沉降离开水体,但随着微生物降解作用,颗粒有机磷以及大分子藻源有机磷可不断转化为无机磷重新进入水体系统,后期水体中DIP增多2.5μmol/L印证了这一过程. 由于P. micans具有磷的奢侈性消费特性[29],水体中 DIP含量在第 11d即达到低浓度(0.52μmol/L);Wang等[30]指出, P. micans对包括核苷酸和磷酸单脂等溶解有机磷利用率高于无机磷,所以由微藻分解产生的有机磷部分被微生物降解后参与再循环,还可在未被降解前直接被水体中藻细胞利用,这也是本研究两体系中TOP/TP比值维持在较高值(>58%)的原因,甲藻的这一特性也为其快速增殖和种群竞争中趋于优势地位提供有利条件.
A1组TOP减少量与DIP增加表现出较好的耦合关系(R2=0.7664,P=0.0027,图 5a),表明 P. micans自然消亡过程中藻细胞破裂释放大量颗粒有机磷进入水体,而DOP除了第33d,一直保持低浓度(<0.79μmol/L),说明颗粒有机磷向溶解无机磷转化较快,推测可能经过了 POP-DOP-DIP转化,或POP直接分解为DIP.而添加改性黏土后A2组比A1组TP减少约7.81%(表1),这归因于改性黏土直接吸附沉降造成 TP离开水体系统,此后A2组TP出现大幅降低;实验末期所有形态磷较A1组均有降低,A2组TP、TIP、TDP和DIP较A1组分别降低42.47%、51.24%、85.19%和84.75%(表1), A2组TP和DIP维持低浓度表明无磷的重新释出(图2a,5a).A2组TOP在第19d前维持大于 21μmol/L的高浓度,而后迅速降为10μmol/L低于A1组的16μmol/L,这可能是藻源有机磷与改性黏土形成的絮体发生快速自沉降离开水体,即这部分有机磷在降解前已被絮凝沉降离开水体.由此可知,改性黏土的添加一方面通过第 13d快速吸附发生自沉降使水中 DIP和DOP降低,另外改性黏土颗粒形成的胶体系统使得颗粒有机磷在后期沉降加速,而有机磷降解速率减缓,说明实验末期有更多磷被沉降离开水体环境(图2a),并未出现A1组有机磷快速降解为无机磷的现象,表明改性黏土在有机磷加速沉降的同时减缓其降解,即对有机磷具有一定的封存作用.第13~21d残留在A2组单位胞内有机磷(τ-POP)较A1组有所增加(图4b).由于改性黏土的添加吸附大量TDP,使A2组TDP从1.18μmol/L降至0.56μmol/L, TDN/TDP最大值A2组高达294(图5b),远高于微藻正常生长所需的 N/P比,这种突发性营养盐限制将对P. micans的生长形成逆境,刺激其合成更多的有机磷,造成低藻密度高有机磷现象(τ-POP,图 4b).这些结果均说明添加改性黏土的确改变了藻细胞的生境和微环境使藻细胞生长受到抑制;同时改性黏土促使藻细胞释放出的大颗粒有机磷并未像A1组快速降解为溶解磷(图5a),在实验后期出现A2组Fa高于A1组的情况(图1),这与以往研究微藻消亡期会产生不易降解的胞外类腐殖质或其他含磷类蛋白荧光物质的结果吻合[28,31-32].不同形态磷对近岸水体生态系统及磷的生物地球化学循环都具有重要意义
[33].本研究表明改性黏土对有机磷的吸附与无机磷的吸附同样值得关注,且两者吸附方式有所不同.在改性黏土絮凝去除微藻过程中,阳离子和磷发生电中和,提高了黏土对极性含磷生源高分子侨联和DIP吸附过程[36-37].另外,水体中重金属与藻源有机磷发生螯合作用(如沉积物中铁和有机物螯合[37])或高聚反应[36],以及改性黏土和水中重金属阳离子的交换作用[7,38]形成叠加效应,促使改性黏土中铝元素对磷酸盐中的氧固定吸附,形成较为稳定的结合[38].这些作用不仅阻止了无机磷的解吸,也延缓了有机磷的降解.
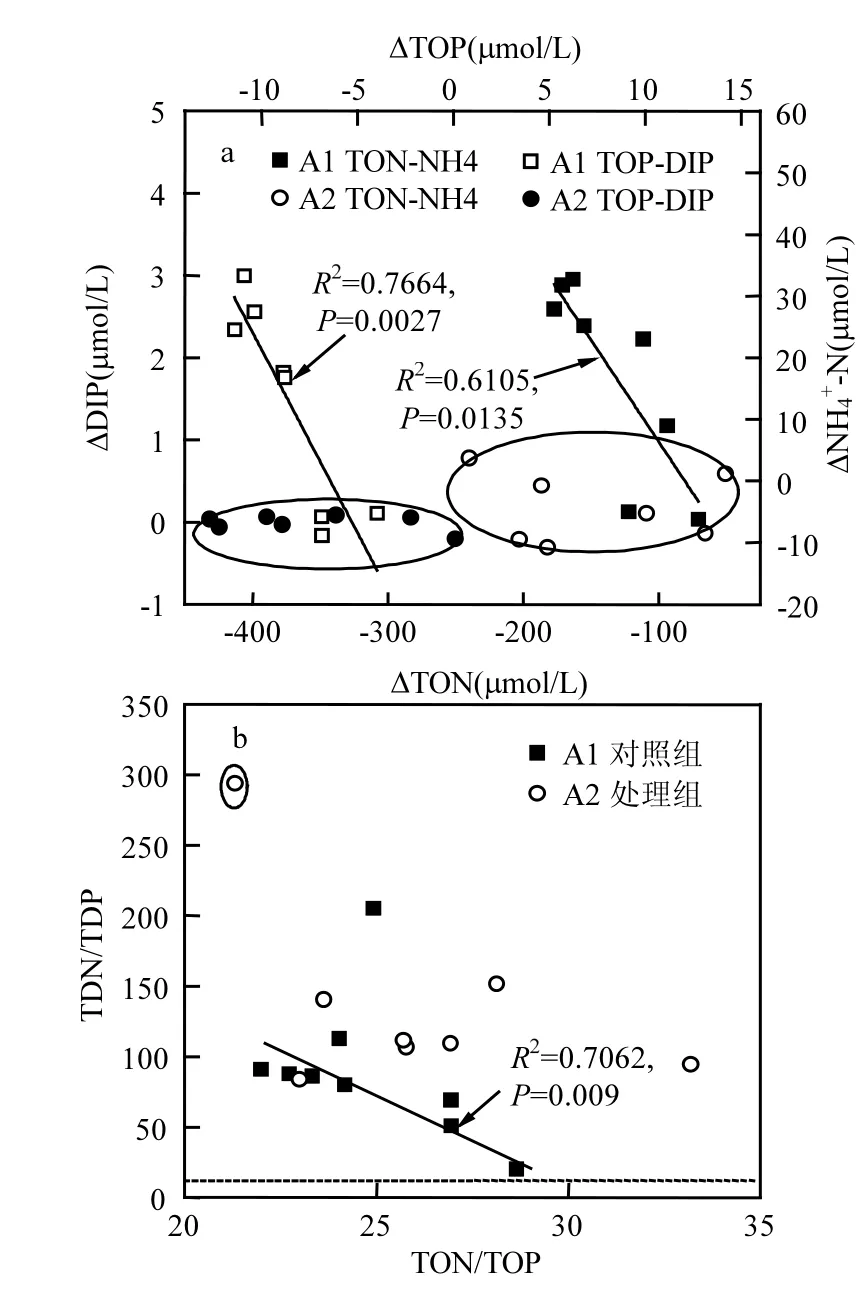
图5 有机物降解与溶解态无机营养盐增量相关性(a)及水体中有机、无机N/P比变化趋势(b)Fig.5 Relationships between algal organic nutrient degradation and dissolved inorganic nutrient productions (a) and the changes of organic and inorganic N/P ratio (b)
3.3 改性黏土对不同形态氮的影响
自然界中氮形态多样,且受微生物等外界因素影响较多[34,39].有害藻华消亡后期会出现大量有机物降解造成溶解氧降低或低氧区扩大[2],在沉积物有氧−无氧界面常伴有反硝化,厌氧氨氧化和硝酸盐异化还原氨等过程[39].A1组消亡期藻细胞发生破裂,大量胞内有机氮释放进入水体,第19d后出现PON降低,DON和NH4+-N增多的现象,说明PON发生降解转化为DON,同时A1组中NO3
--N迅速降低伴有NO2--N暂时性升高(图 3),推测发生了反硝化过程.添加改性黏土后A2组TN浓度快速降低,DON一直保持较低浓度,说明PON向DON转化的过程得到抑制.但A2组TON浓度在第21d前保持在>430μmol/L,此后迅速减少为 338μmol/L, 表1 添加改性黏土第13d及第33d水体中氮、磷营养元素浓度降低百分比[(CA1-CA2)/CA1×100%]Table 1 Declines of major nutrient at day 13 and day 33 when MC had been applied in experimental treatments 实验中,A2组第13~21d单位藻细胞有机氮含量τ-PON较A1组有所增加(图4b,黑色箭头标注),这可能是添加改性黏土对藻细胞形成遮蔽效应[24],微小颗粒改变了藻细胞的通透性,极大地影响了残留藻细胞的正常代谢.同时,分散在水体中的改性黏土颗粒通过吸附等作用改变了水体中无机氮的组成形态,即藻细胞可利用性氮源发生改变[34],从而刺激了 P. micans藻细胞吸收NO3-N合成有机氮,研究发现不同可利用性氮源可改变藻源有机物的荧光特性[40],所以第13~21d出现较高的τ-PON和Fa值. 有机氮吸附与无机氮吸附特性有所不同,无机氮吸附以物理吸附为主,有机氮吸附以化学成键吸附为主,研究表明藻细胞释放出的胺基有机物会被吸附于黏土上[41],而藻细胞碎片含有大量羧基,可与藻源含胺基等有机氮结合絮凝沉降,这两种作用均降低了有机氮与水体的接触面和氧化接触位点[41-42],从而有效阻止水体中有机氮的降解.同时,改性黏土部分吸附水体中游离微生物,降低微生物活性,在一定程度上减缓有机氮降解 [42].另外,水体中金属阳离子与有机极性分子形成螯合物封存到沉积物中[41],随着沉积物的压实脱水而封存,阻止了沉积物中有机氮快速矿化形成NH4+-N释放入水体.所以,改性黏土絮凝体系中,NH4+-N未升高可主要归因于有机氮的未降解,NO2 --N的降低可能是反硝化作用受到抑制和絮凝吸附作用引起的,而 NO3--N的降低则受控于改性黏土吸附或微藻吸收等过程.一方面改性黏土刺激了藻细胞有机氮的合成;另一方面,有机氮的降解减缓,使溶解态氮趋于保守[16].第33dA2组TN、TIN、TDN和DIN较A1组分别减少26.22%、27.65%、30.63%和35.14% (表1). 4.1 改性黏土可有效絮凝活动力较强的 P. micans,其形成的遮蔽效应和胶体缓冲体系可影响残留藻细胞的生长代谢,抑制其二次增殖. 4.2 改性黏土絮凝A2组与自然消亡A1组相比,各营养盐均呈现大幅度减少;改性黏土絮凝方法在去除微藻同时,可有效降低水体中氮、磷营养盐的浓度,特别是对有机氮和磷具有一定封存保护作用,延缓其降解,使更多的营养元素如化石埋赋一般脱离水体环境,从而起到改善水质的作用. [1] 周名江,朱明远,张 经.中国赤潮的发生趋势和研究进展 [J].生命科学, 2001,13(2):54-59,53. [2] Anderson D M. Approaches to monitoring, control and management of harmful algal blooms (habs) [J]. Ocean and Coastal Management, 2009,52(7):342-347. [3] Park S C, Lee J K, Kim S W, et al. Selective algicidal action of peptides against harmful algal bloom species [J]. Plos One, 2011,6(10):e26733. [4] 朱从举,齐雨藻,郭昌弼.铁,氮,磷,维生素b1和b12对海洋原甲藻的生长效应 [J]. 海洋与湖沼, 1994,25(2):168-172. [5] 王正方,张 庆,吕海燕.温度,盐度,光照强度和 pH对海洋原甲藻增长的效应 [J]. 海洋与湖沼, 2001,32(1):15-18. [6] 王正方,张 庆,卢 勇,等.氮、磷、维生素和微量金属对赤潮生物海洋原甲藻的增殖效应 [J]. 东海海洋, 1996,14(3):33-38. [7] 赵 玲,洪爱华,齐雨藻,等.沸石载铜除藻剂的探讨 [J]. 中国环境科学, 2002,22(3):16-18. [8] 洪爱华,尹平河,赵 玲,等.新洁而灭对海洋原甲藻赤潮生物的灭杀与抑制 [J]. 海洋环境科学, 2003,22(2):64-67. [9] 徐年军,唐 军,张泽伟,等.大米草对赤潮藻的抑制作用及其抑藻物质的分离鉴定 [J]. 应用生态学报, 2009,20(10):2563-2568. [10] Tang Y Z, Gobler C J. The green macroalga, ulva lactuca, inhibits the growth of seven common harmful algal bloom species via allelopathy [J]. Harmful Algae, 2011,10(5):480-488. [11] Jin Q, Dong S, Wang C. Allelopathic growth inhibition of Prorocentrum micans(dinophyta) byulva pertusaandulva linza (chlorophyta) in laboratory cultures [J]. European Journal of Phycology, 2005,40(1):31-37. [12] 史荣君,黄洪辉,齐占会,等.一株溶藻细菌对海洋原甲藻的溶藻效应 [J]. 生态学报, 2012,32(16):4993-5001. [13] 俞志明,马锡年,谢 阳.黏土矿物对海水中主要营养盐的吸附研究 [J]. 海洋与湖沼, 1995,26(2):208-214. [14] Certner, R, Cho, H, Gallo, N, et al. Using sediment flocculation to reduce the impacts of Chesapeake Bay Microcystis aeruginosa harmful algal blooms [J]. 2011,55-107. [15] 高咏卉,俞志明,宋秀贤,等.有机改性黏土对海水中营养盐及主要水质因子的影响 [J]. 海洋科学, 2007,31(8):30-37. [16] Wu C D, Xu X J, Liang J L, et al. Enhanced coagulation for treating slightly polluted algae-containing surface water combining polyaluminum chloride (pac) with diatomite [J]. Desalination, 2011,279(1-3):140-145. [17] Matilainen A, Vepsalainen M, Sillanpaa M. Natural organic matter removal by coagulation during drinking water treatment: A review [J]. Advances in Colloid and Interface Science, 2010,159(2):189-197. [18] Archambault M C, Bricelj V M, Grant J, et al. Effects of suspended and sedimented clays on juvenile hard clams, Mercenaria mercenaria, within the context of harmful algal bloom mitigation [J]. Marine Biology, 2004,144(3):553-565. [19] 宋秀贤,俞志明,高咏卉.一种有效去除赤潮生物的黏土复合体系 [J]. 应用生态学报, 2003,14(7):1165-1168. [20] 曹西华,宋秀贤,俞志明.改性黏土去除赤潮生物及其对养殖生物的影响 [J]. 环境科学, 2004,25(5):148-152. [21] Pierce R H, Henry M S, Higham C J, et al. Removal of harmful algal cells (Karenia brevis) and toxins from seawater culture by clay flocculation [J]. Harmful Algae, 2004,3(2):141-148. [22] Lai J X, Yu Z M, Song X X, et al. Responses of the growth and biochemical composition of Prorocentrum donghaiense to different nitrogen and phosphorus concentrations [J]. Journal of Experimental Marine Biology and Ecology, 2011,405(1/2):6-17. [23] Guillard R R, Ryther J H. Studies of marine planktonic diatoms .1. Cyclotella nana hustedt, and Detonula confervacea (cleve) gran [J]. Canadian Journal of Microbiology, 1962,8(2):229-239. [24] 俞志明,邹景忠,马锡年.一种提高黏土矿物去除赤潮生物能力的新方法 [J]. 海洋与湖沼, 1994,25(2):226-232. [25] 林勇新,曹西华,宋秀贤,等.海藻酸钠对改性黏土絮凝特征的影响 [J]. 中国环境科学, 2013,33(2):263-269. [26] 俞志明, DVSubbaRao.黏土矿物对尖刺拟菱形藻多列型生长和藻毒素产生的影响 [J]. 海洋与湖沼, 1998,29(1):47-52. [27] Guillard R R, Kilham P, Jackson T A. Kinetics of silicon-limited growth in marine diatom Thalassiosira-pseudonana Hasle and Heimdal-Cyclotella-nana Hustedt [J]. Journal of Phycology, 1973,9(3):233-237. [28] 任保卫,赵卫红,王江涛,等.海洋微藻生长过程藻液三维荧光特征 [J]. 光谱学与光谱分析, 2008,28(5):1130-1134. [29] 赖俊翔,俞志明,宋秀贤,等.利用特征色素研究长江口海域浮游植物对营养盐加富的响应 [J]. 海洋科学, 2012,36(5):42-52. [30] Wang Z-h, Liang Y, Kang W. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa [J]. Harmful Algae, 2011,12:113-118. [31] Zhao W H, Wang J T, Chen M M. Three-dimensional fluorescence characteristics of dissolved organic matter produced by Prorocentrum donghaiense Lu [J]. Chinese Journal of Oceanology and Limnology, 2009,27(3):564-569. [32] Bieroza M Z, Bridgeman J, Baker A. Fluorescence spectroscopy as a tool for determination of organic matter removal efficiency at water treatment works [J]. Integrating Water Systems, 2010:467-473. [33] 王而力,王嗣淇,江明选.沉积物不同有机矿质复合体对磷的吸附特性影响 [J]. 中国环境科学, 2013,33(2):270-277. [34] 周 涛,李正魁,冯璐璐.氨氮和硝氮在太湖水华自维持中的不同作用 [J]. 中国环境科学, 2013,33(2):305-311. [35] Brandes J A, Ingall E, Paterson D. Characterization of minerals and organic phosphorus species in marine sediments using soft x-ray fluorescence spectromicroscopy [J]. Marine Chemistry, 2007,103(3/4):250-265. [36] Tian S, Jiang P, Ning P, et al. Enhanced adsorption removal of phosphate from water by mixed lanthanum aluminum pillared meontmorilonite [J]. Chemical Engineering Journal, 2009,151:141-148. [37] Lalonde K, Mucci A, Ouellet A, et al. Preservation of organic matter in sediments promoted by iron [J]. Nature, 2012,483 (7388):198-200. [38] Swartzen-Allen S L, Matijevic E. Surface and colloid chemistry of clays [J]. Chemical Reviews, 1974,74(3):385-400. [39] Brandes J A, Devol A H, Deutsch C. New developments in the marine nitrogen cycle [J]. Chemical Reviews, 2007,107(2): 577-589. [40] Ilyash L V, Belevich T A, Ulanova A Yu, Matorin D N. Fluorescence parameters of marine plankton algae at the assimilation of organic nitrogen [J]. Moscow University Biological Sciences Bulletin, 2007,62(3):111-116. [41] Liao M. Effects of organic acids on adsorption of cadmium onto kaolinite, goethite, and bayerite [J]. Pedosphere, 2006,16(2):185-191. [42] Salter I, Böttjer D, Christaki U. The effect of inorganic particle concentration on bacteria-virus-nanoflagellate dynamics [J]. Environmental Microbiology, 2011,13(10):2768-2777. Effects of flocculation of Prorocentrum micans by modified clay on nitrogen and phosphorus. LU Guang-yuan1,2, SONG Xiu-xian1*, YU Zhi-ming1, CAO Xi-hua1, YUAN Yong-quan1(1.Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;2.University of Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2014,34(2):492~498 Harmful algal blooms (HABs) occurred frequently in coastal water around the world over the past decades. Flocculation of algal cells by modified clay has been proven to be an effective method and was the only practical strategy applied in the field, particularly in Asia. To assess the long-term ecological effects of this method, the study investigated the variation of two major nutrients during succession of cultured dinoflagellate Prorocentrum micans Ehrenberg (P. micans, A1) flocculated with modified clay (MC,A2). More than 60% of P. micans cells were efficiently removed by 0.4g/L of MC within 3.5h, and cells were no rebooming in A2. The results indicated that MC removed 26% of TN, 42% of TP, 85% of DIP, 35% of DIN, respectively. compared with TON and TOP concentrations in A1, it has been decreased of 120µmol/L and 6µmol/L by MC on day 33, respectively. Simultaneously, the study speculated that MC treatment controlled the nutrient exchange (between water and sediment) by blocking and sealing the organic-clay matrix in the surface areas of sediments. The study would benefit the further explore of long term environmental effects of the MC application for HABs’ mitigation. harmful algal blooms (HABs);modified clay;mitigation of HABs;nutrient removal;Prorocentrum micans;ecological effect X171 :A :1000-6923(2014)02-0492-07 卢光远(1986-),男,新疆乌鲁木齐人,中国科学院海洋研究所博士研究生,主要研究方向为海洋环境化学,元素生物地球化学循环,有害藻华治理. 2013-06-11 国家自然科学基金资助项目(41276115);国家“973”项目(2010CB428706);国家基金委资助创新研究群体项目(41121064) * 责任作者, 研究员, songxx@qdio.ac.cn
4 结论
