以水肿为主要表现的系统性硬化症1例
2014-04-23宋丽媛李明龙陈海燕李茵茵
宋丽媛,李明龙,周 洁,陈海燕,王 哲,李茵茵
以水肿为主要表现的系统性硬化症1例
宋丽媛,李明龙*,周 洁,陈海燕,王 哲,李茵茵
(山东大学附属省立医院保健内分泌科,济南 250021)
笔者成功诊断1例76岁男性系统性硬化症患者。本患者主要表现为水肿,发病初期一直未明确诊断,对症支持治疗仅暂时缓解病情。水肿加重后查血清相关自身抗体示抗核抗体阳性,结合皮肤活检病理明确诊断为系统性硬化症。根据文献报道和笔者的临床经验,系统性硬化症临床表现复杂多样,缺乏特异性,早期诊断困难。对于临床上难以解释的水肿,应考虑本病的可能,重视患者皮肤的改变及血清相关自身抗体的检查,及早做出正确诊断。
硬化病,系统性;水肿;抗核抗体;皮肤;活组织检查;诊断
1 病例摘要
患者,男,76岁,因“全身水肿1年,加重2个月”于2013年2月20日入院。患者2012年3月无明显诱因出现双下肢水肿,后逐渐发展至躯干、双上肢和颜面部,最终出现全身水肿,尤以下午明显。患者食欲尚好,但进食后出现伴胸骨后不适感,腹胀、腹痛,在当地医院治疗(具体不详),水肿减轻出院。2012年6月患者水肿加重,再次就诊于当地医院,给予白蛋白、呋塞米、安体舒通治疗后水肿减轻,出院时未明确诊断。2012年11月患者症状持续加重,伴有乏力、少言懒动,进食后仍出现腹胀、腹痛,无发热,无明显头晕、头痛,无心慌胸闷,无咳嗽咯痰,无尿急、尿频、尿痛及腰痛。于当地医院行胸腹部CT检查:双肺间质性改变,双侧胸腔积液,右侧叶间积液,心包积液,少量腹水;胃镜:肥厚性胃炎伴糜烂,十二指肠球炎;结肠镜示:结肠息肉病,结肠毛细血管扩张症;化验结果:甲状腺功能T3 1.26nmol/L,促甲状腺激素(thyroid stimulating hormone,TSH)7.45mIU/L;白蛋白25.9g/L。在当地医院仍无法明确诊断,为进一步明确水肿原因收住我院,患者自发病以来体质量减轻3kg。既往史:有高血压病史15年,曾服“卡托普利”治疗,停药多年,血压基本正常;冠状动脉粥样硬化性心脏病史1年,脑动脉硬化症病史1年,否认糖尿病史;对“磺胺药”过敏;有长期饮酒史,已戒1年;无肝炎、结核史,无外伤、手术史,无家族性遗传病史。
入院查体 患者生命体征平稳,精神欠佳,营养中等,全身皮肤中度凹陷性水肿,双手指端皮肤变硬,左侧颌下可及1枚1.5cm×2.0cm大小淋巴结,表面光滑,无触痛。双侧眼睑轻度水肿,心脏、肺部无明显异常,腹部可见局部有色素沉着,阴囊部水肿,双下肢呈可凹性水肿,四肢关节无畸形。
诊疗经过 入院诊断考虑“水肿原因待查”。化验:尿常规、大便常规、病毒系列、凝血5项、血沉、C反应蛋白(C-reactive protein,CRP)大致正常,血常规:红细胞3.33×1012/L、血红蛋白107g/L;肝功生化:总蛋白51.7g/L、白蛋白29.5g/L、球蛋白正常、尿素氮11.9mmol/L、肌酐正常;心肌酶谱:超敏肌钙蛋白T 90.93ng/L、肌酸激酶同工酶5.53µg/L、肌红蛋白79.84µg/L,N端脑钠肽前体909.8ng/L(参考范围0~125ng/L);甲状腺功能:FT3 2.49pmol/L(参考范围3.1~6.8pmol/L)、FT4正常、TSH 5.460μIU/ml(参考范围0.27~4.2mIU/L);肿瘤系列:糖类抗原12-5 61.87U/ml(参考范围0~39U/ml)、非小细胞性肺癌相关抗原7.31µg/L(参考范围0.1~3.3µg/L),余指标未见明显异常。心脏超声示肺动脉高压,三尖瓣中度反流,心包积液(少至中等量)。腹部超声示腹水,多发肝囊肿,双肾慢性肾病声像图,右肾囊肿。血管超声示双侧颈动脉内中膜略增厚,双下肢动脉粥样硬化(散在小斑块),右侧隐股静脉瓣膜功能不全,右侧大隐静脉轻度曲张,双小腿皮下组织水肿。经上述检查后,给予螺内酯片、呋塞米片利尿消肿,奥美拉唑肠溶片、莫沙必利片、双歧杆菌三联活菌胶囊抑酸助消化、调节肠道菌群,因甲状腺功能异常予左甲状腺素钠片,同时输注氨基酸、维生素给予营养支持等。考虑到患者有双手指端皮肤变硬的表现,同时存在心、肺、肾多器官损害,高度怀疑风湿免疫系统疾病的可能。遂完善化验,结果示血清抗核抗体阳性(1∶320);抗双链DNA抗体,SM,SSA,SSB,SCL-70,U1RNP,ANCA,着丝点抗体均为阴性。行双上肢动脉超声示双侧尺动脉内膜炎性改变,双手指掌侧总动脉血管炎并缩窄(中重度),双手指指掌侧固有动脉血管炎并局部管腔闭塞,双上肢淋巴水肿。综合上述检查结果,考虑系统性硬化症的可能性大,于2013年2月26日取手背部皮肤活检。病理镜下可见:真皮内胶原纤维增生致密,局部透明变性,血管附属器周围稀疏淋巴细胞浸润,胶原纤维间可见淡蓝染物质沉积;病理诊断:硬皮病(图1)。结合临床特点,诊断考虑为“系统性硬化症”。在之前对症治疗基础上加用泼尼松片、雷公藤、丹参片、秋水仙碱及静脉应用薄芝糖肽调节免疫、抗纤维化,经上述治疗患者水肿、胃肠道症状较前明显减轻,于2013年3月7日出院。
最后诊断 系统性硬化症。
2 临床病理讨论
宋丽媛医师 水肿为该患者的突出临床表现,首先从引起该症状的常见病因考虑。全身性水肿常由心源性、肾源性、肝源性及营养不良性病因所致。心源性水肿主要为右心衰竭的表现,除心脏增大、心脏杂音外,通常有颈静脉怒张、肝大,严重时可出现胸、腹水;水肿往往首先出现在身体下垂部位,但颜面部一般不肿;该患者无明显心力衰竭的症状和体征,超声未见心脏增大。肾源性水肿可见于各型肾炎和肾病,在疾病早期晨起时有眼睑与颜面水肿,以后发展为全身水肿;而该患者水肿起于双下肢,尤以下午明显;虽既往高血压病史多年,但血压控制稳定,尿常规及肾功能指标大致正常。肝源性水肿主要表现为腹水,也可首先出现踝部水肿,逐渐向上蔓延,而头、面部及上肢常无水肿;该患者水肿延及双上肢及颜面部,且化验及腹部CT均未提示肝脏病变。营养不良性水肿常出现在组织疏松部位,程度不等,初时常局限于双下肢、面部等部位,活动后加重;水肿发生前常有消瘦、体质量减轻等表现;该患者以水肿为首发症状,而后出现消瘦,体质量减轻并不明显且血清总蛋白仅轻度降低,无皮下脂肪、肌肉萎缩,营养不良性水肿的可能性不大。因此,常见引起水肿的病因可初步排除,患者的顽固性水肿会不会由罕见病因所致?
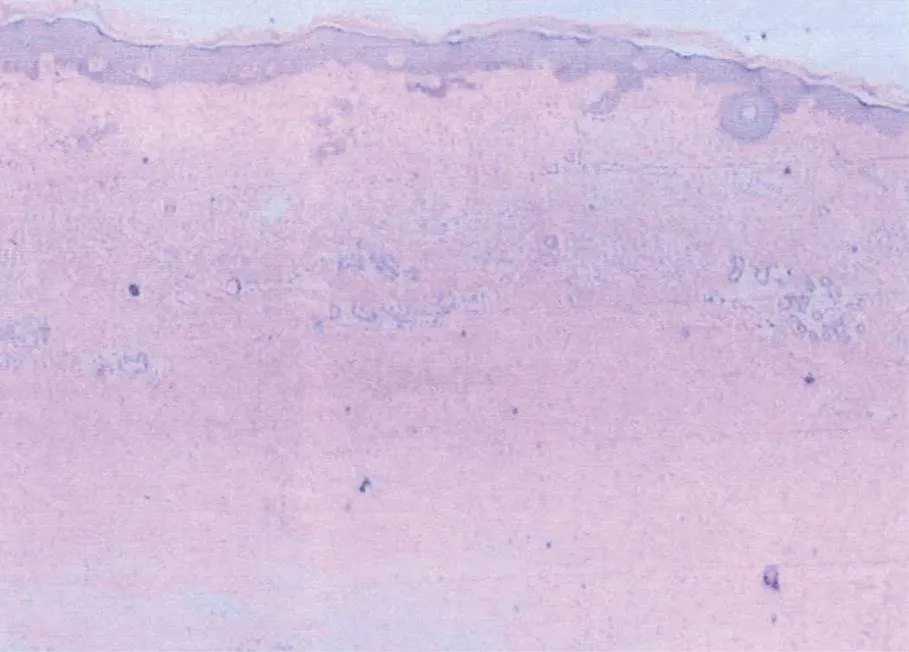
图1 系统性硬化症皮肤病理图
Figure 1 Skin pathological changes of systemic sclerosis (HE×40)
真皮内胶原纤维增生致密,局部透明变性,血管附属器周围稀疏淋巴细胞浸润,胶原纤维间可见淡蓝染物质沉积。
Dense collagen fiber hyperplasia in dermis, partial hyaline degeneration, sparse lymphocyte infiltration around vascular adnexa, deposition of light-blue substance among collagen fiber
周洁主治医师 同意宋医师观点,我们的思路不能仅仅局限于引起水肿的常见病,亦应考虑罕见病因,如甲状腺源性水肿、药源性水肿和特发性水肿等。甲状腺疾病亦可出现水肿,但通常为黏液性水肿,是由于组织液含蛋白量较高所致,极少数表现为可凹陷性水肿。而该患者甲状腺功能仅轻度异常,水肿由甲状腺病变引起的可能性不大。药源性水肿是由于一些药物摄入后影响水钠排泄或影响水钠代谢所致;此种水肿发生在用药后,停药后不久可消失;该患者水肿发生前并未服用可引起水肿的药物,暂不考虑是由服用药物所致。特发性水肿是一种原因不明的水盐代谢紊乱综合征,常呈周期性,并有逐渐加重的趋势。此种水肿往往与体位有关,主要表现为双下肢,直立位时加重,平卧位时减轻。此外,水肿程度常受情绪影响,多伴有神经和精神症状。在除外心、肝、肾及内分泌系统的病因后,需进一步排查该病的可能。
李明龙主任医师 除“水肿”的主要症状外,该患者有“双手指端皮肤变硬”的体征,且存在“多器官受累”的情况。因此,除考虑单一系统病变的病因,可累及全身多系统性的病因也应引起重视。免疫因素往往会导致全身多器官系统受累,结合查体时患者双手指端皮肤变硬的情况,风湿免疫系统疾病的可能性很大。询问患者双手有无不适,回忆近1年来双手遇冷后变红变凉、伴疼痛,此为典型的雷诺现象。综合上述症状和体征,我们高度怀疑系统性硬化症。据报道,80%的系统性硬化症患者有消化道受累的症状,常表现为吞咽困难、胸骨后灼热感和反酸,小肠受累常可引起轻度腹痛、腹泻、体质量下降和营养不良[1]。在系统性硬化症中肺脏受累是普遍存在的,主要为肺间质纤维化和肺动脉血管病变,但往往是其中一个病理过程占主导地位。肺动脉高压常缓慢进展,除非到后期严重的不可逆病变出现,一般临床不易察觉。无创性的超声心动图检查可发现早期肺动脉高压[2]。系统性硬化症肾病变临床表现不一,部分患者有多年皮肤及其他内脏受累而无肾损害的临床现象;有些在病程中出现肾危象,即突然发生严重高血压,急进性肾功能衰竭。此外,20%~40%的系统性硬化症患者有甲状腺功能减退,这与甲状腺纤维化或自身免疫性甲状腺炎有关,病理表现为淋巴细胞浸润,其中半数患者血清中可有抗甲状腺抗体[3]。本患者存在“进食后出现伴胸骨后不适感,腹胀、腹痛”的消化道症状,辅助检查示“双肺间质改变、肺动脉高压、双肾慢性肾病声像图、多腔隙积液”并有“血清甲状腺功能指标异常”,均与文献报道相符,支持系统性硬化症的诊断。继而完善相关抗体检查,结果示抗核抗体阳性。随后取皮肤活检,病理示硬皮病。综合以上病史特点,特别是血清学抗核抗体阳性及皮肤病理学特征,诊断上应考虑为系统性硬化症。
陈海燕副主任医师 系统性硬化症早期最突出的表现往往为软组织肿胀而非皮肤硬化[4]。约70%的患者首发症状为雷诺现象,它可早于系统性硬化症的其他症状1~2年或与其他症状同时发生。几乎所有系统性硬化症患者皮肤硬化都从手开始,手指、手背发亮、紧绷,手指褶皱消失,汗毛稀疏,继而累及面部、颈部,受累皮肤可有色素沉着或色素脱失[5]。在系统性硬化症的早期,水肿是反映疾病严重程度的重要标志。考虑此患者因系统性硬化症早期导致血管周围炎症细胞的浸润和诸如毛细血管扩张及其后毛细血管分叉的微血管内皮细胞的损伤[6],致使血管通透性增加,血管内液体渗出至血管外,组织间隙过多的液体积聚引起全身弥漫性水肿。此外,患者双手指端皮肤变硬的临床表现及手背皮肤活检病理表现提示患者已出现皮肤、皮下组织中胶原纤维明显增加,病情正进行性加重。
王哲副主任医师 系统性硬化症是一种以小血管功能和结构异常,皮肤、内脏纤维化,免疫系统活化等为基本特征的全身性疾病[7],促使本病发生的病因机制尚不明确。系统性硬化症往往会出现特征性自身抗体(如抗着丝点抗体、抗SCL-70抗体等),其中90%的系统性硬化症的患者抗核抗体阳性,故本病属于系统性自身免疫性疾病[8]。由于该病的病理过程复杂,临床表现千变万化并缺乏判断活动度的特异性指标,早期诊断困难,对于临床上不能解释的多器官组织受损应考虑发生本病的可能[9]。系统性硬化症通常是一种不可治愈的缓慢持续进展的疾病,肺间质纤维化和心脏病变是患者病死的主要原因[10],病变仅限于皮肤且没有内脏受累的预后较好[11]。目前系统性硬化症尚无特效治疗方案,原则在于早诊断、早治疗。治疗措施主要包括基础治疗(免疫抑制剂联合糖皮质激素)及对症治疗。免疫抑制剂环磷酰胺是疾病早期的一线用药,泼尼松可减轻早期或急性期水肿,但不能阻止皮肤纤维化[12]。此外,秋水仙碱、D-青霉胺等可影响胶原代谢起到抗纤维化的作用。
李茵茵主任医师 本例患者临床表现不具特异性,我们遇到以水肿为主要临床表现的患者通常首先考虑为心源性、肾源性、肝源性及甲状腺源性病变。考虑到患者老年男性,进食后出现伴胸骨后不适感,腹胀、腹痛,近期体质量下降,且化验指标显示部分肿瘤标志物升高,应特别注意排除恶性肿瘤。但根据影像学检查,初步可排除原发性消化道肿瘤等最有可能的疾病。继而综合分析辅助检查结果,患者存在多器官损害,因此不应局限于单一系统疾病,转而从整体考虑。我们将患者所有的病史、临床表现、实验室以及影像学检查等相关信息综合起来分析,患者心、肺及消化道病变不能以常见病来解释,因此改变思路考虑是否因少见病所致。从细节入手,患者双手指端变硬的体征引起我们的注意,追问得知患者出现过典型的雷诺现象,这让我们的思路拓展到系统性自身免疫性疾病,双手指端变硬使我们考虑到有系统性硬化症的可能性,此为少见病。文献资料显示,系统性硬化症可累及多组织器官,皮肤增厚变硬是其突出表现,雷诺现象往往早于皮损数周甚至数年,但容易被忽视[4]。本例症状和体征恰巧与文献报道相近,我们高度怀疑系统性硬化症。为验证此诊断的正确性,我们行血清相关抗体检测并取皮肤活检,结果证实确为系统性硬化症。该病例的成功诊断让我们深刻地体会到临床经验以及诊断思路的重要性,在临床工作中当常规诊断思路行不通时要果断改变诊断方向,才可尽早明确疾病的诊断。
[1] Savarino E, Mei F, Parodi A,. Gastrointestinal motility disorder assessment in systemic sclerosis[J]. Rheumatology, 2013, 52(6): 1095−1100.
[2] Proudman SM, Stevens WM, Sahhar J,. Pulmonary arterial hypertension in systemic sclerosis: the need for early detection and treatment[J]. Inter Med J, 2007, 37(7): 485−494.
[3] Antonelli A, Ferri C, Fallahi P,. Clinical and subclinical autoimmune thyroid disorders in systemic sclerosis[J]. Eur J Endocrinol, 2007, 156(4): 431−437.
[4] Hachulla E, Launay D. Diagnosis and classification of systemic sclerosis[J]. Clin Rev Allerg Immunol, 2011, 40(2): 78−83.
[5] Krieg T, Takehara K. Skin disease: a cardinal feature of systemic sclerosis[J]. Rheumatology, 2009, 48: iii14− iii8.
[6] Frech TM, Revelo MP, Drakos SG,. Vascular leak is a central feature in the pathogenesis of systemic sclerosis[J]. Rheumatology, 2012, 39(7): 1385−1391.
[7] Canady J, Karrer S, Fleck M,. Fibrosing connective tissue disorders of the skin: molecular similarities and distinctions[J]. J Dermatol Sci, 2013, 70(3):151−158.
[8] Castelino FV, Varga J. Current status of systemic sclerosis biomarkers: applications for diagnosis, management and drug development[J]. Expert Rev Clin Immunol, 2013, 9(11): 1077−1090.
[9] Hui NL, Yu YS, Li ZB. Misdiagnosis of systemic sclerosis: 21 cases analysis[J]. Clin Misdagn Misther, 2001, 14(4): 281−282. [惠乃玲, 于有山, 李振彬. 系统性硬化症21例误诊分析[J]. 临床误诊误治, 2001, 14(4): 281−282.]
[10] Tyndall AJ, Bannert B, Vonk M,. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database[J]. Ann Rheum Dis, 2010, 69(10): 1809−1815.
[11] Roos N, Poulalhon N, Farge D,.evidence for a direct antifibrotic role of the immunosuppressive drug mycophenolate mofetil[J]. J Pharmacol Exp Ther, 2007, 321(2): 583−589.
[12] Cappelli S, Bellando-Randone S, Guiducci S,. Is immunosuppressive therapy the anchor treatment to achieve remission in systemic sclerosis[J]? Rheumatology, 2013: ket312.
(编辑: 王雪萍)
Edema as a main manifestation of systemic sclerosis: a case report
SONG Li-Yuan, LI Ming-Long*, ZHOU Jie, CHEN Hai-Yan, WANG Zhe, LI Yin-Yin
(Department of Geriatric Endocrinology, Shandong Provincial Hospital Affiliated to Shandong University, Ji’nan 250021, China)
We reported a successful diagnosis of a 76-year-old male patient with systemic sclerosis. His main manifestation was edema, and the diagnosis was indefinite at the early stage. Symptomatic and supportive treatments were merely useful for temporary remission of the symptoms. Testing for serum related auto-antibodies showed that anti-nuclear antibody was positive after the aggravation of edema. Ultimately, the diagnosis of systemic sclerosis was established after skin biopsy. According to literature and our clinical experience, the clinical manifestations of systemic sclerosis were complicated and lack of specificity, so it was hard to diagnose at its early stage. We should take systemic sclerosis into consideration when we meet intractable cases with edema. More attention should be paid to skin lesion and serum related auto-antibodies testing in order to make the correct diagnosis of this disease as early as possible.
sclerosis, systemic; edema; anti-nuclear antibody; skin; biopsy; diagnosis
R593.25
A
10.3724/SP.J.1264.2014.00016
2013−11−26;
2013−12−25
李明龙, E-mail: liminglong@medmail.com.cn
