单侧隐睾后胶质细胞源性神经营养因子对另侧睾丸保护的机制研究
2014-04-22王小翠张华锋赵
王小翠张华锋赵 佳
1. 山东省潍坊医学院附属益都中心医院肾内科(青州 262500);
2. 山东省青州市人民医院泌尿外科; 3. 山东省潍坊医学院附属益都中心医院肾内科
单侧隐睾后胶质细胞源性神经营养因子对另侧睾丸保护的机制研究
王小翠1张华锋2*赵 佳3
1. 山东省潍坊医学院附属益都中心医院肾内科(青州 262500);
2. 山东省青州市人民医院泌尿外科; 3. 山东省潍坊医学院附属益都中心医院肾内科
目的大鼠单侧隐睾模型后,探讨胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)对另侧睾丸组织中超氧化物岐化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、白细胞介素-6(IL-6)及睾丸特异性钙结合蛋白86-IV (testis -specif c calcium binding proten,TS- CBP86-IV)的影响和机制。方法选取左侧隐睾造模成功雄性SD大鼠体质量(200±30)g,45只,随机分为,A:隐睾组(n=15);B:生理盐水药物组(n=15);C:GDNF组(n=15);D:另选正常对照组(n=15)。每组根据设定处理方式的不同分别进行处理。采集对侧睾丸并行生化指标(SOD、CAT、MDA及IL-6含量)检测;免疫组织化学检测对侧睾丸细胞凋亡指数(AI);HE染色观察对侧睾丸组织学形态;定时PCR法检测对侧睾丸组织中TS-CBP86-IV mRNA的表达。结果胶质细胞源性神经营养因子药物组(隐睾+GDNF组)生精细胞凋亡明显减少,SOD活性上升,MDA含量下降,IL-6含量下降,TS- CBP86-IVmRNA基因表达明显增强,其与A组、B组、D组比较,差异均有统计学意义。结论 GDNF对单侧大鼠隐睾后对侧睾丸生精功能具有保护作用,并提高抗氧化酶系统的抗氧化及降低血清炎症因子能力,其机制可能与诱导TS-CBP86-IV基因表达有关。
隐睾; 胶质细胞源性神经营养因子; 睾丸特异性钙结合蛋白CBP86-IV基因
单侧隐睾时引起对侧睾丸组织中生精上皮细胞损害、体内抗氧化能力下降,氧自由基攻击造成生精细胞过度凋亡等一系列变化,可导致不育[1]。前期研究表明睾丸组织中睾丸特异性钙结合蛋白CBP86-IV(testis -specif c calciumbinding proten, TS- CBP86-IV)降低时,睾丸生精能力也有所下降[2,3]。胶质细胞源性神经营养因子(glial cellderived neurotrophic factor, GDNF)是转化生长因子超家族的一个相关成员,具有调节多种细胞株发育和分化的多功能信号分子,具有改善受损组织功能恢复。本实验通过建立左侧隐睾动物模型,探讨GDNF对对侧睾丸组织中TS- CBP86-IV mRNA表达情况及超氧化物岐化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、白细胞介素-6(IL-6)的影响和可能发病机制。
资料及方法
一、资料
(一)主要试剂
凋亡检测试剂盒(武汉博士德生物工程有限公司);Revert Aid TM First Strand Cdna Synthesis和 PCR 试剂盒购自Fermentas公司;MDA、SOD、CAT及IL-6测定试剂盒(南京建成生物工程研究所),GDNF(以色列Peprotech公司)。
(二)实验动物分组
雄性SD大鼠体质量(200±30)g,由潍坊医学院实验中心提供,合格证号:SCXK2007-2009。造模成功后,选取符合实验要求的45只大鼠随机分为A、B、C组。A:隐睾组(n=15);B:隐睾+生理盐水组(n=15);C:隐睾+GDNF组(n=15);D:另选正常对照组(n=15)。
二、方法
(一)动物模型建立及分组
2%戊巴比妥钠(50mg/kg)腹腔注射麻醉后,下腹正中小切口,游离左侧睾丸,切除睾丸引带,用8-0无创尼龙线将睾丸固定在腹壁上,分两层关腹后成功造模,所有标本根据实验设计要求分为4组。A组为隐睾组,B组是在A组的基础上静注生理盐水(2ml/mg)qd,C组是在A组的基础上通过尾静脉缓慢注入GDNF液(5ng/mg)qd(参考Peprotech公司生产药品说明书建议剂量),D组为正常对照组,标准食谱喂养,设计要求15d后处死大鼠,取右侧睾丸,分别制作组织匀浆和石蜡切片。
(二)细胞凋亡、组织形态学检测
应用原位缺口末端标记(TUNEL)法检测睾丸上皮细胞凋亡情况,凋亡细胞核为棕黄色,阴性对照不加末端转化酶,每张切片高倍镜下随机选取10个视野,计数视野下细胞数,再计数凋亡细胞数,计算凋亡指数(AI)。采集各组睾丸组织,置于4%中性甲醛溶液中浸泡固定24h,梯度酒精脱水,透明石蜡包埋,制备切片,常规HE染色,光镜下行对侧睾丸组织的形态学观察。
(三)SOD、CAT、MDA IL-6含量检测
取各组对侧睾丸组织0.2g,用匀浆介质制成10%的组织匀浆,光法检测CAT活性,硫代巴比妥酸法测定MDA含量,黄嘌呤氧化酶法测定SOD活性,酶联免疫法测定IL-6血清含量,均操作严格按说明书进行。
(四)实时定量PCR检测各组对侧睾丸组织TSCBP86-IV mRNA表达情况
PCR扩增引物(TS- CBP86-IV)序列:
上游引物5'-ACGGAAGCAGTTGGTGGTCT-3',下游引物5'-AACATCTGAGCAGCAAGCTGAG-3ˊ;内参GAPDH引物序列,上游引物5'-GCCAAGGTCA TCCATGACAACTTTGG-3',下游引物5'-GCCTGCT TCACCACCTTCTTGATGTC-3',收集各组对侧睾丸组织,提取组织中总RNA,参照Revert Aid TM First Strand Cdna Synthesis说明书,进行逆转录反应,操作严格按照试剂盒说明要求进行。所得数据分析均由FTC-2000分析软件自动进行,所得靶基因相对含量=2-(Ct靶基因-CtGAPDH)×103,其中GAPDH为内参照。
三、统计学方法
采用t检验,运用SPSS 13.0统计软件进行数据分析。
结 果
一、细胞凋亡检测
隐睾组对侧睾丸见细胞结构层次紊乱,大量生精细胞凋亡(图1A)。与A组比较,B组对侧睾丸生精细胞排列紊乱,部分生精细胞脱落、胞浆浓缩,生殖细胞凋亡较明显,间质增多(图1B)。C组对侧睾丸生精小管结构较为完整,生精细胞层次稍有紊乱、间质明显减少,生精细胞凋亡较A组、B组明显减少(图1C),D组未见生殖细胞凋亡(图1D)。免疫组织化学检测A组、B组、C组、D组的对侧睾丸细胞凋亡指数(AI)值分别为13.51±0.63、10.98±0.17、7.32 ±0.05、3.14±0.09。
二、各组睾丸组织形态学观察
HE染色证实,对照组未见间质水肿和血管扩张(图2A)。生理盐水组中间质水肿减轻,粒细胞可见(图2B)。隐睾组,被膜血管扩张明显,大量中性粒细胞浸润,生精小管结构紊乱、变性坏死增多,间质重度水肿(图2C)。胶质细胞源性神经营养因子药物组,被膜血管无充血扩张,未见粒细胞浸润,生精小管变性坏死和间质水肿明显改善(图2D)。

图1 另侧各组睾丸组织细胞凋亡情况(HE×200)
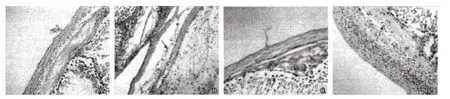
图2 另侧各组睾丸组织细胞形态学观察情况(HE×200)
三、SOD、CAT、MDA、IL-6含量检测
C组对侧睾丸抗氧化酶SOD、CAT活性显著高于A组、B组,而MDA、IL-6含量显著低于A组、B组,差异有统计学意义(P<0.05);D组抗氧化酶SOD、CAT活性明显高于隐睾组、生理盐水组,而MDA、IL-6含量明显低于A组、B组间比较有明显统计学差异(P<0.01);而A组与C组各项指标均无明显统计学意义(表1)。

表1 各组大鼠对侧睾丸组织中CAT、 SOD 、MDA、IL-6含量比较
四、RT-PCR检测各组对侧睾丸组织TS- CBP86-IVmRNA
各组对侧睾丸,TS- CBP86-IV基因相应片段大小的位置均出现条带,TS- CBP86-IV基因的条带强度均比内参GAPDH条带的强度明显要弱,与A组条带相比,其他各组条带明显增强,其C组亮度明显强于D组, A组、B组、C组、D组TS- CBP86-IV mRNA表达含量分别为0.35±0.11、0.43±0.23、0.81±0.05、0.59 ±0.33。C组与A、B、D组,A组与D组,B组与D组间比较均有统计学意义(P<0.05)(图3)。

图3
讨 论
胶质细胞源性神经营养因子最先从大鼠胶质细胞B49的条件培养液中分离出来并被命名(glial cellderived neurotrophic factor,GDNF)。研究表明,GDNF被定作为肠神经元突触小泡的一个标记,通过GFR-1或神经细胞黏附因子从而激活细胞内信号通路,发挥生物学意义[4,5],GDNF对PD、脑缺血、神经性疼痛、感觉纤维再生的作用已有大量研究。本人[6]研究发现GDNF对大鼠隐睾损伤侧睾丸组织生精功能有保护作用,进一步显示胶质细胞源性神经营养因子诱导睾丸精原干细胞增值和分化迁移/祖细胞有一定的调控作用,此与国外学者研究结果基本一致[7,8]。GDNF是TGF-β超家族的一个相关成员,在脑内广泛分布,通过其受体复合物介导激活细胞内信号转导通路,发挥维持神经元功能和损伤修复等作用,成为潜在的治疗脑部疾病靶点之一。
在哺乳动物试验研究中,外源性GDNF能促进精原干细胞(spermatogonial stem cells, SSCs)的自我更新与增殖,可能通过以下作用:GDNF与GFR-α1特异性结合,活化Ret蛋白酪氨酸激酶,随后激活Ras/ ERK1/2、PI3K-Akt和SFK信号通路,促进SSCs的自我更新;同时,在该过程中还可能存在信号通路间的交联对话现象。
TS-CBP86-IV表达上调可能与抗氧化酶活性下降、生精细胞凋亡有关。TS- CBP86-IV可能参与了生精细胞的凋亡和隐睾的病理过程。本研究通过建立大鼠隐睾模型后,进一步探讨了GDNF对大鼠对侧睾丸组织中TS- CBP86-IV基因表达及SOD、CAT、MDA和IL-6的表达特点,结果应用GDNF药物后,抗氧化酶SOD、CAT活性明显高于隐睾组、生理盐水组,MDA、IL-6含量明显低于隐睾组、生理盐水组,两组间比较均有明显统计学意义(P<0.05)。睾丸损伤后抗氧化酶系统已遭破坏,从而启动了凋亡程序,观察其组织病理凋亡及形态学改变,可见A组被膜血管扩张明显,大量中性粒细胞浸润,生精小管结构紊乱、变性坏死增多,此与文献报道基本一致[9,10]。应用GDNF后睾丸生精小管结构较为完整,生精细胞层次无明显紊乱。RT-PCR发现,应用GDNF治疗后,单侧大鼠隐睾对侧睾丸组织中TS- CBP86-IV基因表达条带亮度明显增强,说明GDNF参与对侧睾丸生精细胞的增值和分化作用,对睾丸功能有保护作用。
当然本研究存在缺陷和不足,应设计作用于单侧隐睾损伤后另侧睾丸的不同关键时间点,并给予GDNF干预治疗,观察相应变化,应对不同给药方法和剂量进行试验设计并观察另侧睾丸组织中各项指标动态变化情况。GDNF对大鼠单侧隐睾后对侧睾丸生精功能具有保护作用,并提高抗氧化酶系统的抗氧化及降低血清炎症因子能力,可能是通过诱导TSCBP86-IV基因表达而实现,但如何诱导及调控等问题有待大样本量进一步深入研究探讨。
1 朱保平, 郑新民, 李世文, 等. 大鼠单侧隐睾对侧睾丸的损害与抗氧化酶mRNA的表达. 中华实验外科杂志2004; 21(5): 575-576
2 申树林, 梁季鸿, 朱春晖, 等. 睾丸特异性钙结合蛋白CBP86-IV表达水平变化及抗体制备. 中国男科学杂志2013; 27(10): 61-62, 66
3 徐明, 郑新民, 丁协刚, 等. SCF/c-kit基因在隐睾大鼠睾丸中的表达及其意义. 中华实验外科杂志 2011; 28(5): 781-783
4 Turner TT, Bang HJ, Lysiak JL. The molecular pathology of experimental testicular torsion suggests adjunct therapy to surgical repair.J Urol2004; 172(6 Pt 2): 2574-2578
5 Böttner M, Harde J, Barrenschee M,et al. GDNF induces synaptic vesicle markers in enteric neurons.Neurosci Res2013; 77(3): 128-136
6 张华锋, 赵佳. 睾丸损伤后胶质细胞源性神经营养因子对损伤睾丸的保护和修复的探讨. 中国男科学杂志2013; 27(10): 20-24
7 Dovere L, Fera S, Grasso M,et al. The niche-derived glial cell line-derived neurotrophic factor (GDNF) induces migration of mouse spermatogonial stem/progenitor cells.Plos one2013; 8(4): e59431
8 Ferranti F, Muciaccia B, Ricci G,et al.Glial cell linederived neurotrophic factor promotes invasive behaviour in testicular seminoma cells.Int J Androl2012; 35(5): 758-768
9 Saba M, Morales CR, De Lamirande E,et al. Morphological and biochemical changes following acute unilateral testicular torsion in prepubertal rats.J Urol1997; 157(3): 1149-1154
10 Bianchi R, Giambanco I, Donato R. S100B/RAGE-dependent activation of microglia via NF-KappaB and AP-1 coregulation of COX-2 expression by S100B, IL-6 beta and TNF-alpha.Neurobiol Aging2010; 31(4): 665-677
(2014-03-28收稿)
Effects of glial cell source derived neurotrophic factor in unilateral cryptorchidism on the contralateral testis and its mechanism
Wang Xiaocui1, Zhang Huafeng2*, Zhao Jia3
1. Department of Renal Medicine, Yidu Central Hospital,Weifang Medical College, QingZhou 262500, China;
2. Department of Urology Surgery, Qingzhou Peoples Hospital; 3. Department of Renal Medicine, Yidu Central Hospital,
Weifang Medical College
ObjectiveTo investigate the effects of glial cell source derived neurotrophic factor on the levels of testis -specif c calciumbinding proten CBP86-IV and SOD, CAT, MDA, IL-6 in the contralateral testis in rats.MethodsTotal of 45 male mice model with left cryptorchidism were randomly divided into three groups such as group A(cryptorchidism group n=15), group B(NS n=15 ), group C (GDNF n=15 ) and group D(the normal contral group n=15). They were killed and the right testis was took out and then its biochemical index was examined including superoxide dismutase(SOD), the activity of catalase(CAT) and level of malonic diethylaldehyde(MDA), interleukin-6(IL-6); Germ cell apoptosis was detected by immunohistochemistry; The histological changes were observed by microscope. The expression of TS- CBP86-IV was detected by real-time quantitative PCR.ResultsCompared with those of other group,the percentage of apoptotic germcells and the content of MDA and IL-6 were markedly decreased in erdosteine group,but the levels of SOD and CATwere signif cantly increased. The mRNA expression of TS- CBP86-IV was also enhanced.ConclusionGlial cell derived neurotrophic factor(C group) shows protective effects on contralateral testis. This effect may be achieved through repressing the generation of oxygen-derived free radicals and high expression of TS- CBP86-IV.
Cryptorchidism; glial cell line-derived neurotrophic factor; testis -specif c calcium binding protein CBP86-IV gene
10.3969/j.issn.1008-0848.2014.09.004
R 697.22; R 339.211
*通讯作者, E-mail: zhanghuafeng09@126.com; Tel: 15063608578
Corresponding autor: Zhang Huafeng, E-mail, zhanghuafeng09@126.com; Tel: 15063608578
