热修复中不同pH缓冲液对鸡睾丸组织免疫荧光结果的影响
2014-04-19陈建伟郭丽娜夏龙钢张春香任有蛇
赵 辉,陈建伟,郭丽娜,夏龙钢,张春香,任有蛇
(山西农业大学 动物科技学院 动物遗传育种与繁殖,山西 太谷030801)
免疫荧光技术是应用免疫学基本原理-抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素等) 显色来确定组织细胞内抗原(多肽和蛋白质) ,对其进行定位、定性及定量的研究。特异性强、敏感性高、速度快。但组织在4%多聚甲醛及其他固定液固定过程中,组织蛋白质空间结构会发生变化,形成醛键和羧甲基而封闭部分抗原决定簇,并会使蛋白与蛋白之间发生交联,也可能会对抗原决定簇产生封闭作用[1]。有研究称,样品长时间固定或保存不当会导致其抗原丢失[2,3]。同时,固定液及固定时间的不同,对组织抗原的影响也不尽相同。而在试验操作过程中,组织脱蜡、封闭、内源性过氧化酶灭活等诸多操作,对抗原簇也有一定的影响。因此,在免疫荧光技术中,针对不同的组织样品采取不同的抗原修复方式,是进行后续试验的前提,也是决定整个试验成功与否的关键所在。以往对免疫组化的抗原修复研究较多,但针对免疫荧光的修复方式鲜有报道。本试验对抗原不修复、胰蛋白酶修复、不同条件的热修复进行比较,为睾丸组织免疫荧光抗原修复提供科学依据。
1 材料与方法
1.1 试验动物
选取10 只健康无疾病的海兰白成年公鸡,按照常规免疫程序严格免疫。本试验在山西农业大学动物科技学院动物科学实验站进行。
1.2 主要试剂
即用型兔抗人CD90 多克隆抗体、浓缩型SABC- Cy3 试剂盒(兔IgG) 、抗原修复液、3%双氧水。以上试剂均购自博士德公司,其他常用试剂为国产分析纯。
1.3 样品采集和处理
饲喂10 d 后,采用颈部放血法致死,解剖取睾丸组织样品,用手术刀轻轻切成5 mm×5 mm×2 mm 的组织块,4%多聚甲醛固定24 h 后置于70%乙醇中保存。
1.4 试验方法
睾丸组织块在常规脱水、浸蜡后包埋,并制作石蜡切片,切片厚度5 μm。切片经二甲苯脱蜡后经梯度酒精水化。3%H2O2孵育10 min,以消除内源性过氧化酶。
采取以下抗原修复方式: 1) 不修复; 2)抗原修复液室温孵育10 min; 3) 将装有pH 6.0、7.0、8.0 的柠檬酸缓冲液烧杯置于90 ℃的恒温水浴锅中,将切片置于柠檬酸缓冲液中,10 min; 4) 配相同的柠檬酸缓冲液,置于97 ℃的恒温水浴锅中,将切片置于柠檬酸缓冲液中,10 min。
滴加0.01 mol/L PBS 1∶10 稀释的正常血清封闭液,室温10 min。甩去多余液体,不洗。滴加0.01 mol/L PBS 1∶100 的一抗,37 ℃1 h。0.01 mol/L PBS 洗2 min ×3 次。滴加0.01 mol/L PBS 1∶100 稀释的生物素化二抗,37 ℃ 30 min。0.01 mol/L PBS 洗2 min×3 次。滴加0.01 mol/L PBS 1∶100 稀释的SABC- Cy3,37 ℃30 min。0.01 mol/L PBS 洗5 min ×4 次。水溶性封片剂封片。Olympus 生物显微镜观察,Image- pro plus 7.0 软件拍照。
2 结 果
由试验结果比较可以得出,未进行抗原修复的睾丸组织蛋白粘连严重,造成明显的非特性荧光信号,组织细胞无法分辨(图1) 。用酶修复的组织蛋白粘连较少,但非特性荧光信号依然存在(图2) 。在pH 6.0 的缓冲液中进行热修复的组织,效果明显较未修复的要好。其中,90 ℃中热修复的组织细胞粘连明显减少,已可区分开,但着色较浅(图3) 。97 ℃中组织已可明显的观察到单个细胞,但曲精细管组织结构被破坏(图4) 。在pH 8.0 的缓冲液中热修复的组织细胞可明显区分,结构完整。但荧光信号减弱,且着色不均匀(图5、6) 。在pH 7.0 的柠檬酸缓冲液中热修复的组织切片,组织结构完整,细胞间无蛋白粘连现象,染色均一稳定,其中97 ℃(图8) 较90 ℃(图7) 中荧光信号更为稳定。
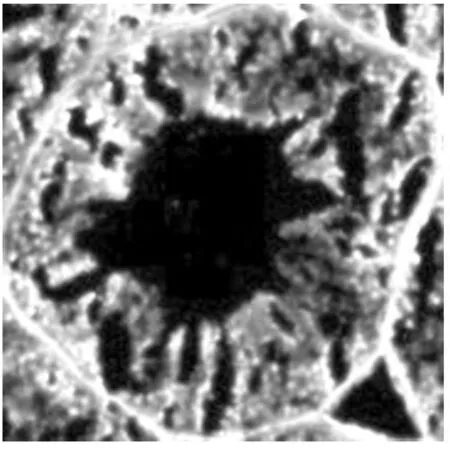
图1 未修复

图2 酶修复

图4 pH6.0、97 ℃修复
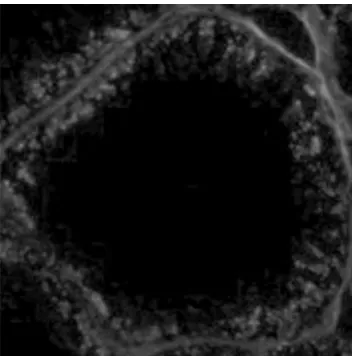
图5 pH8.0、90 ℃修复
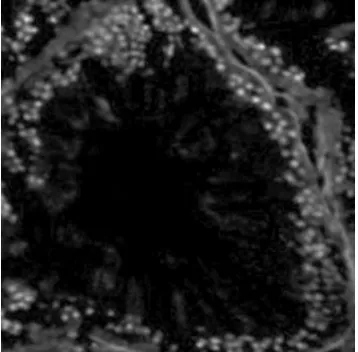
图6 pH8.0、97 ℃修复
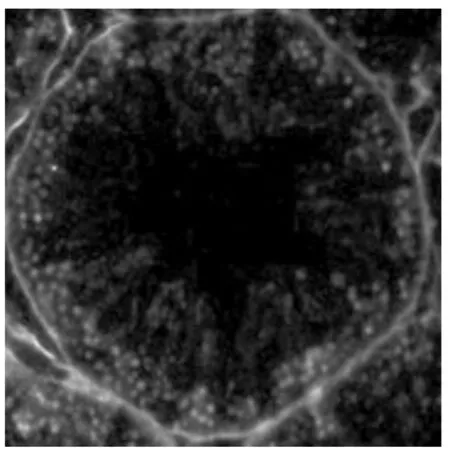
图7 pH7.0、90 ℃修复

图8 pH7.0、97 ℃修复
3 讨 论
免疫组织化学技术发展到现在,早已不是单纯的定性检验靶蛋白的存在与表达部位了。而对于免疫组化定量的三个标准化分别是: (1) 试剂标准化; (2) 染色技术标准化;(3) 结果判定的标准化。这就对免疫组化的各步操作提出了新的要求。同时,关于抗原修复方式的报道也越来越多。1991年Shi 等的研究称,微波加热可提高免疫组化的染色效果[4]。原理是在高频电磁波的作用下使在固定过程中固定液成分与组织中蛋白相结合的醛链打开,从而使被封闭了的抗原决定簇暴露出来。另外,还有高压锅抗原修复,是将组织置于高温高压的环境中,通过高压高温作用将组织中因固定液处理而形成的醛链打开,使抗原暴露,从而提高染色的敏感性。Fowler 等研究证明,在压力达到40 000帕以上用热修复加热石蜡切片,效率可达80% ~95%,但操作程序繁琐,设备要求较高[5]。董玉英等的研究表明,利用超声波对抗原进行修复的结果和微波炉中热修复的结果大致相同[6]。本试验比较未修复、酶修复和不同pH 柠檬酸缓冲液中热修复对试验结果的影响。
从本试验结果比较得出,未进行抗原修复的睾丸组织蛋白粘连严重,造成明显的非特性荧光信号,组织细胞无法分辨。用酶修复的组织蛋白粘连较少,但非特性荧光信号依然存在,且荧光信号极弱,这可能是由于抗原簇暴露的不够充分,致使抗体结合不稳定,导致荧光较弱。在pH6.0 的缓冲液中进行热修复的组织,效果明显较未修复的要好。其中,90 ℃中热修复的组织细胞的粘连明显减少,已可区分开,但着色较浅。97 ℃中的组织已可明显的观察到单个细胞,但可能由于温度过高的原因,组织结构受到破坏,游离的蛋白结合荧光染料后致使非特异荧光信号的增加,导致试验结果的不准确。在pH8.0 的缓冲液中热修复的组织细胞可明显区分,结构完整。但可能是由于pH8.0 的缓冲液对组织靶抗原有一定的影响,致使荧光信号减弱,且着色不均匀,影响结果的准确性。在pH7.0 的柠檬酸缓冲液中热修复的组织切片,组织结构完整,细胞间无蛋白粘连现象,染色均一,稳定,阳性定位准确,可用于细胞计数,测定平均光密度等后续分析。其中,97 ℃的效果较90 ℃的好,可能是高温可使本试验中组织样品抗原簇更好的暴露。
本试验证明,抗原修复是必要的,各修复组的试验结果都较未修复组要好。相比较酶修复,热修复的效果更好,与前人研究结果一致。在高温对组织切片结构不影响的情况下,较高的温度下(97 ℃) 比较低温度(90 ℃) 的效果要好,蛋白粘连减少,着色稳定,非特性荧光信号较弱。这可能是由于高温使组织蛋白抗原簇暴露的更加全面,进而抗原与抗体结合得更加牢固与稳定,得到更好的着色效果。
在相同温度下,本试验以pH7.0 柠檬酸热修复液的效果最好,组织完整,无蛋白粘连,着色稳定。现国内所用的柠檬酸热修复液一般是pH6.0 的,而罗小平等也报道,高pH 抗原修复液在97 ℃下处理的组织能够很好地检测到相应的靶抗原,且着色均匀,定位准确[7]。这说明热修复时不同酸碱度的修复液可能对靶抗原簇的暴露作用有所不同,但其机制未知。针对不同的组织抗原,需要选择不同pH 的热修复液。但由于影响免疫荧光的因素很多,抗原蛋白的表达部位及特点也不尽相同,要得出适合特定组织靶蛋白的抗原修复方式以及热修复液pH,还需进一步研究。
[1]王伯沄,李玉松,黄高昇,等.病理学技术[M].北京: 人民卫生出版社,2000: 367-370.
[2]Yaziji H,Barry T.Diagnostic Immunohistochemistry:what can go wrong? Adv Anat Pathol.2006; 13: 238-46.
[3]Shi SR,Liu C,Taylor CR.Standardization of Immunohistochemistry for Formalin-fixed,Paraffin-embedded Tissue Sections Based on the Antigen Retrieval Technique: From Experiments to Hypothesis.J Histochem Cytochem.2006; 39: 741-8.
[4]Shi SR,Chaiwun B,Young L,et al.Antigens retrieval using pH 3.5 glucine-HCL buffer or urea solution for immuno-histochemical location of Ki-67.Biotech Histochem,1994,69(4) : 213-215.
[5]Fowler C B,Cunningham R E,Waybright T J,et al.Elevated hydrostatic pressure promotes protein recovery from formalin-fixed,paraffin-embedded tissue surrogates [J].Lab Invest,2008,88(2) : 185-95.
[6]董玉英,王 岩.超声波对免疫组化抗原修复的作用[J]中国热带医学,2003,3(2) : 196-196.
[7]罗小平,赖均鹏.高pH 值抗原修复液在免疫组化组织脱蜡和修复中的应用[M]现代医院,2011,11(12) : 50-51.
