高致病性猪繁殖与呼吸综合征病毒基因缺失标记疫苗ELISA鉴别诊断方法的建立
2014-04-14周艳君姜一峰徐彦召童光志
孙 晶,周艳君,姜一峰,徐彦召,童 武,童光志
(中国农业科学院上海兽医研究所,上海 200241)
高致病性猪繁殖与呼吸综合征病毒基因缺失标记疫苗ELISA鉴别诊断方法的建立
孙 晶,周艳君,姜一峰,徐彦召,童 武,童光志
(中国农业科学院上海兽医研究所,上海 200241)
为了配合(Porcine reproductive and respiratory syndrome virus, PRRSV)基因标记疫苗株(rHN4-Δ25+NP49株)的临床抗体鉴别诊断应用,本研究以标记疫苗中缺失的25个氨基酸多肽作为包被抗原,通过对ELISA反应条件的优化,确定抗原最适包被浓度为500 ng/孔,血清最佳稀释度为1:40,同时确定其阴阳性临界值S/P判定标准为0.15,批内和批间重复实验结果显示其变异系数均低于10%,表明该方法具有良好的重复性。对临床血清检测结果显示与IDEXX试剂盒检测结果的符合率为94.84%,采用25 aa负标记ELISA方法检测HuN4-F112免疫猪血清,结果显示从免疫后21 d可检测25 aa特异性抗体,该抗体至少可持续存在126 d。本研究建立的ELISA检测方法为今后PRRSV基因工程标记弱毒疫苗株在临床鉴别诊断的应用提供了有利保障。
高致病性猪繁殖与呼吸综合征病毒;多肽抗原;25aa-ELISA
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒引起的全球范围内严重危害养猪业的传染病[1]。1987年首先在美国发现该病,以各年龄段母猪繁殖障碍和呼吸疾病为特征的传染性疾病在美国和加拿大地区发现,并迅速向世界各地蔓延[2];1996年我国学者郭宝清等[3]首次分离出猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV),2006年高致病性猪繁殖与呼吸综合征(highly pathogenic Porcine reproductive and respiratory syndrome virus, HP-PRRS)的爆发[4,5],给我国养猪业带来巨大损失,PRRS的监测和防控成为重要课题。
目前,猪繁殖与呼吸综合征流行毒株包括PRRS经典毒株、PRRS经典疫苗株、PRRS高致病性毒株、PRRS高致病性疫苗株等,对该病毒监测存在很大难度[6]。该病的流行特点及其病原特性决定其高度传染性,使用疫苗是目前预防本病的最主要手段。国内的疫苗主要包括弱毒疫苗和灭活疫苗,弱毒疫苗具有抗体产生快、持续时间长和保护力强等特点,在临床上被广泛使用于控制PRRS的流行,但传统的弱毒疫苗在抗体监测过程中无法区分野毒和疫苗毒感染。
基于此,本实验室在P R R S V弱毒疫苗HuN4-F112株反向遗传平台的基础上,将NSP2的复制非必须区域(Δ508-532)进行缺失,同时在该区域插入新城疫病毒NP蛋白末端49个氨基酸(NP49)作为标记,成功构建了双标记基因工程弱毒疫苗株(rHN4-Δ25+NP49株)[7,8]。该疫苗株由于具备缺失和插入正、负双标记,这就为特异性区分野毒感染和实现PRRS有效防控奠定了坚实基础。在研究中为了有效监测基因工程标记疫苗株(rHN4-Δ25+NP49株)的抗体水平,与其他自然感染野毒和疫苗毒进行鉴别和区分,我们针对基因工程标记疫苗株(rHN4-Δ25+NP49株)的特征缺失的25个氨基酸(25 aa)作为包被抗原,建立一种特异性25aa-ELISA检测方法,从基因工程标记疫苗的负标记角度达到鉴别诊断目的。
1 材料与方法
1.1 血清和试剂PRRSV阴性血清、PRRSV HuN4-F112阳性血清、PRRSV rHN4-Δ25+NP49株阳性血清、猪伪狂犬病毒(Porcine pseudorabies virus, PRV)阳性血清、猪瘟病毒(Classical swine fever virus, CSFV)阳性血清和猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)阳性血清均为本实验室保存;猪细小病毒(Porcine parvovirus, PPV)阳性血清、猪圆环2型病毒(Porcine circovirus-2, PCV-2)阳性血清为哈尔滨兽医研究所猪病研究室提供;辣根过氧化物酶(HRP)标记的山羊抗猪IgG购自Sigma公司;脱脂乳购于BD公司;TMB显色液、脱脂乳、牛血清蛋白(BSA)购自AMRESCO公司;PRRSV抗体检测试剂盒HerdCheck PRRS X3购自IDEXX公司。
1.2 抗原最佳包被浓度和最佳血清稀释度的确定将特异性缺失区域25 aa多肽抗原用0.05 mol/L碳酸盐缓冲液(pH9.6)稀释成10倍梯度进行包被(10 μg/mL至0.125 μg/mL),每孔包被100 μL,4 ℃包被过夜后,5 %脱脂乳于37 ℃封闭2 h。PRRSV HuN4-F112株阳性血清、阴性血清分别1:20、1:40、1:80、1:160稀释,每孔100 μL,37 ℃孵育1 h进行ELISA方阵试验。HRP标记的山羊抗猪IgG抗体1:10 000倍稀释,每孔100 μL,37 ℃孵育1 h。加入100 μL TMD显色底物,室温避光显色10 min。50 μL 2 mol/L H2SO4终止反应。测定各孔OD450值,确定最佳抗原包被浓度与血清稀释浓度。
1.3 最佳反应条件的确定从包被时间、封闭液的选择、封闭时间、血清稀释液、酶标二抗稀释度、底物反应时间等方面进行反应条件的优化,其他条件不变,对HuN4-F112株阳性血清和阴性血清进行25aa-ELISA测定,经酶标仪测OD450值,比较各组阴、阳性血清的OD450值和P/N值,确定最佳反应条件。
1.4 临界值的确定收集300份临床动物实验血清,依照已经优化条件25aa-ELISA方法,测定OD450值,计算血清样品的S/P值。通过SPSS(statistical product and service solutions)软件绘制ROC曲线,得出25aa-ELISA检测方法的灵敏度(sensitivity)和特异度(specificity)。数据处理分析,得出S/P值的阴阳性血清临界值(cut off value)。
1.5 特异性实验以建立的25aa-ELISA方法,检测已知的CSFV、PRV、PPV、PEDV、PRRS rHN4-Δ25+NP49株阳性血清,同时设立PRRSV HuN4-F112株阳性血清和阴性血清对照,确定25 aa多肽抗原与其他常见猪病的交叉反应性。
1.6 重复性实验批内重复试验选取6份PRRS HuN4-F112抗体水平不同的猪血清,在相同试验条件下进行检测,每份血清平行做3个重复,对检测结果进行统计学分析;批间重复试验选取上述血清,在相同实验条件下,使用3个不同时间包被的ELISA检测板进行检测,每份血清平行做2个重复,对检测结果进行统计学分析。
1.7 临床血清符合性实验对310份临床血清样品,分别采用间接25aa-ELISA方法和IDEXX的猪繁殖与呼吸综合征抗体检测试剂盒(IDEXX Herd Check® PRRS X3)同时进行检测,比较两种检测方法的结果,计算两者之间的符合率。同时对5头免疫PRRS HuN4-F112不同时间采集的试验猪血清用25aa-ELISA方法对其进行检测,通过1.4方法确定的临界值判定方法,分析临床血清中特异性抗体产生和持续存在的时间。
2 结果
2.1 抗原最佳包被浓度和最佳血清稀释度的确定抗原的初始浓度为1 mg/mL,通过棋盘法检测结果显示随着抗原和抗体稀释倍数的增加,阳性血清的OD值存在下降趋势,阴性血清的OD值变化不显著。选择阴性血清的OD450值≤0.100,阳性血清的OD450值≥0.200,阳性血清和阴性血清OD450比值P/N≥2的最大稀释度,即血清的稀释度为1:40,抗原的稀释浓度为1:200,确定每孔抗原包被量为500 ng为最佳(见表1)。

表1 棋盘法测定阳性血清和阴性血清的OD450值Table 1 The optimization of coating concentration with virus by checkerboard titration
2.2 最佳反应条件的确定通过25aa-ELISA各反应条件的摸索与优化,最终确定4℃过夜为抗原最佳包被条件;封闭液为5%脱脂乳,4℃过夜封闭;2%BSA为血清稀释液,作用时间为30 min,二抗稀释度为1:8000,作用时间为30 min,TMB底物作用时间为20 min(如图1A、B、C、D、E、F)。
2.3 临界值判定检测临床血清样品300份,同时设IDEXX检测结果对照,阴性血清为148份,阳性血清为152份。根据检测结果绘制ROC曲线,其中灵敏度为纵坐标,以 1-特异性为横坐标。ROC 曲线下面积为0.984(95 % CI :0. 974~0.994)。
ROC分析列出从-0.124到5.915连续193个切点对应的灵敏度和1-特异度,对各切点灵敏度和特异度求和,得到的数值最大值为1.880,对应的S/P值为0.154,此值为阴阳性临界值,其灵敏度为93.4%、特异度为94.6% 。
2.4 特异性试验对已知CSFV、PRV、PPV、PEDV、PRRS rHN4-Δ25+NP49阳性血清检测结果显示OD450值分别为0.087、0.075、0.099、0.073、0.078,表明25 aa多肽抗原与上述猪病阳性血清没有交叉反应。
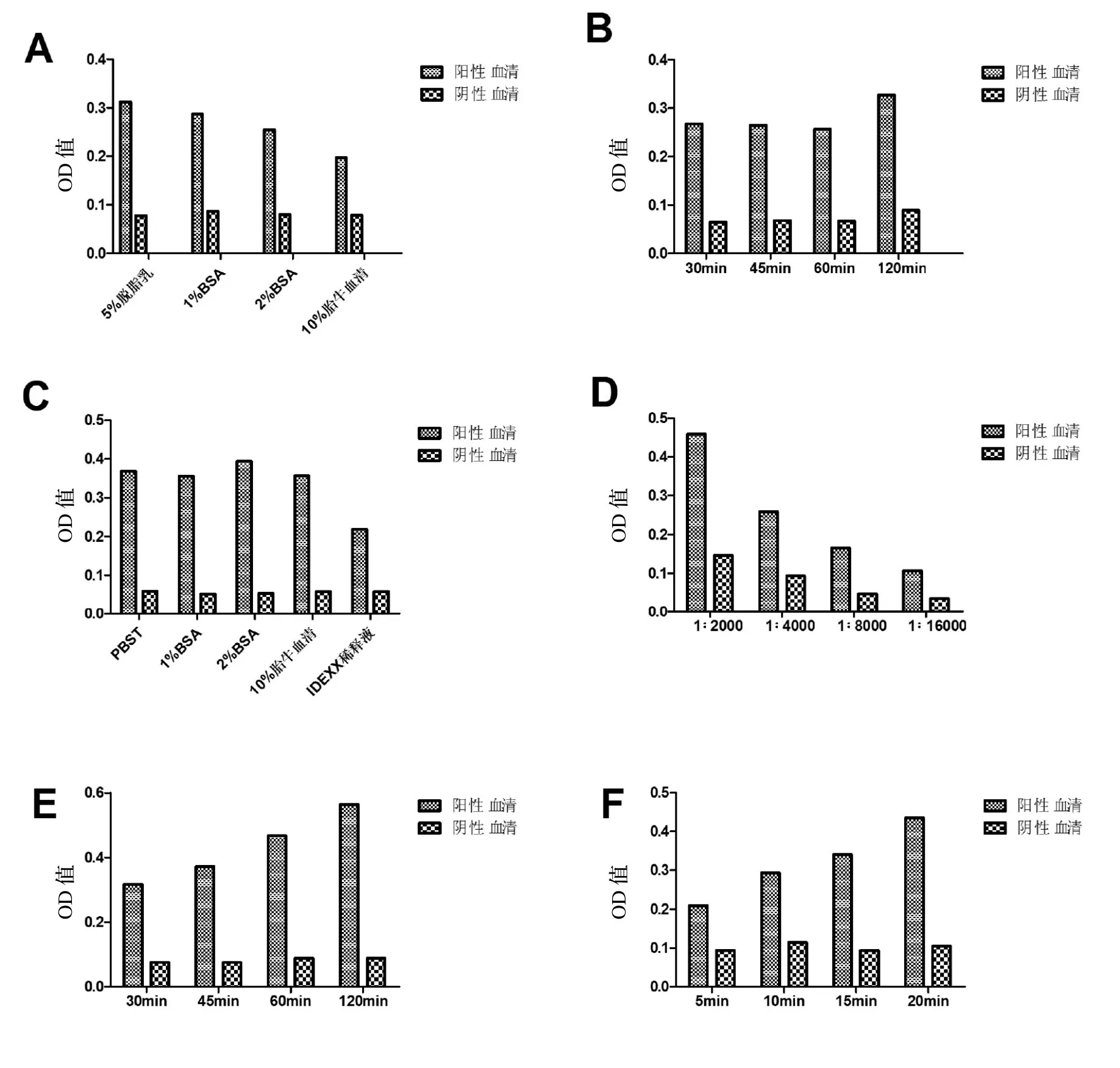
图1 25aa-ELISA反应条件Fig.1 Optimization of 25aa-ELISA reaction conditions
2.5 重复性试验重复性试验选取6份PRRS HuN4-F112抗体水平不同的猪血清,在相同试验条件下进行检测,实验结果表明,批内和批间重复性试验的变异系数(CV%)均小于10 %(见表2)。
2.6 样品的符合率检测应用间接25aa-ELISA方法与IDEXX公司生产的PRRSV抗体检测试剂盒HerdCheck PRRS X3检测样品,对310份血清样品进行判定并分析。结果如表3所示,表中*代表两种检测方法结果一致的样品,两者的阳性符合率为95.00%,阴性符合率为94.67%,总符合率达到94.84%。
使用25aa-ELISA方法对临床背景已知的HuN4 F112血清进行检测,通过OD值进行S/P值判定,结果显示猪免疫后21 d开始出现25 aa抗体阳性,此后一直持续检测到126 d仍呈现25 aa抗体阳性(图2)。
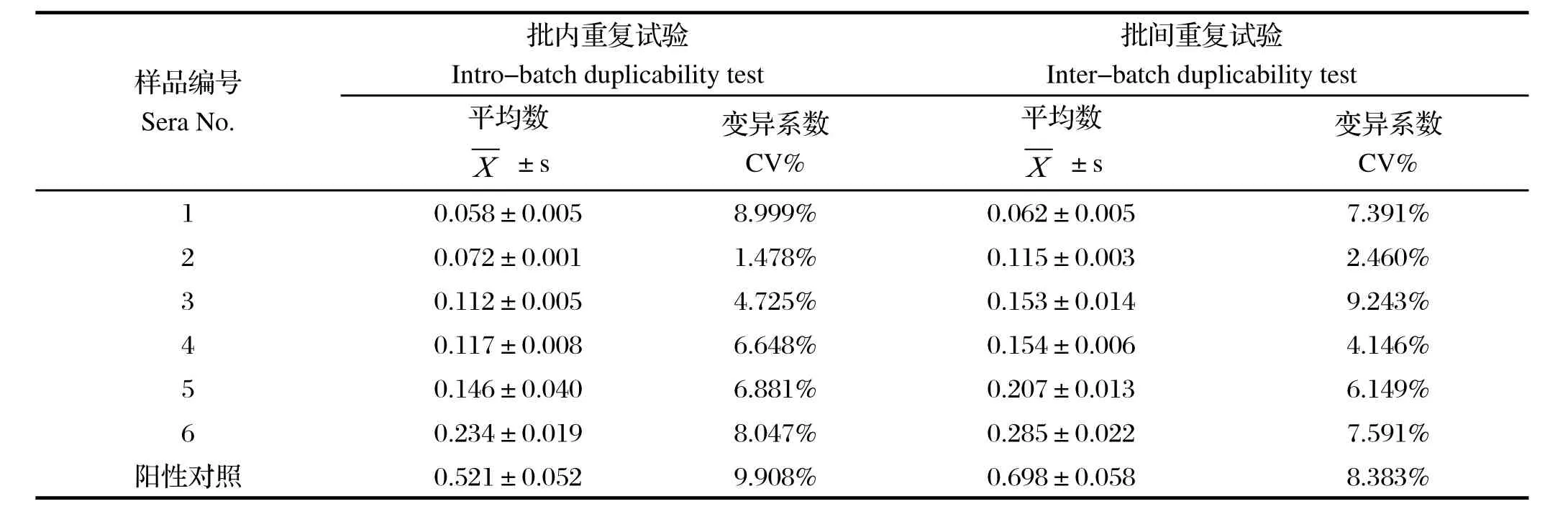
表2 25aa-ELISA 批内重复试验和批间重复试验结果Table 2 Intro-batch and inter-batch duplicability test of 25aa-ELISA

表3 血清样品的IDEXX Herd Check PRRS X3与25aa-ELISA检测结果比较Table 3 The comparison of serum detection by IDEXX HerdCheck PRRS X3 and 25aa-ELISA

图2 25aa-ELISA检测HuN4-F112血清样品结果Fig. 2 The results of 25aa-ELISA testing HuN4-F112 serum samples
3 讨论
免疫预防是控制PRRS的重要手段,但是诸多不同种类弱毒疫苗株的普遍应用,也为对PRRSV野毒感染的鉴别诊断带来了困难。本研究室选择NDV NP49基因优势抗原表位区域作为标记基因,利用反向遗传操作技术缺失了PRRSV NSP2基因中的25 aa区域,构建了基因标记弱毒疫苗株(rHN4-Δ25+NP49株),并通过免疫效果评价证实该疫苗株具有较好的免疫保护效果[7,8]。基于该基因标记疫苗株自身存在25 aa缺失的特点,可以使我们利用其建立区分其他毒株感染和弱毒疫苗免疫的鉴别诊断方法,从而更有助于对PRRS疫情的有效控制。
ELISA检测方法已经被普遍应用于对PRRS血清抗体检测,该方法可以短时间内检测大量血清样本,具有良好的特异性和灵敏度[9]。ELISA检测方法中包被抗原按照来源可以分为天然抗原、重组抗原和合成多肽抗原三大类。本试验中我们采用特异性标记区域缺失的25个氨基酸(25 aa)多肽作为抗原,保证抗原的特异性和纯度,避免了其他杂蛋白混杂存在干扰,而且25 aa相对分子量小、结构简单,降低了与其他病毒细菌抗体交叉反应的可能性。该合成肽抗原呈水溶性,可较好的包被于酶标板,操作省时方便。特异性多肽抗原不同于PRRSV全病毒抗原或高表达量的融合蛋白抗原,由于PRRSV感染猪产生的抗体大部分是针对N蛋白,血清样品中针对25 aa多肽抗原的抗体相对较少,因此选择纯度高的25 aa多肽作为包被抗原可以明显提高针对25 aa抗体检测的敏感度和特异性[10-12]。同时在洗涤过程中,通过增大25aa-ELISA的洗涤液盐离子浓度,还可以有效去除非特异性影响。本研究中使用PBST需要40 min才能有效去除非特异性,当增大盐离子浓度后,洗涤时间可缩短至15 min。
ROC曲线是反映敏感性和特异性连续变量的综合指标[13]。本实验采用灵敏度和特异度之和最大值为最佳阳性临界值[14]。根据PASS软件的ROC分析,S/P临界值为0.15。在ROC曲线上最靠近坐标图左上方的点为灵敏度和特异度均较高的阳性临界值,本试验中25aa-ELISA检测方法的敏感性为93.4%和特异性为94.6%。利用本方法检测已知背景的HuN4-F112株免疫血清样品,可判定为针对25aa血清转阳时间为21 d,利用IDEXX试剂盒检测N蛋白血清转阳时间为14 d。表明在PRRSV感染或免疫后针对Nsp2蛋白中25 aa肽段的抗体产生相对于N蛋白的抗体明显滞后,因此在早期检测25aa抗体呈现阴性。对临床样品检测结果显示,证明该方法具有良好的特异性和重复性,上述试验表明通过本研究建立的25aa-ELISA检测方法,能够有效区分PRRS野毒感染和基因标记疫苗免疫猪的血清抗体,为今后PRRSV基因工程标记疫苗的应用提供了有效检测方法。
[1] Rossow K D. Porcine reproductive and respiratory syndrome[J]. Vet Pathol, 1998, 35(1): 1-20.
[2] Hall W V. Porcine reproductive and respiratory syndrome(PRRS) virus: a significant disease of pigs[J]. Aust Vet J, 2005, 83(5): 260- 261.
[3] 郭宝清, 陈章水, 刘文兴, 等. 从疑似PRRS流产胎儿分离PRRSV的研究[J]. 中国畜禽传染病, 1996(2): 3-7.
[4] 童光志, 周艳君, 郝晓芳, 等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J]. 中国预防兽医学报, 2007(29): 323-327.
[5] Tong G Z, Zhou Y J, Hao X F,et al. Highly pathogenic porcine reproductive and respiratory syndrome, China [J]. Emerg Infect Dis, 2007, 13: 1434-1436.
[6] 邢海云, 梅林, 赵建增, 等. 猪繁殖与呼吸综合征弱毒疫苗的安全性及新型疫苗的研究进展[J]. 中国生物制品学杂志, 2011(2): 237-240.
[7] Xu Y Z, Zhou Y J, Zhang S R,et al. Identification of nonessential regions in nsp2 gene of an attenuated porcine reproductive and respiratory syndrome virus for replication in MARC-145 Cell[J]. Virol J, 2012, 9: 141-147.
[8] Xu Y Z, Zhou Y J, Zhang S R,et al. Stable expression of foreign gene in nonessential region of nonstructural protein 2 (nsp2) of porcine reproductive and respiratory syndrome virus: applications for marker vaccine design[J]. Vet Microbiol, 2012, 159(1-2): 1-10.
[9] Denac H, Moser C, Tratschin J D,et al. An indirect ELISA for the detection of antibodies against Porcine reproductive and respiratory syndrome virus using recombinant nucleocapsid protein as antigen[J]. J VirolMethods, 1997, 65(2): 169-181.
[10] 吴延功, 徐天刚, 王志亮, 等. 重组N蛋白抗原检测PRRSV抗体ELISA的研究Ⅰ. ELISA方法的初步建立及其标化[J]. 中国兽医学报, 2005, 25(4): 339-342.
[11] Music N, Gagnon C A. The role of porcine reproductive and respiratory syndrome (PRRS) virus structural and non-structural proteins in virus pathogenesis[J]. Anim Health Res Rev, 2010, 11(2): 135-163.
[12] 刘鹤, 刘永刚, 王淑杰, 等. 猪繁殖与呼吸综合征病毒Nsp7间接ELISA检测方法的建立[J]. 中国预防兽医学报, 2011, (12): 949-952.
[13] Tian J. A nonparametric method for comparing the areas under two ROC curves[J]. J Math Med, 2002, 15 (3): 201-204.
[14] Edwards D C, Metz C E. The three-class ideal observer for univariate normal data: Decision variable and ROC surface properties[J]. J Math Psychol, 2012, 56(4): 256-273.
DEVELOPMENT OF ELISA DIFFERENTIATION DIAGNOSIS FOR A DUALMARKER VACCINE OF PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS
SUN Jing, ZHOU Yan-jun, JIANG Yi-feng, XU Yan-zhao, TONG Wu, TONG Guang-zhi
(Shanghai Veterinary Research Institute,CAAS, Shanghai 200241,China)
To develop a ELISA method for detection of antibody against 25aa in Nsp2 region which was deleted from a dual-marker PRRSV vaccine strain rHN4-Δ25 + NP49. The 25aa peptide was synthesized artif cially and used as antigen to coat the microplate for ELISA. The optimal coating concentration of antigen was 500 ng/well. optimal serum dilution was 1:40, and the cut off S/P value was 0.15. The reproducibility test showed that the coeff cients of variation for intra- and inter-assay were lower than 10%. 25aa-ELISA method was used to test clinical samples and compared with commercial PRRSV-detection-kit (IDEXX). The results showed that coincidence of two methods was 94.84%. Then 25aa-ELISA was used to test HuN4-F112 immunized serum samples from 1 to 126 days post immunization (dpi). Specific antibody against 25aa was detected during 21 to 126 dpi. The vaccine immunized pigs could be differentiated from naturally infected pigs with wild type PRRSVs. Therefore, this study set up a foundation for further investigation of the differentiation diagnosis for a dual-marker vaccine rHN4-Δ25 + NP49.
Highly pathogenic Porcine reproductive and respiratory syndrome virus; peptide antigen; 25aa-ELISA
S852.659.6
A
1674-6422(2014)01-0030-07
2013-10-09
国家863计划项目(2011AA10A208-2);国家国际科技合作重点计划项目(2010DF33920);科研院所技术开发研究专项资金(2012EG134237);上海市科技兴农重点攻关项目(沪农科攻字(2012)第2-5号);中国农业科学院基本科研业务费预算增量项目(2013BL039)
孙晶,女,硕士研究生,预防兽医学专业
童光志,E-mail:gztong@shvri.ac.cn
