大肠杆菌Nissle 1917鞭毛蛋白部分高变区功能初步研究
2014-04-13朱国强
杨 颖,朱 军,朱国强
(1.扬州大学兽医学院,扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
大肠杆菌Nissle 1917鞭毛蛋白部分高变区功能初步研究
杨 颖1,2,朱 军1,2,朱国强1,2
(1.扬州大学兽医学院,扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
初步研究大肠杆菌Nissle 1917(E. coli Nissle 1917,EcN)鞭毛蛋白(Flagellin, FliC)高变区的功能,为探讨其作为表面展示系统的可行性打下基础。以EcN无质粒克隆(EcN was cured of its 2 cryptic plasmids pMUT1 and pMUT2 resulting in EcNc)为实验菌株,分别构建2个鞭毛蛋白基因(f iC)高变区859-888位、829-858位的缺失突变株和回补菌株。分析突变区域对EcNc的生长性能、生化特性、运动性及抗原性等方面的影响。结果显示:EcNc、两个缺失株和回补株的生长特性无明显差异,且三者生化试验结果一致。缺失突变株在半固体培养基上不能运动,而回补株均恢复了原运动性;缺失突变株均不与H1单因子血清发生凝集,而互补菌株均能产生与EcNc一致的凝集反应。表明高变区的这两个区域尽管不影响菌株的生长性能和生化特性,但与EcN的运动性及抗原性密切相关。这为进一步探索EcN鞭毛展示技术的研究提供了一定的数据。
大肠杆菌Nissle 1917;鞭毛蛋白;高变区
鞭毛蛋白(flagellin, FliC)是鞭毛的主要结构蛋白,不同血清型大肠杆菌中的fliC基因有差异。FliC N端和C端高度保守,存在于鞭毛丝的轴心,是鞭毛发挥佐剂活性的重要部位;而中间区域暴露于鞭毛表面,在长度和组成上呈现高度变化,形成不同的抗原表位,这个区域被称为“高变区”[1,2]。全部或部分缺失鞭毛蛋白高变区会使鞭毛的抗原性降低,但不会影响其佐剂活性[3]。鉴于高变区可容许部分区域的缺失和外源多肽插入[4,5],基于此建立的鞭毛表面展示技术被广泛地运用于构建新型活疫苗的研究[6-8]。
益生菌大肠杆菌Nissle 1917(EcN)因其独特的性质,诸如无致病性,能合成小菌素、铁摄取系统,强有力的肠道定殖能力等,一直被用作益生制剂。目前,EcN在临床上主要用于治疗腹泻、炎症性肠炎以及便秘等[9-11]。鉴于EcN可携带外源基因在肠道表达,激活机体的免疫系统,适合用于生物载体口服活苗的候选株[12,13]。
本试验以EcN鞭毛为切入点,构建了EcNcfliC基因高变区缺失突变株EcNc::fliC1、EcNc::fliC2和回补菌株EcNc::fliC1/pBR322-fliC、EcNc::fliC2/pBR322-fliC。分析突变区域对EcNc的生长性能、生化特性、运动性及抗原性等方面的影响。
1 材料和方法
1.1 材料本研究中用到的质粒和菌株见表1。

表1 质粒和菌株Table 1 Bacterial strains and plasmids
1.2 生化试剂限制性内切酶、T4 DNA连接酶、DNA Marker为TaKaRa公司产品;Expand Long Range dNTPack购自Roche公司;大肠杆菌H1抗原单价血清购自天津生物芯片技术有限公司;蔗糖购自Sigma公司。
1.3 EcNc fiC的克隆和鉴定以EcNc基因组DNA为模板,P1、P2(P1:5′-GGCTCTAGAATGGCACAAG TCATTAATACCAACA-3′;P2:5′-ATAGAGCTCTTAACCCTGCAGCAGAGAC-3′)为引物PCR扩增得到fliC片段,下划线为XbaⅠ和SacⅠ酶切位点,与pUC18同时双酶切、胶回收后,用T4连接酶连接、转化DH5α,并挑取疑似阳性重组子,进行酶切鉴定和测序,获得pUC18-fliC。
1.4 fiC1和fiC2缺失突变片段引物的设计
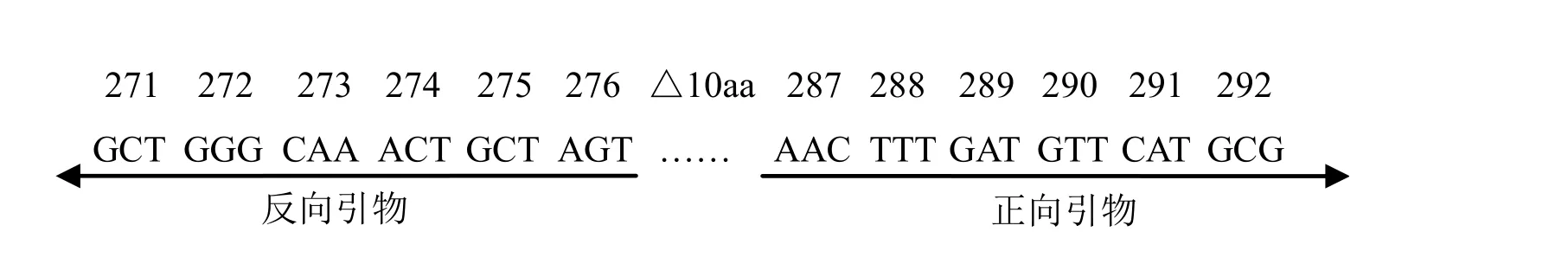
1.4.1 用于fliC1突变片段的正向及反向引物
fliC1突变片段正向引物P3:5′-CATCTCGAG ACAATCGGAGGACAGGAAGC-3′;fliC1突变片段反向引物P4:5′- ACTCTCGAGCACTTCACC GCTTGCTGCTT- 3′。其中,在正向引物和反向引物的5′端加入保护碱基和CTCGAG碱基序列,替代fliC859-888位碱基。
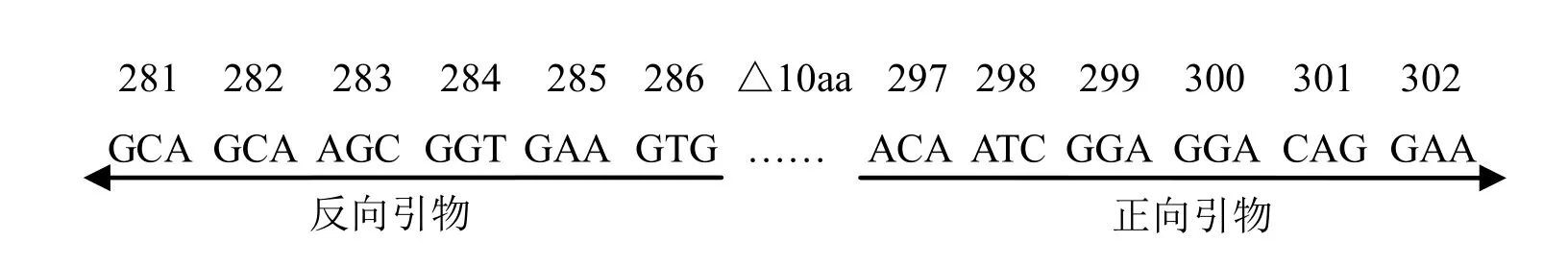
1.4.2 用于fliC2突变片段的正向及反向引物
fliC2突变片段正向引物P5:5′-CATCTCGAG AACTTTGATGTTGATGCGAATG-3′;fliC2突变片段反向引物P6:5′-ACTCTCGAGACTAGCAG TTTGCCCAGCC-3′。其中,在正向引物和反向引物的5′端加入保护碱基和CTCGAG碱基序列,替代fliC829-858位碱基。
1.5 缺失突变株及回补株的构建以pUC18-fliC质
粒为模板,P3和P4、P5和P6为引物分别进行反向PCR扩增,产物经XhoⅠ酶切、T4连接酶连接、转化DH5α,挑取疑似阳性重组子进行酶切鉴定和测序,获得pUC18-fliC1、pUC18-fliC2。根据朱春红等[14]介绍的自杀性载体技术构建EcNc fliC基因高变区缺失突变株EcNc::fliC1、EcNc::fliC2,即用XbaⅠ和SacⅠ对pUC18-fliC1、pUC18-fliC2和自杀载体pRE112分别进行双酶切,将fliC1、fliC2片段分别与线形的pRE112质粒连接,转化E.coliCC118 λpir,并挑取疑似阳性重组子进行酶切鉴定,获得pRE112-fliC1、pRE112-fliC2。提取质粒pRE112-fliC1、pRE112-fliC2分别转化至EcNc感受态,筛选氯霉素抗性菌,此抗性菌即为疑似一次重组菌。将一次重组菌划线LB(Cm 34 ug/mL)平板传代纯化后挑取单菌落接种4 mL LB(NaCl free)液体培养基,37 ℃震荡培养至OD600约为0.5时分别涂布含蔗糖的LB(sucrose 10%,NaCl free)琼脂平板。从含蔗糖的LB平板上选择氯霉素抗性敏感的菌落进行PCR扩增后测序,验证缺失突变位点,筛选基因缺失突变株EcNc::fliC1、EcNc::fliC2。
以EcNc基因组DNA为模板,P7、P8(P7:5′-GCTCTAGAATGGCACAAGTCATTAATACCA ACAG-3′,P8:5′- CAGCGTCGACTTAACCCTGC AGCAGAGACAGAAC-3′)为引物,PCR 扩增得到互补片段fliC基因全长,连接到pBR322载体构建重组质粒pBR322-fliC,酶切鉴定后,将该质粒转化到缺失突变株 EcNc::fliC1、EcNc::fliC2,构建回补菌株。
1.6 细菌生长、生化特性、运动性及H1抗原性血清学测定按照常规方法进行EcNc、缺失突变株及回补株生长曲线的测定,将过夜生长的种子液OD600调整为1.0后1:100转接于新鲜的LB中,间隔1 h测取各菌液OD600的数值绘制生长曲线。将EcNc、缺失突变株及回补株分别纯化培养,进行生化鉴定。对菌株进行运动性检测,取60 μL过夜的种子液重新转接于6 mL新鲜的LB培养,然后将EcNc、缺失突变株及回补株分别稀释至OD600=1.0,各取1 μL滴加于0.3%的半固体运动平皿上,37 ℃生长约24 h,观察运动圈的大小。按照常规玻片凝集试验进行EcNc、缺失突变株及回补株鞭毛H1抗原性血清学测定。
2 结果
2.1 pUC18-f iC的构建扩增fliC基因连接到pUC18,经双酶切和测序表明,EcNcfliC基因(约1800 bp)成功克隆到pUC18质粒载体中(图1)。

图1 质粒pUC18-f iC酶切鉴定Fig.1 Identif cation of the plasmid pUC18-f iC by restriction enzymes digestion
2.2 缺失突变菌株与回补菌株的构建如图2所示,反向PCR扩增在约4500 bp处有明亮的特异性电泳条带,在两个缺失突变体转化的平板上分别随机挑选克隆,提取质粒大小约2900 bp,通过双酶切鉴定,获得缺失突变片段fliC1、fliC2及与载体片段pUC18大小相同的DNA条带,测序结果均与预期相符(图3中划横线处表示发生突变的碱基序列)。将fliC1、fliC2片段连接到自杀载体pRE112,转化E.coliCC118 λpir。从转化平板上挑取单个菌落提取质粒进行酶切鉴定,结果均与预期的大小相同。pRE112-fliC1、pRE112-fliC2分别转化到EcNc中,经过第一次同源重组和第二次同源重组筛选到的菌株,扩增其鞭毛蛋白基因测序,证实获得了fliC859-888位以及829-858位碱基被CTCGAG碱基序列替换的缺失突变株EcNc::fliC1、EcNc::fliC2(图略)。回补菌株在Amp+LB平板上筛选,进行质粒提取和酶切分析验证(图4),获得了回补菌株EcNc::fliC1/pBR322-fliC、EcNc::fliC2/pBR322-fliC。

图2 pUC18-f iC1、pUC18-f iC2的构建Fig.2 Construction of pUC18-f iC1 and pUC18-f iC2
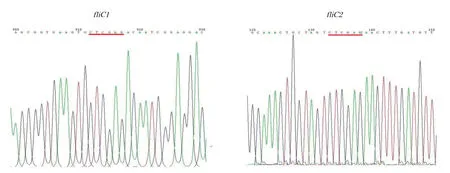
图3 fliC1和fliC2缺失突变片段的测序结果Fig.3 DNA sequencing results of mutant fragments
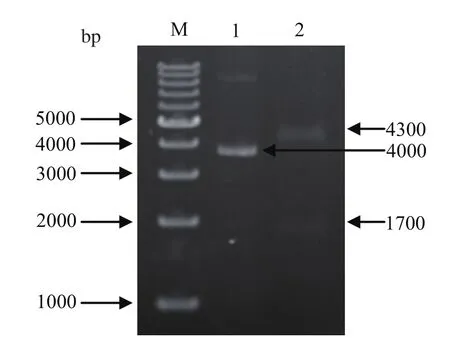
图4 质粒pBR322-f iC酶切鉴定Fig.4 Identif cation of the plasmid pBR322-f iC by restriction enzymes digestion
2.3 生长能力、生化特性、运动性及H1抗原性血清学测定图5所示EcNc、缺失突变株及回补株在LB培养基中的生长曲线,表明EcNc在对数期的生长速率略高于缺失株和回补株,但无明显差异。生化试验结果显示,EcNc、缺失突变株及回补株在麦芽糖、葡萄糖、海藻糖、甘露醇、山梨醇、硫化氢、柠檬酸钠等代谢分解利用上并无定性差异,均为α-半乳糖苷酶、β-半乳糖苷酶、赖氨酸脱羧酶、鸟氨酸脱羧酶阳性。运动性平板检测细菌运动性,24 h后观察,缺失突变株不具有运动能力,细菌只在接种的原点生长,而回补株可以恢复到EcNc的运动水平(图6)。凝集反应显示缺失突变株均不与H1单因子血清发生凝集,而回补菌株能产生与EcNc一致的凝集反应。
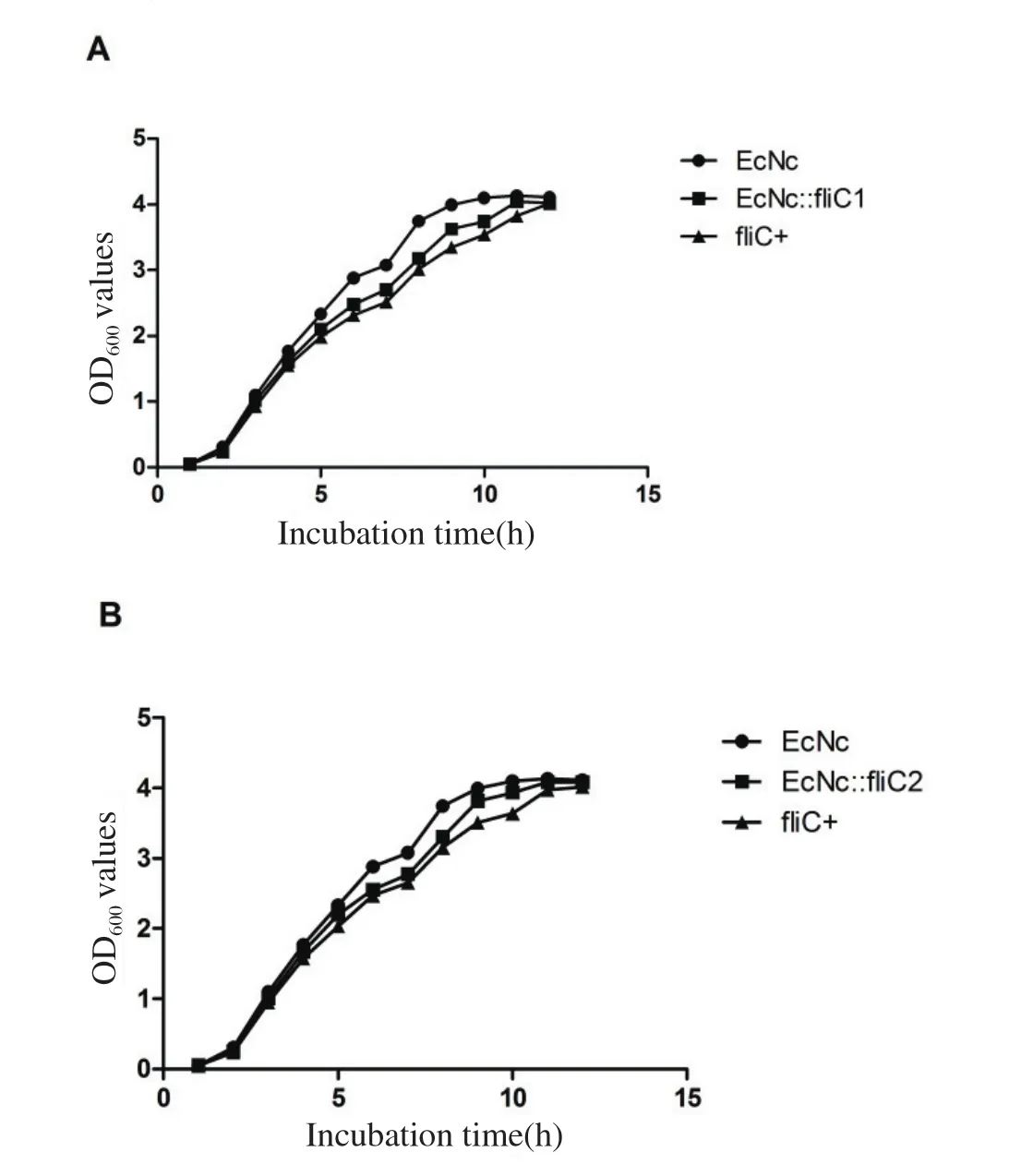
图5 EcNc、缺失突变株及回补株的生长曲线Fig.5 Growth curve of strains

图6 EcNc、缺失突变株及回补株的运动性Fig.6 Motility of strains
3 讨论
黏膜是机体与外界环境接触的最前沿,是机体的第一道屏障,研发的黏膜免疫疫苗尤其是口服活疫苗在临床上期待有很好的疗效[15]。众多研究表明益生菌EcN的优势[9-11],且适合作为生物载体口服活苗候选株,携带外源基因在肠道靶向表达,激活机体的黏膜免疫系统[12-13]。EcN在运动性试验中体现出强大的运动能力,较短时间内出现较大的运动环,这有赖于它自身的鞭毛系统。EcN的鞭毛不仅介导菌体的运动性,而且能诱导人体产生β防御素-2。最近的报道表明,鞭毛具有较强的黏附能力,促进菌体在肠道的定殖[16-17]。FliC是鞭毛的主要结构蛋白,其N端和C端高度保守区含有与TRL5的结合位点,主要介导鞭毛蛋白的佐剂活性;中部的高变区是鞭毛蛋白的抗原区域,该区域能允许部分缺失和容纳一定的外源多肽,使鞭毛携带外源抗原在菌体表面表达。早在1988年,Kuwajima等[4]就随机缺失大肠杆菌K-12鞭毛蛋白高变区以研究该区域的缺失和短肽的插入对H抗原性的影响。Benita等[5]把金黄色葡萄球菌纤连蛋白结合蛋白A(FnbpA)、小肠结肠炎耶尔森菌粘附素YadA的不同肽段嵌合入大肠杆菌JT1鞭毛蛋白高变区,将不同肽段功能性地展示于大肠杆菌表面。在部分沙门氏菌和大肠杆菌中,鞭毛高变区嵌合表达外源抗原的方法已成功地应用于活菌疫苗的研制[6]。
本试验构建了EcNc fliC基因高变区缺失突变株EcNc::fliC1、EcNc::fliC2及其回补株EcNc::fliC1/pBR322-fliC、EcNc::fliC2/pBR322-fliC,同时对EcNc、缺失突变株及回补株的生长性能、生化特性、运动性及抗原性进行了测定。三者的生化特性一致,生长性能没有显著差异,说明缺失突变区域不影响菌株的生长,这与贺扬等[18]对迟缓爱德华氏菌野生株、fliC基因突变株及回补株生长性能的测定结果不一致,他们的结果显示突变株的生长速度明显低于野生株和回补株,且突变株所能达到的最大密度只有野生株和回补株的29%。EcN FliC基因高变区859~888位、829~858位的缺失使菌株失去了运动性和抗原性。Troge等[19]构建的EcN高变区缺失株亦丧失了运动性能。杨菁毅等[2]将HIV-1 p24蛋白替换了E. coliK12鞭毛蛋白的可变区去除了鞭毛蛋白自身的免疫原性。刘芳等[20]构建的3个沙门氏菌鞭毛蛋白高变区(190~278、220~320、180~400)缺失株均失去了H抗原性,说明高变区域对其抗原性具有重要影响。FliC高变区的缺失可能引起鞭毛形成压力,影响了FliC亚基之间或者FliC和其他鞭毛的蛋白之间相互作用的稳定性[4],破坏了FliC的发夹结构,二级结构的改变亦可能不利于FliC通过孔道运输,而这是鞭毛进行组装的关键[21],即便FliC通过了孔道运输组装成鞭毛丝,但鞭毛脆性增加容易断落,这也影响了其运动性能[19]。今后的实验将尝试在高变区的其他区域进行缺失和插入外源多肽,这将为EcN鞭毛展示技术的应用提供了一定的数据,为探索大肠杆菌Nissle 1917鞭毛作为运送载体的可行性打下基础。
[1] Smith K D, Andersen-Nissen E, Hayashi F,et al. Tolllike receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility[J]. Nat Immunol, 2003, 4(12): 1247-1253.
[2] Yang J, Zhong M, Zhang Y,et al. Antigen replacement of domains D2 and D3 in flagellin promotes mucosal IgA production and attenuates flagellin-induced inflammatory response after intranasal immunization[J]. Hum Vaccin Immunother, 2013, 9(5): 1084-1092.
[3] Nempont C, Cayet D, Rumbo M,et al. Deletion of flagellin's hypervariable region abrogates antibodymediated neutralization and systemic activation of TLR5-dependent immunity[J]. J Immunol, 2008, 181(3): 2036-2043.
[4] Kuwajima G. Construction of a minimum-size functional flagellin of Escherichia coli[J]. J Bacteriol, 1988, 170(7): 3305-3309.
[5] Westerlund-Wikstrom B, Tanskanen J, Virkola R,et al. Functional expression of adhesive peptides as fusions to Escherichia coli flagellin[J]. Protein Eng, 1997, 10(11): 1319-1329.
[6] Westerlund-Wikstrom B. Peptide display on bacterial flagella: Principles and applications[J]. Int J Med Microbiol, 2000, 290(3): 223-230.
[7] Ben-Yedidia T, Arnon R. Flagella as a platform for epitope-based vaccines[J]. Isr Med Assoc J, 2006, 8(5): 316-318.
[8] Zhang H, Liu L, Wen K,et al. Chimeric flagellin expressed by Salmonella typhimurium induces an ESAT-6-specific Th1-type immune response and CTL effects following intranasal immunization[J]. Cell Mol Immunol, 2011, 8(6): 496-501.
[9] Willer Y, Muller B, Bumann D. Intestinal inflammation responds to microbial tissue load independent of pathogen/non-pathogen discrimination[J]. PloS One, 2012, 7(5): e35992.
[10] Zhou S, Zhang M, Wang J. Tumor-targeted delivery of TAT-Apoptin fusion gene using Escherichia coli Nissle 1917 to colorectal cancer[J]. Med Hypotheses, 2011, 76(4): 533-534.
[11] Seo E J, Weibel S, Wehkamp J,et al. Construction of recombinant E. coli Nissle 1917 (EcN) strains for the expression and secretion of defensins[J]. Int J Med Microbiol, 2012, 302(6): 276-287.
[12] Buddenborg C, Daudel D, Liebrecht S,et al. Development of a tripartite vector system for live oral immunization using a gram-negative probiotic carrier[J]. Int J Med Microbiol, 2008, 298(1-2): 105-114.
[13] Remer K A, Bartrow M, Roeger B,et al. Split immune response after oral vaccination of mice with recombinant Escherichia coli Nissle 1917 expressing fmbrial adhesin K88[J]. Int J Med Microbiol, 2009, 299(7): 467-478.
[14] 朱春红, 孙小庆, 何素芬, 等. 基于Red同源重组和高效自杀性载体系统构建肠炎沙门氏菌突变株方法的比较[J].中国预防兽医学报, 2009, 31(2): 81-84.
[15] Pasetti M F, Simon J K, Sztein M B,et al. Immunology of gut mucosal vaccines[J]. Immunol Rev, 2011, 239(1): 125-148.
[16] Zhou M, Duan Q, Zhu X,et al. Both flagella and F4 fimbriae from F4ac(+) enterotoxigenic Escherichia coli contribute to attachment to IPEC-J2 cells in vitro[J]. Vet Res, 2013, 44(1): 30.
[17] Duan Q, Zhou M, Zhu X,et al. Flagella from F18+Escherichia coli play a role in adhesion to pig epithelial cell lines[J]. Microb Pathog, 2013, 55: 32-33.
[18] He Y, Xu T, Fossheim L E,et al. FliC, a Flagellin Protein, Is Essential for the Growth and Virulence of Fish Pathogen Edwardsiella tarda[J]. PloS One, 2012, 7(9): e45070.
[19] Troge A, Scheppach W, Schroeder B O,et al. More than a marine propeller-the fagellum of the probiotic Escherichia coli strain Nissle 1917 is the major adhesin mediating binding to human mucus[J]. Int J Med Microbiol, 2012, 302(7-8): 304-314.
[20] Liu F, Yang J, Zhang Y,et al. Recombinant fagellins with partial deletions of the hypervariable domain lose antigenicity but not mucosal adjuvancy[J]. Biochem Biophys Res Commun, 2010, 392(4): 582-587.
[21] Okuda J, Murayama F, Yamanoi E,et al. Base changes in the fliC gene of Edwardsiella tarda: possible effects on flagellation and motility[J]. Dis Aquat Organ, 2007, 76(2): 113-121.
PRELIMINARY STUDY ON THE FUNCTIONAL ROLE OF FLAGELLIN PARTIAL HYPERVARIABLE DOMAIN OF ESCHERICHIA COLI NISSLE 1917
YANG Ying1,2, ZHU Jun1,2, ZHU Guo-qiang1,2
(1. College of Veterinary Medicine Yangzhou University, Yangzhou 225009, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
The function of E. coli Nissle 1917 Flagellin partial hypervariable domain was investigated, it provided a basis for the potential approach of using E. coli Nissle 1917 Flagellin as a carrier for foreign peptides. We constructed two EcNc fagellin variants with deletions in the hypervariable domain 859-888 bp and 829-858 bp as well as their complemented strains. The bacterial growth, biochemical characteristics, motility and antigenicity were tested and analyzed. There were no apparent difference in growth rate and biochemical characteristics among EcNc,variants and complemented strains. Two variants exhibited abrogated motility, while the complementation strains restored the phenotype of EcNc, meanwhile, two variants lost substantial H antigenicity compared with both EcNc and complemented strains. EcNc fagellin variants with partial deletions of the hypervariable domain lose motility and antigenicity but did not inf uence growth rate and biochemical characteristics. These results provided an important experimental data and clues forexploration of peptide display on EcN f agella in the future.
E. coli Nissle 1917; f agellin; hypervariable domain
S852.612
A
1674-6422(2014)01-0037-07
2013-11-07
国家自然科学基金(30571374;30771603;31072136;31270171);江苏高校优势学科建设工程资助项目;教育部创新团队;科技部转基因生物新品种培育重大专项(2009ZX08006-004B);重大动物疫病防控技术引进(国家农业部948计划,2011-G24)
杨颖,女,博士研究生,预防兽医学专业
朱国强,E-mail:yzgqzhu@hotmail.com;yzgqzhu@yzu.edu.cn
