BCL-2基因多态性与复治晚期非小细胞肺癌TKI治疗疗效的关联研究
2014-04-13洪卫林宝钗张贝贝余新民王凯毛伟敏张沂平
洪卫 林宝钗 张贝贝 余新民 王凯 毛伟敏 张沂平
BCL-2基因多态性与复治晚期非小细胞肺癌TKI治疗疗效的关联研究
洪卫 林宝钗 张贝贝 余新民 王凯 毛伟敏 张沂平
目的 通过检测BCL-2基因多态性,探讨其与复治晚期非小细胞肺癌表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗疗效的关系。方法116例复治晚期非小细胞肺癌患者,既往均接受过化疗,失败后接受吉非替尼或厄洛替尼靶向治疗。采用多聚酶链反应方法检测患者外周血白细胞中BCL-2基因多态性。结果116例患者总有效率为25.9%,BCL-2各基因型间患者间的有效率无明显差异。相比BCL-2其它基因型,AA型疾病控制率更低(40%vs 75.2%,P=0.005)。单因素分析中位PFS,AA型中位无进展时间短于其它基因型(2.6个月vs 6.0个月,P=0.025),而女性长于男性(10.2个月vs 4.6个月,P=0.04);不吸烟者长于有吸烟史者(11.9个月vs2.5个月,P=0.000);病理类型为腺癌长于其他类型(11.9个月vs 4.1个月,P=0.000),均达到统计学差异。多因素分析结果显示,包括性别、吸烟史、ECOG评分和病理类型,BCL-2基因多态性为PFS的独立预后因素(P=0.049)。结论复治晚期EGFR突变状态未明的非小细胞肺癌BCL-2(-938C>A)基因型为AA者是提示近期疗效较差的指标。
BCL-2基因 多态性 非小细胞肺癌 酪氨酸激酶抑制剂
肿瘤组织表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变是小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗最重要的疗效预测因子[1],但晚期非小细胞肺癌患者也常因肿瘤组织量太少导致EGFR突变状态未明,ISEL研究的数据中能够获得基因突变检测标本的患者仅约20%[2]。月R21[3]、TITAN[4]和INTEREST[5]等临床研究显示了厄洛替尼和吉非替尼在晚期NSCLC二三线治疗中的疗效。目前NCCN指南指出在二线及二线以上治疗时,对EGFR突变状态未明的患者可以选择TKI,如何对这些患者进行治疗前的疗效预估是我们面临的难题。研究发现,TKI的一个重要作用机制是诱导肿瘤细胞凋亡[6-7],而月CL-2基因家族与细胞凋亡的进程密切相关,本文探索晚期非小细胞肺癌EGFR突变未明患者TKI近期疗效与凋亡相关基因月CL-2基因多态性的关系,报道如下。
1 对象和方法
1.1 一般资料 浙江省肿瘤医院化疗中心2009年1月至2012年12月收治的116例晚期非小细胞肺癌患者,均经组织学或细胞学病理确诊;采血前均对本研究知情同意并签署知情同意书,本研究获得浙江省肿瘤医院医学伦理委员会审核批准。
1.2 方法 抽取患者治疗前外周静脉全血2 ml,EDTA抗凝,采用全血基因组DNA提取试剂盒(康为世纪公司产品),按照说明书进行基因组DNA提取,提取后-80℃冰箱保存备用。用紫外分光光度计测定DNA浓度和纯度。OD260/OD280比值的参考值为1.8~2.0。
1.2.1 PCR扩增 引物序列为:上游引物5′-TTATCCAGCAGCTTTTCGG-3′,下游引物5′-GGCGGCAGATGAATTACAA-3′。PCR反应总体积为25μl,2×Gold-Star Taqman Mixture(with ROX)12.5μl,上、下游引物各1μl,样本2μl,去离子水8.5μl。PCR的反应条件为:95℃×10min预变性;95℃×30s变性,60℃×30s退火,72℃×60s延伸,35个循环。本实验已设空白对照孔,每个样本均设置复孔。
1.2.2 琼脂糖凝胶电泳体系 将TAE缓冲液、1%琼脂糖、溴化乙锭(0.5μg/ml)在电压120V的琼脂糖凝胶电泳体系电泳60min。
1.3 疗效评价标准 采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)[8],分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。客观缓解率(objective response rate,ORR)=(CR+ PR)/(CR+PR+SD+PD)×100%。疾病控制率(disease control rate,DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。
1.4 随访和生存分析 随访采用门诊、电话或书信方式,末次随访时间为2012年11月30日。无进展生存期(progression-free survival,PFS)定义为患者自接受吉非替尼或厄洛替尼靶向治疗开始至疾病进展、死亡或不良反应不可耐受。对于在随访截止日期无进展的病例,在统计时作截尾数据处理。
1.5 统计学处理 采用SPSS 13.0统计软件,基因多态性与疗效评价的关系采用Pearson χ2检验法,单因素分析PFS采用Kaplan-Meier生存曲线分析及log rank检验,多因素分析采用Cox回归。
2 结果
2.1 一般临床特征 116例患者,均既往经过一至二线化疗失败后开始二、三线EGFR-TKI靶向治疗,其中41例患者服用吉非替尼(易瑞沙)250mg,1次/d治疗:75例患者服用厄洛替尼(特罗凯)150mg 1次/d治疗。所有患者具体临床特征详见表1。

表1 患者的一般临床特征
2.2 基因多态性检测结果判定 月CL-2基因片段的PCR扩增出目的长度为252bp,完全被月CC1切开154bp和98bp为AA型;完全未被切开为252bp,即CC型,条带为双链DNA片段一条被酶切,一条未切开的产物酶谱,CA型,见图1。
2.3月CL-2基因片段多态性与TKI治疗ORR的关系 116例患者,总有效率25.9%,其中月CL-2基因基因CC型、CA型及AA型分别为52、49和15例,有效率分别为30.8%、28.6%和26.7%,月CL-2各基因型间患者间的有效率无明显差异。相比月CL-2其它基因型,AA型DCR更低(40.0%vs 75.2%,P=0.005)。见表2。
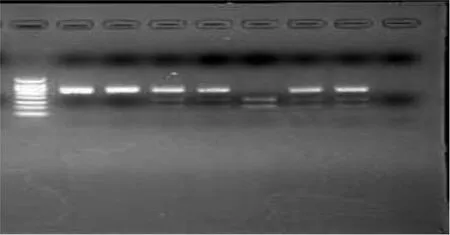
图1 BCL-2基因多态性判定图(在凝胶成像系统扫描中最左侧为maker电泳通道,(左边数起)第1、2通道为BCL-2基因基因型是CC型,第3、4、6、7为CA型,第5通道为AA型。)
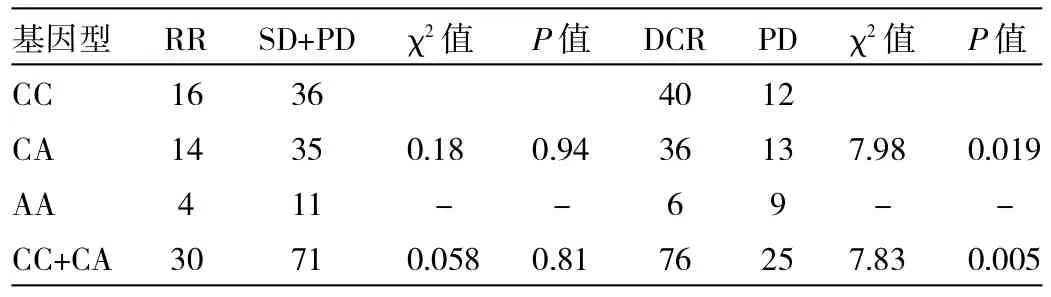
表2 BCL-2(-938C>A)基因多态性与TKI治疗疗效的关系
2.4 单因素分析PFS 单因素分析中位PFS,月CL-2基因型为AA型中位无进展时间短于其它基因型(2.6个月vs 6.0个月,P=0.025),而女性长于男性(10.2个月vs 4.6个月,P=0.04);不吸烟者长于有吸烟史者(11.9个月vs 2.5个月,P=0.000);病理类型为腺癌长于其他类型(11.9个月vs 4.1个月,P=0.000),均有统计学差异,见表3。
2.5 多因素分析PFS 多因素分析结果显示,包括性别、吸烟史和病理类型在内,月CL-2基因多态性为PFS的独立预后因素(P=0.05),见表4。
3 讨论
TKI是晚期非小细胞肺癌21世纪最重要的治疗进展,EGFR基因突变是最重要的疗效预测因子[1],中国的OPTIMAL[9]、日本的WJTOG3405[10]和NEJ002[11]及欧洲EURTAC[12]等多项三期随机对照研究结果显示EGFR突变的晚期非小细胞肺癌,其有效率可以高达58~82%,显著高于传统的第3代新药与铂的两药联合化疗,PFS也较化疗组明显延长。然而,临床实践过程中,比较多的晚期非小细胞患者因肿瘤组织采集困难、患者依从性等多种原因导致无法取得足够的肿瘤组织量进行EGFR突变状态检测,临床上能够获得基因突变检测标本的患者仅约20%(来自ISEL研究的数据)[2]。对这些EGFR突变状态未明的患者,疗效预测目前主要依赖一些临床因素,如亚裔、女性、不吸烟、腺癌等[13]。如何对这些患者进行治疗前的疗效预估是我们面临的难题。
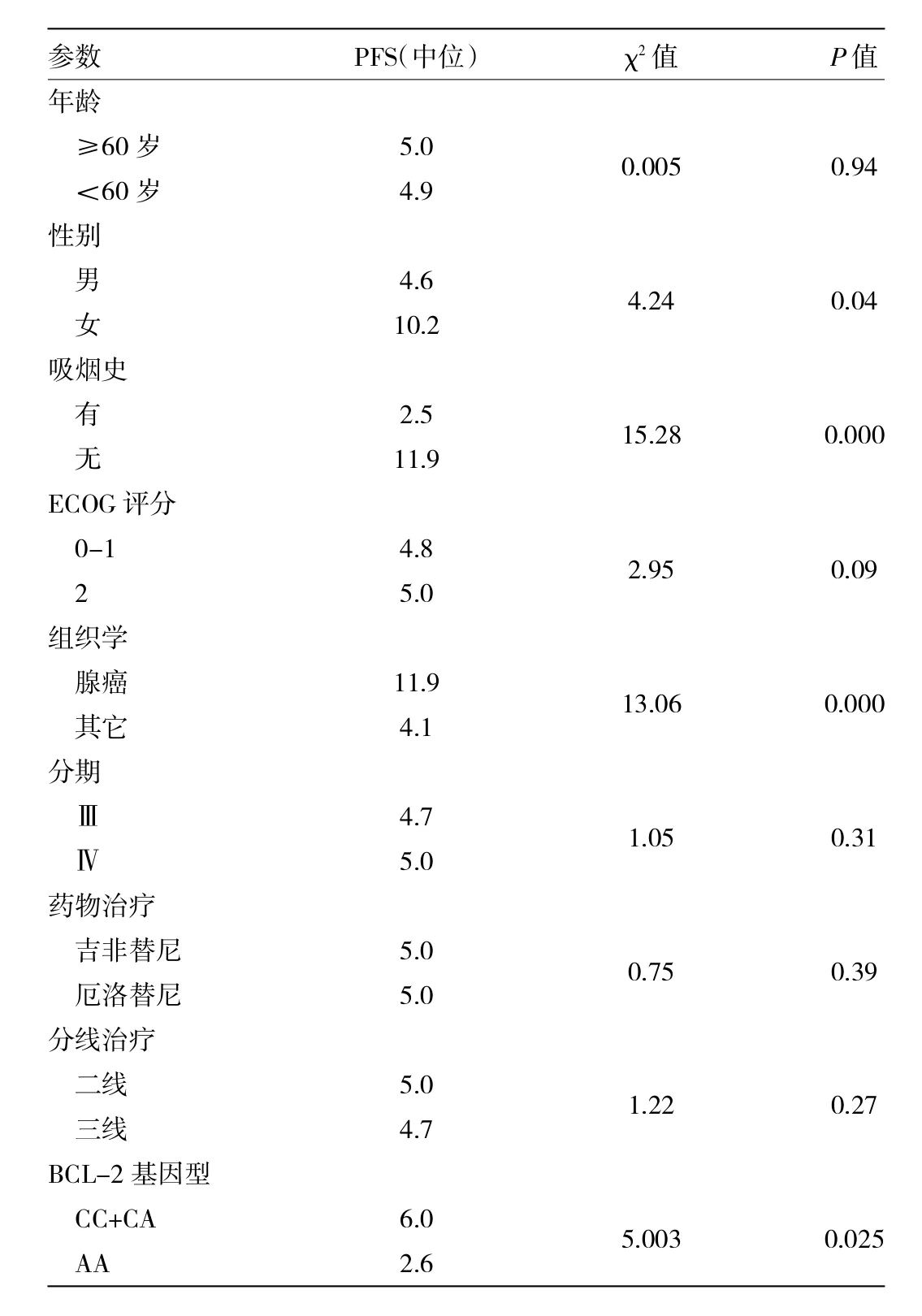
表3 单因素分析无进展生存时间(个月)

表4 多因素分析无进展生存时间(PFS)
多个基础研究发现,TKI诱导肿瘤细胞凋亡可能是其重要的作用机制之一,有研究发现不论吉非替尼还是厄洛替尼都可在肿瘤细胞内通过月cl-2/月cl-xL复合体来调节下游的IP3R3蛋白导致肿瘤细胞产生凋亡抵抗[14],敲除月CL-2基因可以增加肿瘤细胞对TKI的敏感性[7],因而,月CL-2基因可能通过抗凋亡作用影响TKI的治疗疗效。
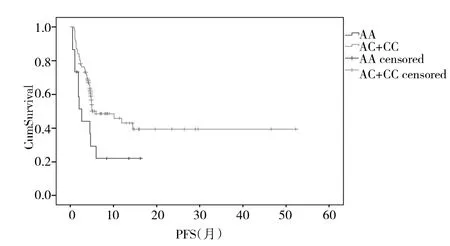
图2 单因素分析PFS与BCL-2基因多态性的关系(BCL-2基因型为AA型患者,生存率显著低于CC+CA,中位PFS为2.6个月vs 6.0个月,P=0.025。)
本研究共116例患者,其中月CL-2基因AA15例,ORR为26.7%,但DCR为40%;CC型52例,CA型49例,ORR分别为30.8%和28.6%,而DCR分别为76.9%和73.5%。在DCR上,AA型对比月CL-2的其它基因型更低,提示预后差,(DCR 40%vs75.2%,χ2=7.83,P= 0.005),女性、不吸烟、腺癌患者是TKI治疗的优势人群。单因素分析中位PFS,女性长于男性(10.2个月vs 4.6个月,χ2=4.24,P=0.04);不吸烟者长于有吸烟史者(11.9个月vs 2.5个月,χ2=15.28,P=0.000);病理类型为腺癌长于其他类型(11.9个月 vs 4.1个月,χ2=13.06,P= 0.000),差异均有统计学意义。研究还发现月CL-2基因型为AA型者预后差,中位PFS短于其它基因型的患者(2.6个月vs 6.0个月,χ2=5.003,P=0.025)。多因素分析结果显示月CL-2基因多态性为PFS的独立预后因素(P=0.049)。因此,本研究结果进一步从临床中证实了月CL-2基因多态性能够作为预测EGFR基因突变未明NSCLC患者TKI治疗的疗效的指标之一。在EGFR基因突变未明的中国患者,月CL-2基因型为AA占比为12.9%,因不同人群和不同种族可能会存在基因突变频率的差异。我们推测月CL-2基因型为AA的患者,由于影响了TKI诱导细胞凋亡通路,导致近期疗效欠佳,具体的机制值得进一步研究。本研究还发现不同月CL-2基因型患者间的近期有效率并无统计学意义。
本研究为回顾性研究,且样本量有限,有待后续更深入研究及期待前瞻性多中心的大型临床研究为肺癌的治疗提供更高级别的循证医学证据。
[1]Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J].N Engl J Med,2010,362(25):2380-8.
[2]Hirsch F R,Varella-Garcia M,Bunn P A Jr,et al.Molecular predictors of outcome with gefitinib in a phase III placebo-controlled study in advanced non-small-cell lung cancer[J].J Clin Oncol, 2006,24(31):5034-42.
[3]Shepherd F A,Rodrigues P J,Ciuleanu T,et al.Erlotinib in previously treated non-small-cell lung cancer[J].N Engl J Med,2005, 353(2):123-32.
[4]Ciuleanu T,Stelmakh L,Cicenas S,et al.Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced,non-small-cell lung cancer with poor prognosis (TITAN):a randomised multicentre,open-label,phase 3 study[J].Lancet Oncol,2012,13(3):300-8.
[5]Kim E S,Hirsh V,Mok T,et al.Gefitinib versus docetaxel in previously treated non-small-cell lung cancer(INTEREST):a randomised phase III trial[J].Lancet,2008,372(9652):1809-1810.
[6]Chang C Y,Shen C C,Su H L,et al.Gefitinib induces apoptosis in human glioma cells by targeting Bad phosphorylation[J].J Neurooncol,2011,105(3):507-522.
[7]Zou M,Xia S,Zhuang L,et al.Knockdown of the Bcl-2 gene increases sensitivity to EGFR tyrosine kinase inhibitors in the H1975 lung cancer cell line harboring T790M mutation[J].Int J Oncol, 2013,42(6):2094-2102.
[8]Eisenhauer E A,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[9]Zhou C,Wu Y L,Chen G,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL,CTONG-0802):a multicentre,open-label,randomised,phase 3 study[J].Lancet Oncol,2011,12(8):735-742.
[10]Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3 trial[J].Lancet Oncol,2010,11(2):121-128.
[11]Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J].N Engl J Med,2010,362(25):2380-2388.
[12]Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC):a multicentre,open-label,randomised phase 3 trial [J].Lancet Oncol,2012,13(3):239-246.
[13]Engelman J A,Janne P A.Factors predicting response to EGFR tyrosine kinase inhibitors[J].Semin Respir Crit Care Med,2005, 26(3):314-322.
[14]Zannetti A,Iommelli F,Fonti R,et al.Gefitinib induction of in vivo detectable signals by Bcl-2/Bcl-xL modulation of inositol trisphosphate receptor type 3[J].Clin Cancer Res,2008,14(16): 5209-5219.
Association between BCL-2(-938C>A)polymorphism and therapeutic efficacy of tyrosine kinase inhibitor in pretreated patients with advanced non-small cell lung cancer
Objective To investigate the association between BCL-2 gene polymorphism and therapeutic efficacy of tyrosine kinase inhibitor(TKI)in pretreated patients with advanced non-small cell lung cancer(NCSLC).MethodsA total of 116 patients with advanced NSCLC were recruited from Zhejiang Cancer Hospital,all of whom were treated with gefitinib or erlotinib after failure to chemotherapy.BCL-2 gene polymorphism of peripheral blood lymphocytes was detected with polymerase chain reaction(PCR).Statistical analysis was performed by SPSS version 13.0.ResultsThe overall response rate was 28.9%.No significant association was found between BCL-2(-938C>A)polymorphism and the objective response rate.The disease control rate of patients with BCL-2 AA genotype was lower than that of patients with genotype CC or CA(40%vs 75.2%,P=0.005).Univariate analysis identified gender,smoking history,histology and BCL-2(-938C>A)polymorphism as predictive markers of progress free survival(PFS)(P=0.04,P=0.000,P=0.000 and P=0.05).Multivariate analysis demonstrated that BCL-2(-938C>A)polymorphism was correlated independently with PFS(P=0.049).ConclusionOur data suggest that BCL-2(-938C>A)AA genotype may be a predictive marker for poor DCR and PFS in advanced NSCLC patients treated with tyrosine kinase inhibitor.
BCL-2 Gene Polymorphism Non-Small Cell Lung Cancer Tyrosine Kinase Inhibitor


2013-11-01)
(本文编辑:田云鹏)
浙江省自然基金(LY13H160024);卫生部医药卫生科技发展研究中心课题(W2012FZ134);卫生部科研基金(201232200);吴阶平基金资助项目(320.6799.1106);浙江省科技厅公益技术研究社会发展项目(2012C23081);浙江省医药卫生科学研究基金(2012B032)
310022 浙江省肿瘤医院、浙江省胸部肿瘤诊治技术研究重点实验室(洪卫、余新民、毛伟敏、张沂平);温州医科大学附属第一医院肿瘤内科(林宝钗);浙江中医药大学第二临床医学院内科学专业(张贝贝);浙江大学医学院附属第二医院呼吸内科(王凯)
张沂平,E-mail:hwya192@163.com
