灯盏花素对 MPP+诱导的 PC12 细胞凋亡的保护作用
2014-04-12肖吉元程月芳李建雄白银亮
肖吉元, 程月芳, 李建雄, 白银亮*
(1.兰州大学第二医院药学部, 甘肃 兰州 730030;2.河南省肿瘤医院药学部, 河南 郑州 450000;3.兰州大学第二医院神经内科, 甘肃 兰州 730030)
[药 理]
灯盏花素对 MPP+诱导的 PC12 细胞凋亡的保护作用
肖吉元1, 程月芳2, 李建雄3, 白银亮1*
(1.兰州大学第二医院药学部, 甘肃 兰州 730030;2.河南省肿瘤医院药学部, 河南 郑州 450000;3.兰州大学第二医院神经内科, 甘肃 兰州 730030)
目的 观察灯盏花素对 MPP+诱导的 PC12 细胞凋亡的保护作用, 并探讨其作用机制。 方法 采用 MTT法检测细胞相对存活率, 流式细胞术检测凋亡率,DCFH-DA法检测细胞内活性氧水平; Rhodamine123 染色法检测线粒体膜电位 水 平; Western blot法 检 测 胞 浆 Cyt-C的 表 达; ELISA法 检 测 caspase-3 和 caspase-9 酶 活 性 。 结 果 250 μmol/L MPP+处理 PC12 细胞, 细胞存活率显著降低, 并明显诱导细胞产生凋亡。 而经灯盏花素 (12.5、 25、 50 μg/L) 预处理, 有效抑制 MPP+诱导的细胞调亡, 明显增加 PC12 细胞存活率, 同时使细胞活性氧的增加和线粒体膜电位的降低;并明显 抑 制胞浆 Cyt-C的 释 放 和 caspase-3 和 caspase-9 的 高 表 达 。 结 论 灯 盏 花 素 预 处 理 能 明 显 提 高 MPP+诱 导 的PC12 细胞损伤的细胞存活率, 其机制可能与抑制细胞线粒体凋亡途径有关。
灯盏花素; MPP+; PC12 细胞; 凋亡; 线粒体
帕金森病是一种临床常见的中枢神经系统退行性疾病,其病理变化主要表现为黑质纹状体系统多巴胺能神经元的丢失[1]。 众多研究表明, 多巴胺能神经元的丢失与细胞凋亡有关,尤其认为线粒体功能紊乱和氧化应激在帕金森病的发病机制中起着关键作用[2-3]。 因 此, 保 护 神 经 元 的 凋 亡 对 帕 金 森病的治疗至关重要。
灯盏花素 (scutellarin) 是从菊科植物短葶飞蓬中提取的黄酮类化合物,具有明显的扩张脑血管和保护脑缺血作用[4], 其 注 射 液 已 广 泛 用 于缺血性心脑血管疾病的治疗。近年来研究显示灯盏花素对血管内皮细胞和皮质神经元凋亡性损伤具有 明 显 的 保 护 作 用[5-6], 但 目 前 对 多 巴 胺 能 神 经元作用的研究很少。 本实验拟以 MPP+诱导 PC12损伤建立体外帕金森病模型,观察灯盏花素对MPP+诱导的 PC12 细胞凋亡的影响并对其机制进行初步研究。
1 材料与方法
1.1 细胞株 大鼠嗜铬细胞瘤细胞株 (PC12 细胞)购自中科院上海细胞库。
1.3 仪 器 Accuri C6 流 式 细 胞 仪 (美 国 BD公司); 全 波 长 Multiskan Spectrum 酶 标 仪 ( 美 国Thermo公司)。
1.4 方法
1.4.1 细 胞 培养及分组 用含 有 100 U/mL青 霉素和 100 μg/mL链霉素、 10%胎牛血清和 5%马血清的 DMEM培养基于 37 ℃、 5%CO2条件下培养PC12 细胞。 隔天换液, 待细胞至 80%融合时, 用0.25%胰蛋白酶溶液消化传代, 待细胞进入对数生长期时进行实验。实验设空白对照组、模型组和灯盏花素预处理组。各组处理如下,模型组:根据文献方法[7]加 入 250 μmol/L的 MPP+处 理 细 胞, 建立帕金森病细胞模型;灯盏花素预处理组:根据文献 [6] 选用灯盏花素 12.5、 25、 50 μg/L预处理细胞 24 h 后 再 加 入 250 μmol/L MPP+; 空 白 对 照组则只加等体积培养基。每组设3个复孔,所有试验均重复4次。
1.4.2 MTT法检测细胞存活率 将 PC12 细胞以1 ×104个/孔 接 种 于 培 养 板 中 培 养 24 h 后, 按“1.4.1” 项 所 述 方 法 分 组 处 理, 药 物 孵 育 24 h,每孔加入 MTT(质量 浓 度 为 5 g/L)20 μL, 继续孵育4 h, 弃上清液, 每孔加入二甲基亚砜 (DMSO)100 μL振荡数次, 采 用全自 动酶标仪于 570 nm处测定各孔的吸光度值并计算相对细胞存活率。
1.4.3 流式细胞术检测细胞凋亡 将 PC12 细胞以 1 ×105个/孔接 种 于 培 养 板 中 培 养 24 h 后 分 别按 “1.4.1”项所述方法分组处理, 药物孵育24 h,收集细胞, 用经预冷的 PBS 洗 2 次, 按照 AnnexineV-FITC/PI试剂盒说明进行染色操作, 采用流式细胞仪检测并分析细胞凋亡率。
1.4.4 荧 光 探 针 DCFH-DA检 测 ROS 水 平 将PC12 细胞 以 1 ×105个/孔 接 种于 培 养 板中 培 养24 h后分别按 “1.4.1” 项所述方法分组处理, 药物孵育 24 h 后, 离 心 收 集 细 胞,PBS 洗 涤 1 次,加入经培养基稀释成 10 μmol/L的 DCFH-DA溶液1 mL 37 ℃ 避 光 孵 育 20 min。 收集 细 胞, 使 用 PBS洗3次,重悬细胞,采用流式细胞仪检测其荧光强度值。
1.4.5 Rhodamine123 染色法检测细胞线粒体膜电位 同 “1.4.4” 项所述方法处理细胞后, 加入10 μmol/L Rhodamine123 染液 1 m L 37 ℃ 避光 孵 育30 min。 收集细胞, 使用 PBS 洗涤细胞 3 次, 重悬细胞,利用流式细胞仪检测其荧光强度值。
1.4.6 Western blot法检测 Cyt-C的表达 分别收集各 组 细 胞, 加 入 含 有 PMSF的 RIPA 裂 解 液160 μL, 冰浴 30 min, 震 荡 待 充 分 裂 解 后, 离 心60 min(20 000 ×g,4 ℃), 收 集 上 清, 并 用 BCA法检测蛋白浓度, 规定上样量为 40 μg。 Cyt-C抗体稀 释 浓 度 均 为 1 ∶300, β-actin 抗 体 稀 释 浓 度为1 ∶4 000。
教育背景:福州,育英学校,1910-1912年上海圣玛利医院,1912-1916年芝加哥培训学校,1918年1月至1920年10月
1.4.7 ELISA法检测 caspase-9 和 caspase-3 酶活性分别收 集各组细胞, 冰浴 裂 解 20 min。 离 心 15 min(16 000 ×g,4 ℃), 取上清, 并 测 定 蛋 白 水平。所有操作均按试剂盒说明书进行。具体如下:反应于96 孔板中进行, 取缓冲液 80 μL, 样品 10 μL,Ac-DEVD-pNA(2 mmol/L,caspase-3 底 物 )或 者 Ac-LEHD-pNA(2 mmol/L,caspase-9 底 物) 10 μL, 充分混 匀 后于 37 ℃ 孵育 120 min, 酶 标 仪测定 405 nm波长处吸光度值。
2 结果
2.1 灯盏花素对 MPP+诱导的 PC12 细胞存活率的影响 如 图 1 所 示,250 μmol/L MPP+作 用 24 h后, 细 胞 存 活 率 仅 为 空 白 对 照 组 的 (47.1 ± 5.2)%, 与空白对照组相比, 模型组细胞存活率呈显著性下降 (P<0.001)。 灯盏花素预处理能剂量依赖地抑制 MPP+诱导的 PC12 细胞存活率的降低 (P<0.001)。
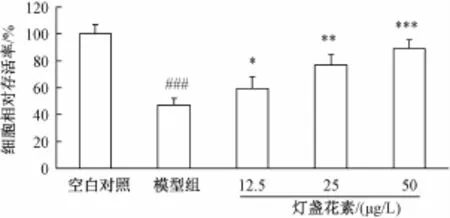
图 1 灯盏花素对 MPP+诱导 的 PC12 细 胞 存 活 率 的 影 响(, n=4)Fig.1 Effect of scutellarin on MPP+-induced cell viability in PC12 cells(, n=4)
2.2 灯盏花素对 MPP+诱导的 PC12 细胞凋亡率的影响 250 μmol/LMPP+作用24 h 后细胞凋亡率为(33.1 ±4.9)%, 空 白 对 照 组 凋 亡 率 为 (2.3 ± 0.4)%, 与空白对照组比较, 模型组细胞凋亡率呈显 著 性 增 加 (P<0.001)。 而 经 灯 盏 花 素(12.5、 25、50 μg/L) 预处理 24 h 后, 细 胞 凋 亡率则明显降低 (P<0.01)(见表1)。
表 1 灯盏花素对 MPP+诱导 的 PC12 细 胞 凋 亡 率 的 影 响(, n=4)Tab.1 Effect of scutellarin on the percentage of apoptosis induced by MPP+in PC12 cells(, n=4)

表 1 灯盏花素对 MPP+诱导 的 PC12 细 胞 凋 亡 率 的 影 响(, n=4)Tab.1 Effect of scutellarin on the percentage of apoptosis induced by MPP+in PC12 cells(, n=4)
注: 与空白对照组比较,###P<0.001; 与模型组比较,*P<0.05,**P<0.01
组 别 剂 量 /( μg.L-1) 凋 亡 率 /% 2.3 ±0.4模型组 33.1 ±4.9###灯盏花素 12.5 24.1 ±5.3*灯盏花素 25 16.1 ±4.6*灯盏花素 50 7.5 ±1.3空白对照组**
2.3 灯盏花素对 MPP+诱导的 PC12 细胞内 ROS水平的影响 如表2所示,与空白对照组比较,模型组细胞 DCF荧光强度明显升高 (P<0.001),即细胞内 ROS水平明显升高。 灯盏花素预处理则能明显抑制 MPP+诱导的 PC12 细胞内 ROS 水平的升高 (P<0.001)。
表 2 灯盏花素对 MPP+诱导的 PC12 细胞内 ROS水平的影响 (, n=4)Tab.2 Effect of scutellarin on the level of ROS induced by MPP+in PC12 cells(, n=4)

表 2 灯盏花素对 MPP+诱导的 PC12 细胞内 ROS水平的影响 (, n=4)Tab.2 Effect of scutellarin on the level of ROS induced by MPP+in PC12 cells(, n=4)
注: 与空 白 对 照 组 比 较,###P<0.001; 与 模 型 组 比 较,**P<0.01,***P<0.001
荧光强度空白对照组组 别 剂 量 /( μg.L-1) DCF 104.2 ±11.7模型组 198.6 ±20.3###灯盏花素 12.5 168.6 ±18.1**灯盏花素 25 151.7 ±12.3**灯盏花素 50 120.4 ±14.4***
2.4 灯盏花素对 MPP+诱导的 PC12 细胞线粒体膜电位的影响 如表3所示,与空白对照组比较,模型组细 胞 Rhodamine荧 光 强 度 显 著 性 降 低 (P<0.001), 即线粒体膜电位水平明显降低; 同时,绿色荧光强度明显增加, 绿色/红色荧光比值由空白对照组的 (0.8 ±0.2) 增加为 (5.3 ±1.7), 呈明显的统计学差异 (P<0.001)。 与模型组比较,灯盏花素预处理能够抑制 MPP+诱导的 PC12 细胞线粒体膜电位的降低 (P<0.001)。
表 3 灯盏花素对 MPP+诱导的 PC12 细胞线粒体膜电位的影响 (, n=4)Tab.3 Effect of scutellarin on the level of m itochrond ia transmembrane potential induced by MPP+in PC12 cells(, n=4)

表 3 灯盏花素对 MPP+诱导的 PC12 细胞线粒体膜电位的影响 (, n=4)Tab.3 Effect of scutellarin on the level of m itochrond ia transmembrane potential induced by MPP+in PC12 cells(, n=4)
注: 与空白对照组比较,###P<0.001; 与模型组比较,*P<0.05,**P<0.01,***P<0.001
荧光比值空白对照组组 别 剂量/ (μg.L-1) Rhodamine荧光强度绿色/红色1 963.2 ±112.3 0.8 ±0.2模型组 979.1 ±88.6### 5.3 ±1.7###灯盏花素少剂量组 12.5 1 201.4 ±265.7** 3.8 ±1.1*灯盏花素中剂量组 25 1 573.2 ±189.5** 2.5 ±0.9**灯盏花素高剂量组 50 1 795.6 ±201.8*** 1.4 ±0.3***
2.5 灯盏花素对 MPP+诱导的 PC12 细胞胞浆 Cyt-C水平的影响 Western blot结果显示,MPP+能明显诱导的 PC12 细胞胞浆 Cyt-C的释放, 与空白对照组比较, 模 型 组 细 胞 胞 浆 Cyt-C表 达 明 显 增 加(P<0.001), 灯盏花素 (12.5、 25、 50 μg/L) 预处理呈剂量依赖地抑制 MPP+诱导的 PC12 细胞胞浆 Cyt-C释放的增加 (P<0.01), 结果见图 2。
2.6 灯盏花素对 MPP+诱导的 PC12 细胞 caspase-9和 caspase-3 酶活性的影响 ELISA结果显示, 与空白对照 组比较,250 μmol/L MPP+作用 PC12 细胞 24 h 后,caspase-9 和 caspase-3 酶活性均 显著性升高 (P<0.001,P<0.001), 灯盏花素预处理则能 够 降 MPP+诱 导 的 PC12 细 胞 caspase-9 和caspase-3 酶活性的升高 (P<0.001,P<0.01) (见表4)。
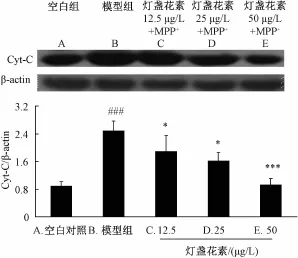
图 2 灯盏花素对 MPP+诱导的 PC12 细 胞胞浆 Cyt-C水平的影响 (, n=4)Fig.2 Effect of scutellarin on the expression of cytosolic Cyt-C induced by MPP+in PC12 cells(, n=4)
表 4 灯 盏 花 素 对 M PP+诱 导 的 PC12 细 胞 caspase-9 和caspase-3 酶活性的影响 (, n=4)Tab.4 E ffects of scutellarin on the activity of caspase-9 and caspase-3 induced by M PP+in PC12 cells(, n=4)
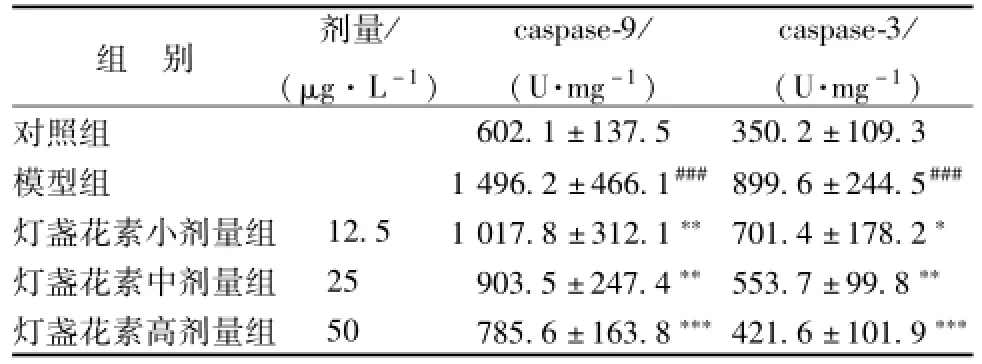
表 4 灯 盏 花 素 对 M PP+诱 导 的 PC12 细 胞 caspase-9 和caspase-3 酶活性的影响 (, n=4)Tab.4 E ffects of scutellarin on the activity of caspase-9 and caspase-3 induced by M PP+in PC12 cells(, n=4)
注: 与空白对照组比较,###P<0.001; 与模型组比较,*P<0.05,**P<0.01,***P<0.001
组 别 剂量/ (μg.L-1) caspase-9/ (U.mg-1) caspase-3/ (U.mg-1)对照组602.1 ±137.5 350.2 ±109.3模型组 1 496.2 ±466.1###899.6 ±244.5###灯盏花素小剂量组 12.5 1 017.8 ±312.1**701.4 ±178.2*灯盏花素中剂量组 25 903.5 ±247.4**553.7 ±99.8**灯盏花素高剂量组 50 785.6 ±163.8***421.6 ±101.9***
3 讨论
PC12 细胞来源于大鼠肾上腺髓质嗜铬细胞瘤,由于其受体及合成的递质均与中脑多巴胺能神经元十分接近,因此常用其代替多巴胺能神经元用于帕金森病细胞模型的建立[8-9]。 MPP+为 MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶) 经过单胺氧化酶 B催化后产生的代谢产物,可直接被多巴胺能神经细胞膜上的单胺转运体摄入胞内并进入线粒体,可特异性抑制线粒体复合物-Ⅰ的活性, 并引起线粒体ATP生成障碍和线粒体膜电位下降, 从而导致线粒体 功 能 损 伤[10-12], 同 时 MPP+诱 导 产 生 大 量 的 ROS, 会进一步损伤线粒体并最终引起细胞死亡[13-15]。 因而 MPP+常作为神经毒素被广泛用于建造帕金森 病 的 体 内 和 体 外 模 型[8-9]。 目 前,MPP+诱导建立的 PC12 损伤模型是目前研究帕金森病的最常用的体外模型。
本研究采用 MPP+诱导 PC12 损伤建立体外帕金森病模型, 观察了灯盏花素对 MPP+诱导的PC12 细 胞 凋 亡 的 影 响。 结 果 显 示 250 μmol/L MPP+处理细胞能明显引起细胞凋亡, 细胞存活率显著下降, 凋亡率呈显著增加, 细胞内 ROS水平明显升高,线粒体膜电位明显降低,这均与文献报道一致[7,12,14-15], 表 明 模 型 建 立 成 功 。同 时, 本 实验发现灯盏花素 (12.5、 25、 50 μg/L) 预处理则能够有效抑制 MPP+诱导的 PC12 凋亡, 抑制线粒体膜电位的降低和 ROS 水平的升高, 对 MPP+诱导的 PC12 损伤表现出明显的保护作用。
线粒体功能紊乱和氧化应激在帕金森病的发病机制中起 着 关 键 作 用[2-3]。 线 粒 体 膜 电 位 的 丧 失 是引起多巴胺能神经元产生凋亡的关键因素之一。本研究结果显示灯盏花素预处理能够有效抑制线粒体膜电位的降低,提示灯盏花素可能直接保护线粒体。活性氧的过度释放也是引起引起多巴胺能神经元损伤的主要因素之一,本研究结果显示灯盏花素预处理能够有效抑制 ROS水平的升高, 这与文献报道一致[5-6]。 因此, 不妨认为灯盏花素抑制 PC12凋亡是其保护线粒体膜电位丧失和抑制 ROS过度释放共同作用的结果。
线粒体凋亡途径被认为是细胞凋亡的主要途径之一[16]。 普遍认为活性氧 自 由 基 等 因 素 诱 导 线 粒体受损后引起线粒体膜电位的降低,引起核膜的破裂 以 及 细 胞 色 素 C等 的 释 放[17-18]; 进 入 胞 浆 的 细胞色素 C可活化 caspase-9 并进一步激活细胞凋亡过程 中 最 关 键 酶 caspase-3 从 而 触 发 凋 亡 级 联 反应[19]。 Western blot结 果 显 示,MPP+能 明 显 诱 导的 PC12 细胞胞浆 Cyt-C的释放, 这与之前报道结果一致[12]。 而灯盏花素预 处 理 呈 剂 量 依 赖 地 抑 制胞浆的 Cyt-C释放; 同时,ELISA结果显示, 灯盏花素预处理对 MPP+诱导的 PC12 细胞 caspase-9 和caspase-3 的活化同样具有抑制作用。 因此, 认为灯盏花素抑制 PC12 凋亡机制与其抑制 Cyt-C的释放和抑制 caspase酶活性有关。
总之, 灯盏花素预处理能够有效抑制 MPP+诱导的 PC12 凋亡, 其可能的机制与灯盏花素保护线粒体膜电位丧失和抑制 ROS 过度释放进而抑制Cyt-C的释放并最终抑制 caspase-9 和 caspase-3 的凋亡级联反应有关。
[ 1 ] Remy P,Doder M,Lees A,et al.Depression in Parkinson's disease:loss of dopamine and noradrenaline innervation in the limbic system[ J].Brain,2005,128(6):1314-1322.
[ 2 ] Büeler H.Impaired mitochondrial dynamics and function in the pathogenesis of Parkinson's disease[ J] .Exper Neurol,2009, 218(2):235-246.
[ 3 ] Yuan H,Zheng JC,Liu P,etal.Pathogenesis of Parkinson's disease:oxidative stress,environmental impact factors and inflammatory processes[ J] .Neurosci Bull,2007,23(2): 125-130.
[4] 雷 婷,王建超,刘光明.灯盏花素在心脑血管疾病中的药理 作 用 研 究 进 展 [ J].医 学 综 述,2009,15(18): 2844-2846.
[5] 叶 立,李建宇,李月鹏,等.灯盏花素对大鼠脑微血管内皮细胞 损 伤 的 保 护 作 用 [J].中 草 药,2011,42(5): 955-955.
[6] 熊 哲,张 丽,李彩莲.灯盏花素对谷氨酸体外诱导大鼠皮质神经元损伤的保护作用[J].中草药,2008,39(6): 893-895.
[ 7 ] 曹 旭, 肖 海 兵, 李 慧, 等.1,5-二 咖 啡 酰 奎 宁 酸 对MPP+所致 PC12 细胞损伤的保护作用[ J].华中科技大学学报: 医学版,2010,39(4):435-438.
[ 8 ] 单悌超, 任玉娇, 于学慧, 等.帕金森病模型研究进展[J].中国老年学杂志,2009,29(9):1171-1174.
[ 9 ] Sun X,Liu J,Crary JF,et al.ATF4 Protects against neuronal death in cellular Parkinson's diseasemodels by maintaining levels of parkin[J] .JNeurosci,2013,33(6):2398-2407.
[10] Chen T,Zhu J,Zhang C,et al.Protective effects of SKF-96365,a non-specific inhibitor of SOCE,against MPP+-induced cytotoxicity in PC12 cells:Potential role of homer1[ J]. PloSOne,2013,8(1):e55601.
[11] 程月发, 朱国旗, 关亚丽, 等.葛根素对 MPP+诱导的 SHSY5Y细胞线粒体途径凋亡的保护作用[J].中国中药杂志,2011,36(9):1222-1226.
[12] 汪跃春.茶多酚对 MPP+诱导的 PC12 细胞损伤的保护作用[D].武汉: 华中科技大学,2008.
[13 ] Ye Q,Zhang X,Huang B,et al.Astaxanthin suppresses MPP+-induced oxidative damage in PC12 Cells through a Sp1/ NR1 signaling pathway[ J] .Marine Drug,2013,11(4): 1019-1034.
[14] 尹蔚兰, 何剑琴, 唐国华, 等.硫化氢对 MPP+诱导 PC12细胞氧化应激损伤的保护作用[J].中南医学科学杂志, 2011,39(1):7-9.
[15] 李晓冰, 陈建宗, 李晓峰, 等.二苯乙烯苷通过抑制氧化应激对 MPP诱导的 PC12 细胞凋亡的保护作用[ J].神经解剖学杂志,2009,25(6):667-671.
[16] Wang C,Youle R J.The role of mitochondria in apoptosis*[J] .Ann Rev Genet,2009,43:95-118.
[17] CaroppiP,Sinibaldi F,Fiorucci L,etal.Apoptosis and human diseases:mitochondrion damage and lethal role of released cytochrome C as proapoptotic protein[ J] .Curr Med Chem,2009, 16(31):4058-4065.
[18] 杨 静, 陈赛贞, 王 婷.氧化应激致 PC12 细胞凋亡的信号传导途径的研究进展[J].中国药理学与毒理学杂志, 2011,25(1):102-102.
[19 ] Singh M H,Brooke S M,Zemlyak I,et al.Evidence for caspase effects on release of cytochrome c and AIF in amodel of ischemia in corticalneurons[ J] .Neurosci Lett,2010,469(2): 179-183.
Protective effect of scutellarin on MPP+-induced apoptosis of PC12 cells
XIAO Ji-yuan1, CHENG Yue-fang2, LI Jian-xiong3, BAIYin-liang1*
(1.Department of Pharmacy,Lanzhou University Second Hospital,Lanzhou 730030,China; 2.Department of Pharmacy,Henan Cancer Hospital, Zhenzhou 450000,China; 3.Department of Internal Neurology,Lanzhou University Second Hospital,Lanzhou 730030,China)
AIM To investigate the protective effect of scutellarin on MPP+-induced apoptosis of PC12 cells and its related mechanism.METHODS Cell viability and cell apoptotic rate weremeasured by MTT assay and flow cytometry,respectively.The level of reactive oxygen species(ROS)in the cellwas analyzed by fluorometric probe DCFH-DA assay and mitochondria transmembrane potential was tested by Rhodamine123 staining.The expression of cytosolic Cyt-C was analyzed by Western blot.caspase-3 and caspase-9's activities were detected by Enzyme-linked immunosorbent assay.RESULTS Treatmentwith 250 μmol/LMPP+decreased the cell viability and then significantly induced apoptosis in PC12 cells,but pretreatmentwith different concentrations of scutellarin (12.5,25,50 μg/L)increased viability and the ROS level,decreased mitochondria transmembrane potential, halted the release of cytosolic Cyt-C,and enhanced the activity of caspase-3 and caspase-9.CONCLUTION Scutellarin can increase cell viability by preventing MPP+-induced cell apoptosis.Themechanism may be related to the inhibition ofmitochondrial apoptotic pathway.
scutellarin; MPP+; PC12; apoptosis; mitochondria
R966
:A
:1001-1528(2014)06-1113-05
10.3969/j.issn.1001-1528.2014.06.001
2013-11-17
中央高校基本科研业务费专项资金 (lzujbky-2013-216)
肖吉元 (1972—), 男, 副主任中药师, 研究方向: 中药药理学。 E-mail:lzuxjy@163.com
*通信作者: 白银亮, 男, 医学硕士, 研究方向: 药理学。 Tel:(0931)8942491,E-mail:lzubyl@163.com
