醇类保护剂对猪软骨低温膨胀过程的作用
2014-04-09余华星李代禧
余华星 李代禧 胥 义 刘 立 翟 振 张 燕
(上海理工大学医疗器械与食品学院 上海 200093)
在对关节软骨进行低温保存时,常常会观察到低温断裂现象[1-3],然而其生物力学性能的低温损伤机理至今仍不甚明确[4]。从现有文献来看,有关细胞低温保存冻结损伤影响机制的研究,主要集中在悬浮细胞领域,研究方法比较成熟。对于悬浮细胞,由于在冰晶生成时,细胞可以自由移动[5],胞外冰晶对细胞的损伤程度比对粘附细胞的损伤小,此时胞内冰对细胞的损伤起主导作用。然而黏附细胞(包括组织内的细胞)是固定的,生成的冰晶与其刚性接触产生挤压、剪切作用较大,其受到胞外冰机械损伤增加,甚至更为严重[6]。同时有研究发现,细胞外基质主导了软骨细胞的生物力学特性,软骨细胞的外基质生物力学特性的改变可能会改变软骨细胞的应力,应变环境[7]。关于胞外冰晶对黏附细胞的研究目前还较少,所以胞外冰晶对细胞机械损伤的检测和研究对解释组织细胞的低温损伤机理是非常必要的。文献[4]利用热机械分析仪研究了猪软骨在冻结过程的热膨胀行为和热应变值,认为关节软骨至今不能成功保存的重要原因是在低温冻结时,关节软骨中存在非均匀热膨胀现象,从而导致关节软骨内部产生热应力,并损伤关节软骨中的胶原纤维等成分。同时提出了在一定降温速率下,添加适宜的冷冻保护剂有利于保护关节软骨基质的力学性能。
本文采用降温梯度为1 ℃/min、3 ℃/min、5 ℃/min的慢速降温方式,通过分别添加四种醇类低温保护剂,系统考察软骨低温保存过程中细胞外发生的生物力学性能变化,研究降温速率和低温保护剂对软骨在冻结过程热膨胀行为的影响情况,希望为工程化软骨组织的低温保存提供有效的依据。
1 材料与方法
1.1 实验材料
选取上海本地成年猪身上的整根有两瓣半月板覆盖的白色软骨的猪大骨。用手术剪将半月板剪去,选取受力负荷相对集中的中央软骨,用专用采样工具制备直径为5 mm厚度为3~4 mm的软骨测试样品。本实验为了便于讨论,采用摩尔浓度标定保护剂,从而减小了分子量差异对实验结果的影响。因为高浓度保护剂的添加存在玻璃化现象,并且会对关节软骨细胞以及其他活性物质造成不可逆损伤[4],实验采用较小摩尔浓度(1.5 mol/L、4.5 mol/L)的乙醇、乙二醇、1,2-丙二醇、甘油(四种试剂均为分析纯,购置于上海国药集团化学试剂有限公司),分别进行2.5 h的充分渗透并放在4 ℃冰箱贮存以备实验时取用。
1.2 实验方法
使用热机械分析仪 (TMA Q400, TA, USA) 作为测试仪器(压缩模式)。测试方法如下:将样品置于压缩夹具中心位置;加载0.005N的微小载荷,读取此时样品的厚度为初始厚度。针对黏附成骨细胞的前期实验结果表明[8-10],在慢速降温时没有胞内冰的生成,即胞外水分冻结膨胀所致的热应力是软骨组织内部损伤的主要因素。因此,本实验选择分别以1 ℃/min、3 ℃/min、5 ℃/min的降温速率从0 ℃开始程序降温至-60 ℃,并记录整个过程样品的热应变曲线。通过最终分析该热应变曲线,研究关节软骨冻结过程的低温损伤机理和低温保护剂对关节软骨的低温保护机理。
2 实验结果与分析
2.1 降温速率对冻结过程热膨胀的影响
2.1.1降温速率对添加乙醇、乙二醇的猪软骨热应变的影响
添加乙醇和乙二醇时,在不同降温速率和浓度作用下,猪软骨的低温热流曲线如图1所示,其中曲线相对应的相变温度、猪软骨最大热应变变化值见表1。
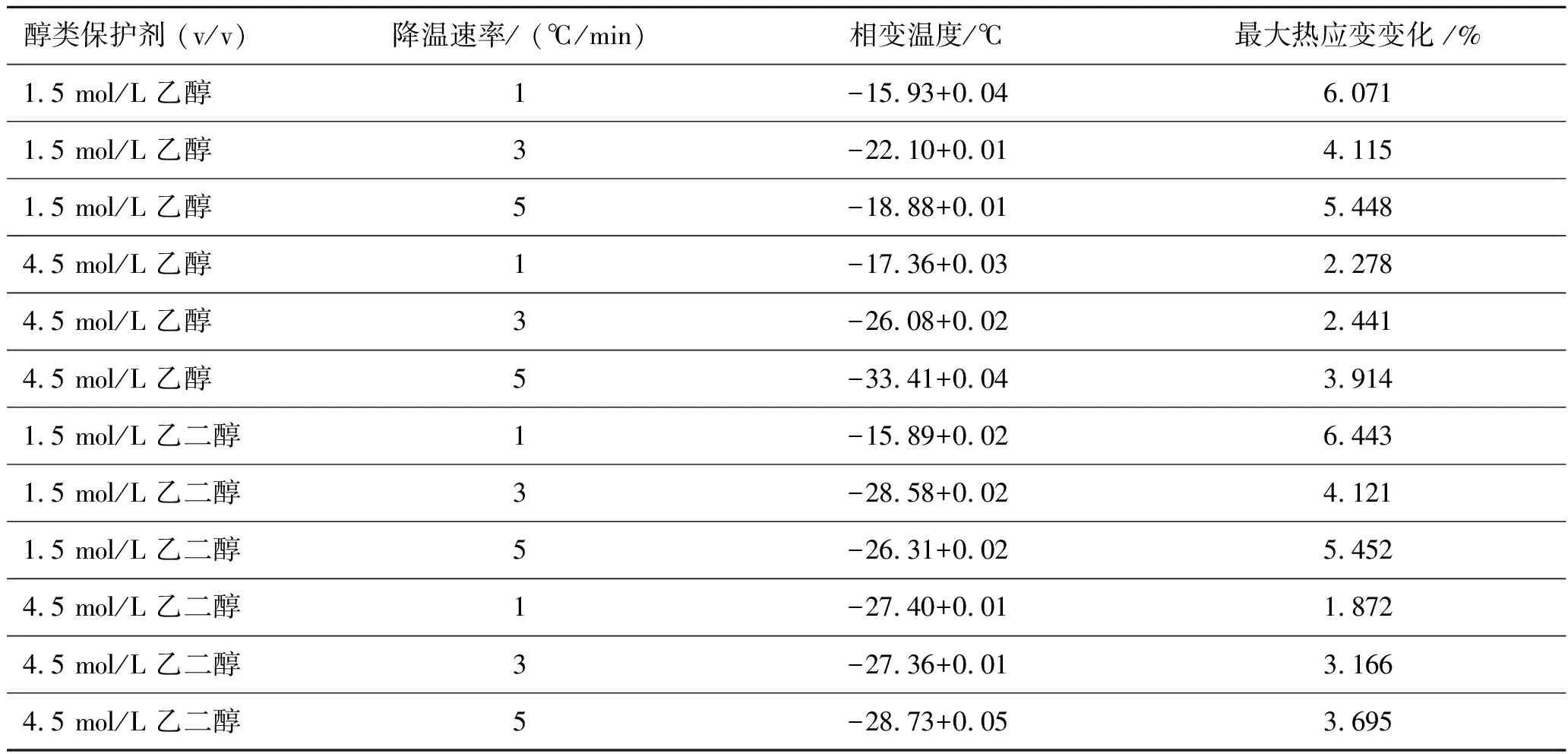
表1 添加乙醇和乙二醇时不同降温速率和浓度的相变温度、猪软骨最大热应变变化值
图1表明,添加乙醇和乙二醇保护剂时,降温速率对关节软骨冻结过程的热膨胀有非常显著的影响。结合表1及图1(a)、(c)可以发现,当添加乙醇、乙二醇浓度为1.5 mol/L时,样品在三种降温速率下,3 ℃/min时的热应变变化值是最小的。可能是因为在降温过程中, 细胞外局部结冰,细胞内未结冰处于过冷状态,水分开始渗出细胞,导致细胞外的冰晶不断生长。在浓度为1.5 mol/L时,由于保护剂浓度较低,渗透进入软骨组织的保护剂分子较少,其对水分子的结合作用较弱,所以胞内有大量的自由水可以外渗。当降温速率较快时,胞外水的过冷度高,突然结晶导致膨胀应力来不及释放,然而此时细胞内的水来不及外渗,因此冰晶的生长有限;降温速率较慢时,虽然冰晶的成核率较低,胞外基质对应力具有一定的缓冲作用,然而随着胞内水分不断外渗,冰晶不断生长增大,总体应变变化值依旧较大。因此,当降温速率为3 ℃/min时,存在最佳降温速率,胞内水外渗不致过多,细胞外冰的生长又不至于过快,胞外蛋白具有一定的缓冲作用,膨胀产生的热应力得以及时释放。
由图1(b)、(d)可以看出,对于添加浓度为4.5 mol/L保护剂的猪软骨,降温速率越快,其热应变变化值越大。此时,保护剂浓度相对较高,渗透进入软骨细胞的保护剂分子较多,其对水分子的结合作用较强,胞内水的外渗作用对于整个组织的膨胀效应贡献已经不大,胞外自身水膨胀应力对于整个组织的膨胀起主导作用。软骨胞外基质中存在大量的胶原和蛋白多糖,对冰晶的膨胀效应具有缓冲效应。随着降温速度的增加,胞外基质来不及调整形态,导致由于膨胀所产生的应力来不及释放。
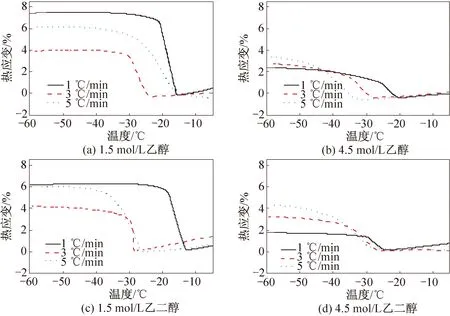
图1 乙醇和乙二醇保护下的猪软骨的热应变曲线
2.1.2降温速率对添加乙1,2-丙二醇和甘油的猪软骨热应变的影响
添加1,2-丙醇和甘油时,不同降温速率和浓度作用下,猪软骨的低温热应变曲线如图2所示,其中曲线相对应的相变温度、猪软骨最大热应变变化值列于表2。
通过图2发现,丙二醇以及甘油在浓度为1.5 mol/L时,应变随温度的变化情况与乙醇及乙二醇相同。然而在浓度为4.5 mol/L时依旧存在最佳降温速度,即3 ℃/min时,猪软骨应变最小。出现这种情况的最可能原因是三碳醇对水的结合性更优,此时软骨热应力的大小主要取决于冰晶自身的形成机制。原因可以用结晶理论来解释:慢速降温的成核率较低,而冰晶生长快,生成少但较大的冰晶;快速降温的成核率高,但冰晶生长慢,因而生成多但较小的冰晶[11]。二者的拮抗作用结果为存在最佳降温速度,使得此时的冰晶形成率最低。
由图1、2可以看出,在冻结相变发生前的热应变首先快速减小,随着降温速率的增大,热收缩幅度越小。原因是在冻结发生前,关节软骨中的水分子虽然受降温的影响而缩短彼此间的距离,在当快速降温时,达到冻结相变点温度的时间短,水分子之间的距离还没有来得及减小到稳定状态,就发生了冻结相变过程,因而冻结发生前的热收缩越小[4];还能发现保护剂浓度为4.5 mol/L时,膨胀产生的热应力要显著小于1.5 mol/L。其主要原因有两个方面:一是高浓度低温保护剂(溶质)占据了本该参与相变的纯水份额较多,二是有一部分水与低温保护剂之间以氢键的形式相联系,成为不冻水(未冻水)。未冻水含量的高低反映了保护剂结合水能力的强弱[12]。
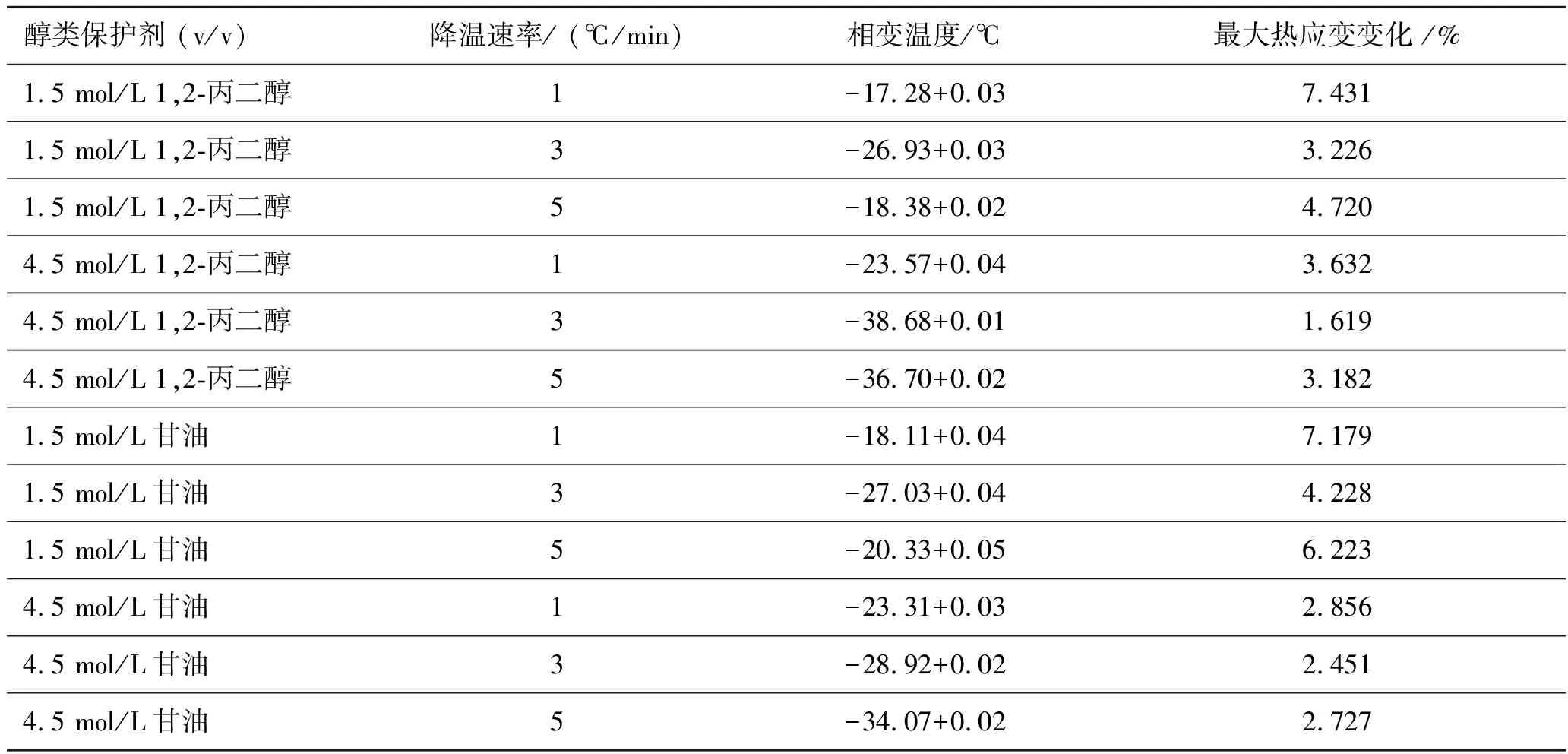
表2 添加1,2-丙醇和甘油时不同降温速率和浓度的相变温度、猪软骨最大热应变变化值
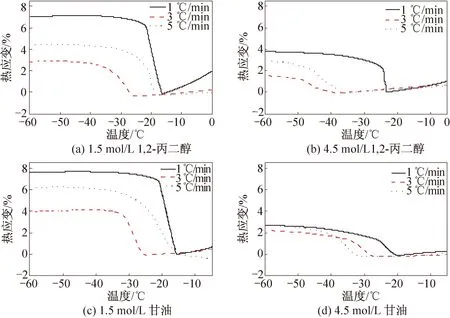
图2 1,2-丙二醇和甘油保护下的猪软骨的热应变曲线
2.2 低温保护剂对冻结膨胀的影响
图3给出了样品经过乙醇、乙二醇、1,2-丙醇、甘油处理后的冻结过程热应变变化情况(降温速率3 ℃/min)。从图中不难发现,与其他三种醇类相比,1,2-丙二醇的保护效果最优。其可能原因是在物质的量浓度相同的情况下,1,2-丙二醇也要强于其他三种醇类,这与胡桐记等[13]使用DSC研究不同醇类水和性质的研究结果一致。Fahy等[14]认为诸多低温保护剂结合水能力的高低,除了部分与本身所含有的羟基个数有关,还与是否含有甲基以及甲基的个数有关,这就是所谓的“甲基化效应”。甲基的存在降低了羟基之间键合的可能性,切断了溶质之间羟基链的键合,增大了与水分子之间键合的可能性[15]。由于甘油分子中有较长的羟基链,大大增加了保护剂自身或者保护剂之间的键合的概率,从而弱化了对水束缚的能力,造成了结合水能力弱于1,2-丙二醇,同样的道理适用于乙二醇和甘油的比较。在1,2-丙二醇和乙二醇的比较中,1,2-丙二醇的结合水能力也是强于乙二醇,两者的分子中虽然都只有两个羟基基团,但是1, 2-丙二醇分子中多了一个碳原子,减少了保护剂之间的键合的概率,使得1,2-丙二醇自身键合的概率降低,与水键合的可能性也就增加了。
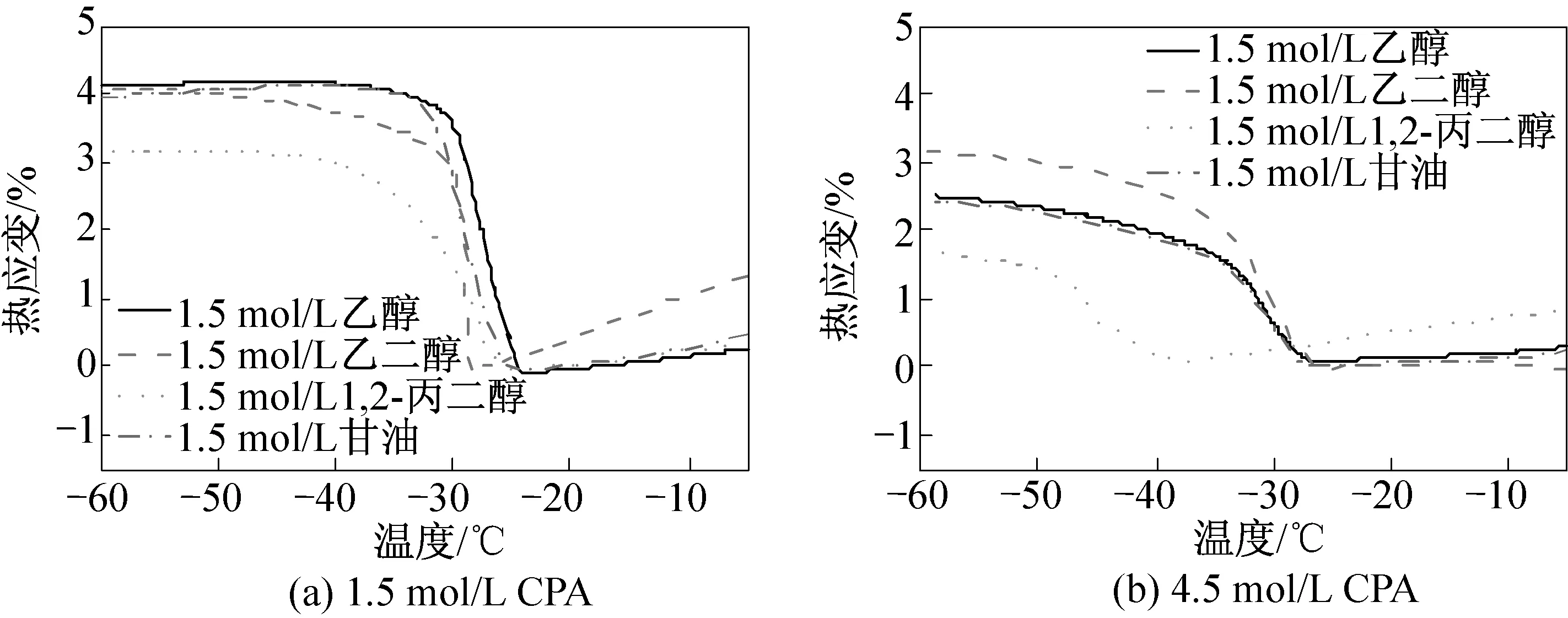
图3 3 ℃/min的降温速率下四种保护剂不同浓度下的猪软骨的热应变曲线
3 结论
1) 关节软骨低温冻结保存时,细胞外存在热膨胀现象,导致关节软骨内部热应力的产生,并损伤关节软骨中的胶原纤维等成分。影响该热应力大小的因素有很多,如降温速率,添加保护剂的浓度和种类。
2) 降温速率对胞外膨胀所产生的应力的影响机制复杂:随着速度的增加,未冻水的过冷度增加,成核率较高,保外基质难以起到缓冲效果,导致膨胀热应力较大;然而此时,胞内水的外渗作用弱,未冻水含量较少,同时冰晶的生长速率也较低。一定浓度冷冻保护剂的添加,可以影响降温过程的主导因素,进而找到最佳降温速率。
3) 由于甲基对于关节软骨基质的力学性能保护要好于羟基,与乙醇、乙二醇、甘油相比,1,2-丙二醇更适合保护关节软骨。
[1] 胥义,周国燕,高才.兔主动脉冻结膨胀行为及其影响因素的研究[J].工程热物理学报,2005,26(6):1013-1015.(Xu Yi,Zhou Guoyan,Gao Cai,et al. Study on the Thermal Expansion Behaviors of Rabbit Artery during Freezing and Affecting Factors [J].Journal of Engineering Thermophysics,2005,26(6):1013-1015.)
[2] Shi X L,Dalta A K. Thermal stresses from large volumetric expansion during freezing of biomaterials [J]. Transaction of the ASME,1998,120:720-726.
[3] Xu Yi, Hua Z Z, Sun Dawen, et al. Effects of freezing rates and dimethyl sulfoxide concentrations on thermal expansion of rabbit aorta during freezing phase change as measured by thermo mechanical analysis [J]. Journal of Biomechanics,2007,40:3201-3206.
[4] 胥义,孙慧君,吕娅.关节软骨冻结过程中的热膨胀行为及其影响因素研究[J].中国生物医学工程学报,2012,31(5):742-748. (Xu Yi,Sun Huijun,Lü Ya.Thermal Expansion Behaviors of Articular Cartilage during Freezing and Affecting Factors [J].Chinese Journal of Biomedical Engineering,2012,31(5):742-748.)
[5] Ishiguro H,Rubinsky B.Mechanical interactins between ice crystals and red blood cells during directional solidification [J]. Cryobiology,1994,31:483-500.
[6] Ishine N,Rubinsky B,Lee C Y. A histoligical analysis of liver injury in freezing storage [J]. Cryobiology,1999,39:271-277.
[7] Mow V C,Ateshian G A,Spilker R L.Biomechanics of diarthrodial joints:a review of twenty years of progress [J].J Biomech Eng 1993,115(4B):460-467.
[8] 刘宝林,McGrath John,华泽钊.低温保存过程中老鼠成骨细胞胞内冰的研究[J]. 制冷学报,2007,28(2):22-25.(Liu Baolin,John M G,Hua Zezhao. The study on the intracellular ice formation of osteoblast cells in cryopreservation [J]. Journal of Refrigeration,2007,28(2):22-25.)
[9] Liu Baolin,McGrath J. Freezing osteoblast cells attached to hydroxyapatite discs and glass coverslips: Mechanisms of damage [J]. Science in China Series E: Technological Sciences,2007,50(1):1-9.
[10] Liu Baolin,McGrath J. Effects of two-step freezing on the ultra-structural components of murine osteoblast cultures [J]. Cryo-Letters,2006,27(6):369-374.
[11] 华泽钊,任禾盛.低温生物医学技术[M].北京:科学出版社,1994.
[12] 高才,王文华,胡桐记,等.不同结晶度的乙二醇及其水溶液玻璃化转变与焓松弛[J].物理化学学报,2004,20 (7):701-707.(Gao Cai,Wang Wenhua,Hu Tongji,et al. Glass Transition and Enthalpy Relaxation Behavior of Ethylene Glycol and Its Aqueous Solution with Different Crystallinity[J]. Physico-Chimica Sinica,2004,20 (7):701-707.)
[13] 胡桐记,高才,周国燕,等.常用醇类低温保护剂水溶液的DSC研究[J].低温工程,2005(1):38-43.(Hu Tongji,Gao Cai,Zhou Guoyan,et al. Thermal property of polyalcohols aqueous solution used as cryoprotectants studied by DSC[J]. Cryogenics,2005(1):38-43.)
[14] Fahy G M,Levy D I. Some emerging principle underlying the physical property, biologicalaction and utility of vitrification solution. [J].Cryobiology,1987,24:196-214.
[15] DeVisser C,Somsen G. Molar heat capacities of binary mixtures of water and some amides a 298.15K.Z.Phys. Chem[J].NeueFolge,1974,92:159-170.
