昼夜节律生理机制最新国际研究动态
2014-04-09郝洛西
崔 哲,郝洛西,林 怡
(同济大学建筑与城市规划学院,上海 200092)
引言
关于健康光照的问题大多会涉及到昼夜节律生理机制,对照明设计与应用来讲也是前沿和热点方向。由于该部分内容涉及多个学科,实验手段具有多样性和复杂性,研读国内外的文献和实验方法,对我们未来要开展的工作,具有一定的指导意义。
生物钟(Biological Clock)控制生物各种生理活动的变化周期。视交叉上核(以下简称SCN)接收外界光信号并向人体发出同步指令,是生物钟的中枢组织。人类的睡眠/觉醒周期约为24小时,这个周期被称之为昼夜节律(Circadian Rhythm)[注]。光是影响昼夜节律的主要因素。相对平衡的昼夜交替,可以保障人体昼夜节律的持续及稳定。
高纬度地区特有的自然光照环境,无法给生活在此类地区的人群提供相对平衡的昼夜交替周期,导致此类人群昼夜节律的紊乱;此外,随着照明灯具的出现以及电子显示技术的普及,现代城市人群的工作、生活周期与自然昼夜交替周期存在着巨大差异,客观导致此类人群的昼夜节律紊乱。临床医学表明:昼夜节律紊乱容易诱发睡眠障碍、代谢综合症以及癌症的患病机率,并且与抑郁症等精神疾患存在着密切的关系[1]。因此,深入探讨研究昼夜节律的机理,探明它与人类健康之间的关系,既是现代人群健康问题的焦点,也是世界各国科学研究的前沿方向,有着极强的现实意义。
本文将从生物学角度阐述昼夜节律的生理机理;整理归纳国内外此类课题的研究现状,以光对褪黑激素(以下简称MLT)分泌情况的影响为切入点,重点分析、总结光对昼夜节律的作用情况。
1 昼夜节律的生理机制
包括人类在内的哺乳类动物都拥有昼夜节律。现代医学研究证明人体几乎所有的生理机能都存在昼夜节律变化。控制人体昼夜节律的节律振动体存在于SCN。SCN振动体位于下丘脑视交叉之上,与第三脑室相接,是一对神经核,通过视网膜接收视神经脉冲。SCN的每个细胞都有独自的昼夜节律,节律周期不尽相同。例如鼠类的神经细胞昼夜节律分布在22小时至28小时之间[2-3]。神经细胞各自的昼夜节律相互作用,最终输出约为24小时的昼夜节律信号。哺乳动物通过视网膜感知外部昼夜光照环境交替,并调节自身的昼夜节律与之同步。实验表明,恒暗环境会导致鼠类昼夜节律失常[4]。此外,近年研究表明,除SCN之外,末端组织器官也存在昼夜节律振动体,其中一部分振动体并不与光信号进行同步。综上所述,哺乳动物的生物钟系统是一个多层级、多种类的振动体集合[5]。
2 光照刺激对昼夜节律的影响
2.1 非视觉通路的生理机制与MLT分泌的关系
如图1所示[6]:哺乳动物的视网膜除锥状细胞与杆状细胞以外,存在含有黑视素的第三类感光细胞,我们称之为神经节细胞(mRGCs: melanopsin chontaining retinal ganglion cell 或 ipRGC: intrinsically photosensi-tive retinal ganglion cell,以下简称mRGCs)[7-8]。mRGCs独立于锥状细胞和杆状细胞,直接感受环境中的光强信号,并将其转换为神经脉冲[9]。神经脉冲经过视网膜下丘脑通道(RHT),到达SCN。mRGCs同时也接受来自杆状、锥状细胞的光信号[10]。这条神经通路有别于视觉通路(visual formingsystem),因此我们称之为非视觉通路(non-visualformingsystem)。非视觉通路从SCN离开大脑,继而转入颈交感神经节,通过交感神经节的后纤维再次进入大脑,直接作用于松果体。暗环境下松果体细胞的β接收器受到刺激分泌酶,促进MLT合成。MLT分泌量增加,会催生羟色胺,进而促进慢波睡眠(Slow-wave sleep)[11]。因此,MLT的分泌周期很大程度上代表了人体昼夜节律,而MLT分泌状况与光照刺激有极强的相关性。

图1 哺乳动物松果体内褪黑激素分泌情况的神经调节机制(非视觉通路)[6]Fig.1 Non-visual forming system
2.1.1 光照刺激与相位反应
对处于恒暗环境下的被试进行强光照射(数分钟至数小时),被试的昼夜节律相位会发生改变。这种改变叫做“相位反应(phase response)”。相位反应的方向(提前或者退后)及大小取决于光照刺激发生的时刻、光照刺激的强度(照度)以及光照刺激的持续时间。图2[12]表示的是“相位反应曲线(phase response curve)”。横轴为光照刺激的时刻,纵轴为相位反应的大小;光照刺激的时刻用“·”标示。图2中灰色区域表示生物的“主观夜晚”时段(主观夜晚:生物在恒暗环境下表现出“夜晚行为”的时间段)。图2插图A、B、C分别表示生物在自然节律状态下(Free-running rhythm),不同时刻受到单一光照刺激(例如:恒暗状态下的光脉冲刺激)后,昼夜节律相位的移动情况。插图中的斜线表示生物“主观夜晚”的起始时刻。如图2所示:生物在“主观白天”时段(A点)接受光照刺激,不会对其昼夜节律相位产生影响,此时段被称之为“无反应区间(dead zone)”;生物在“主观夜晚”前期(B点)接受光照刺激,会导致其昼夜节律相位推迟;生物在“主观夜晚”后期(C点)接受光照刺激,会导致其昼夜节律相位提前[13];同样的光照刺激对昼夜节律相位作用的大小,随刺激时刻不同而变化[14]。此外,图2中D点是相位推迟作用与提前作用的切换点,被称之为“交叉点(cross-over point)”。当昼夜节律相位推迟(或提前)12小时,交叉点会消失,转化为“回归点(point of no-return)”[15]。总之,人体内因性昼夜节律平均为24.18小时[16],其中20%~30%的被试小于24小时[17]。内因性昼夜节律受外界自然环境周期(特别是光照环境)影响,并与之同步。相位反应越大,表示其昼夜节律可调节范围越大。人体昼夜节律相位反应同时受到清晨及黄昏时段光照刺激的影响,相位反应的大小约等于“提前(清晨光照刺激)”与“推迟(黄昏光照刺激)”的相位反应之和[18]。

图2 相位反应曲线图[12]Fig.2 Phase response curve
2.1.2 光照刺激与MLT分泌的关系
2.1.2.1 “主观夜晚”区间的光照刺激
针对“主观夜晚”区间的光照刺激强度(照度)、持续时间与MLT分泌抑制作用的关系,几十年来科研工作者进行了大量的实验研究。表1[19]列出了主要实验研究的实验条件以及实验结果。1980年A.J. Lewy等人[20]首先通过实验证明了夜晚光照刺激对MLT分泌存在抑制作用。实验在凌晨(AM2∶00—AM4∶00)对被试施加不同强度(照度)的光照刺激(50lx/1500lx/2500lx),试图找出光照刺激与MLT分泌情况的关系。实验结果表明:被试在连续接受30分钟、2500lx(瞳孔照度)光照刺激时,MLT分泌受到明显抑制。此后,同类实验[21-23]结果证明:低于2500lx的光照刺激也会对MLT分泌产生抑制作用。抑制作用的程度既与光照刺激强度(照度)有相关性[24-27],同时也与光照刺激累计时间呈现正相关性[28];Zeitzer等人[29]的研究结果表明:120lx(瞳孔照度)、6.5小时(PM11∶00—次日AM5∶30)的连续光照刺激可以抑制MLT的分泌。户田直宏等人[30]的研究显示:100lx(瞳孔照度)、4小时(PM8∶00—PM12∶00)连续光照刺激同样会抑制MLT的分泌。因此,现代都市日常生活中的光照环境对人体褪黑激素分泌的抑制作用不可忽视。

表1 重要研究的实验条件以及实验结果[19]Table 1 The experimental conditions and results of some important research
2.1.2.1 “主观白天”区间的光照刺激
研究显示[31-32]:与夜晚相反,无反应区间(主观白天)的光照刺激虽然不会产生相位反应,但是会刺激增加夜晚MLT的分泌量。Hashimoto等人[32]的研究表明:让被试每天6小时、连续3天(白天)曝露在5000lx(水平照度)的光照环境下,其夜晚MLT分泌总量比曝露在200lx(水平照度)的情况下有显著的增加。SJ.Park等人[33]的研究显示:6∶30—19∶30的13个小时里,曝露在5000lx(水平照度)被试的尿中MLT浓度,比曝露在200lx(水平照度)的被试的MLT浓度有所增加。Mishima等人[34]进行了以下两种实验:(1)连续4周,每天对MLT分泌障碍的高龄被试进行累计4小时(10∶00—12∶00,14∶00—16∶00)的强光(2500lx水平照度)照射;(2)连续1周,每天对被试进行连续16小时(8∶00—24∶00)的强光(5000lx水平照度)照射。两种实验结果表明:被试的MLT分泌浓度的最大值都有显著增加。以上实验证明:高强度光照刺激有助于提高人体夜晚MLT分泌量,进而改善睡眠质量。
2.1.2.3 非视觉通路作用光谱
不同波长的光照刺激对昼夜节律的影响作用不尽相同。如表2[35]所示,科研工作者针对光源特性(不同SPD)与MLT分泌抑制作用的关系进行了大量基础研究。2001年,美国科研工作者Brainard与英国科研工作者Skene各自的研究团队同时发表了关于波长与MLT分泌抑制作用关系的成果[36-37]。成果显示:同等光照强度(照度)下,460nm附近的短波光(蓝色光)对MLT分泌的抑制作用最强。并将这种波长特性被称之为“作用光谱(action spectrum)”。森田等人[38]针对1名男性被试进行多种波长光照刺激实验,其结果显示:500nm波长对LMT的抑制作用最大。Lockley,Cajochen等人[39-40]的研究显示:作用光谱除了对褪黑激素抑制作用外,对生物钟的相位变化作用、觉醒作用、瞳孔光反射作用同样最为显著。由于作用光谱曲线与锥状细胞、杆状细胞等已知感光细胞的敏感曲线有所不同,进而佐证了mRGCs的存在[41-42]。荧光灯等复合波长光源中,作用光谱区间的波长能量(SPD)越强,对MLT的抑制作用越大[43-46]。日本生理人类学会在20世纪90年代开始了一系列针对荧光灯色温与人体生理指标(主要为心率、脑波、基础体温等)关系的研究[47-48]。研究表明:富含蓝色光域的高色温(7500K)荧光灯,可以有效提高人体自律神经与中枢神经兴奋程度。近年来,欧洲研发出17000K的超高色温荧光灯[49],并实际应用在办公场所。超高色温荧光灯成功提高了工作人员的清醒度和工作情绪,同时改善了夜晚睡眠质量。另一方面,有研究表明:不同SPD分布的光源,即使数学意义上富含相同程度的光脉冲能量,其实际对MLT的抑制效果也会有所不同[50-52]。由此推测,mRGCs并不是影响MLT分泌的唯一因素[53-54]。此外,因为非视觉的光谱灵敏度特性(作用光谱)与视觉作用光谱(明视觉、暗视觉)灵敏度有所不同,所以在探讨光与非视觉作用之间的相互关系时,一般运用放射照度(μW/cm2)或光子量(photons/cm2)等物理量度量,而非一般照明研究时普遍采用的心理明亮度物理量“照度(lx)”。换言之,在探讨研究光与非视觉作用关系时,我们需要更多的着眼于光源SPD分布。

表2 非视觉通路作用光谱曲线主要研究以及实验结果[35]Table 2 Some important research and results on non-visual system
2.2 季节变动与昼夜节律
如2.1.1节所述,昼夜节律的相位反应主要由清晨与傍晚光照刺激的强度与时刻共同作用而决定。地球除赤道附近之外的大部分地区,太阳光的光照时间及光照强度随着四季的变动而变化。夏季日出时间早、日照强度大,人体昼夜节律相位相对其他季节提前。关于人体睡眠节律的季节变动,日本Honma等人[55]的研究结果如图3所示,即使在相同室内温度条件下,人体夏季睡眠时间较其他季节为短,而冬季睡眠时间相对最长。就寝时刻受社会活动制约较大,因此四季差异并不明显,而起床时刻由于受到四季日出时刻的影响,因而表现出明显的季节差异。同时,体温节律以及血液中MLT节律也表现出和睡眠节律相同的变化情况。事实上,除了睡眠节律之外,多数身体机能的昼夜节律的季节差异都客观存在。

图3 人体睡眠节律的季节变动[55]Fig.3 Seasonal Change of human sleep rhythm
另一方面,如2.1.2节所述,由于无反应区间的光照强度会影响MLT分泌总量,因此睡眠状况与季节也表现出相关性。图4[56]表示的是睡眠脑波的季节变动。如图4所示,因为夏季光照刺激的强度(照度)较高,所以第3、4阶段睡眠(余波睡眠)时间相比冬季有所增加;另一方面,同样的原因导致冬天雷姆睡眠时间比夏季有显著的增加。
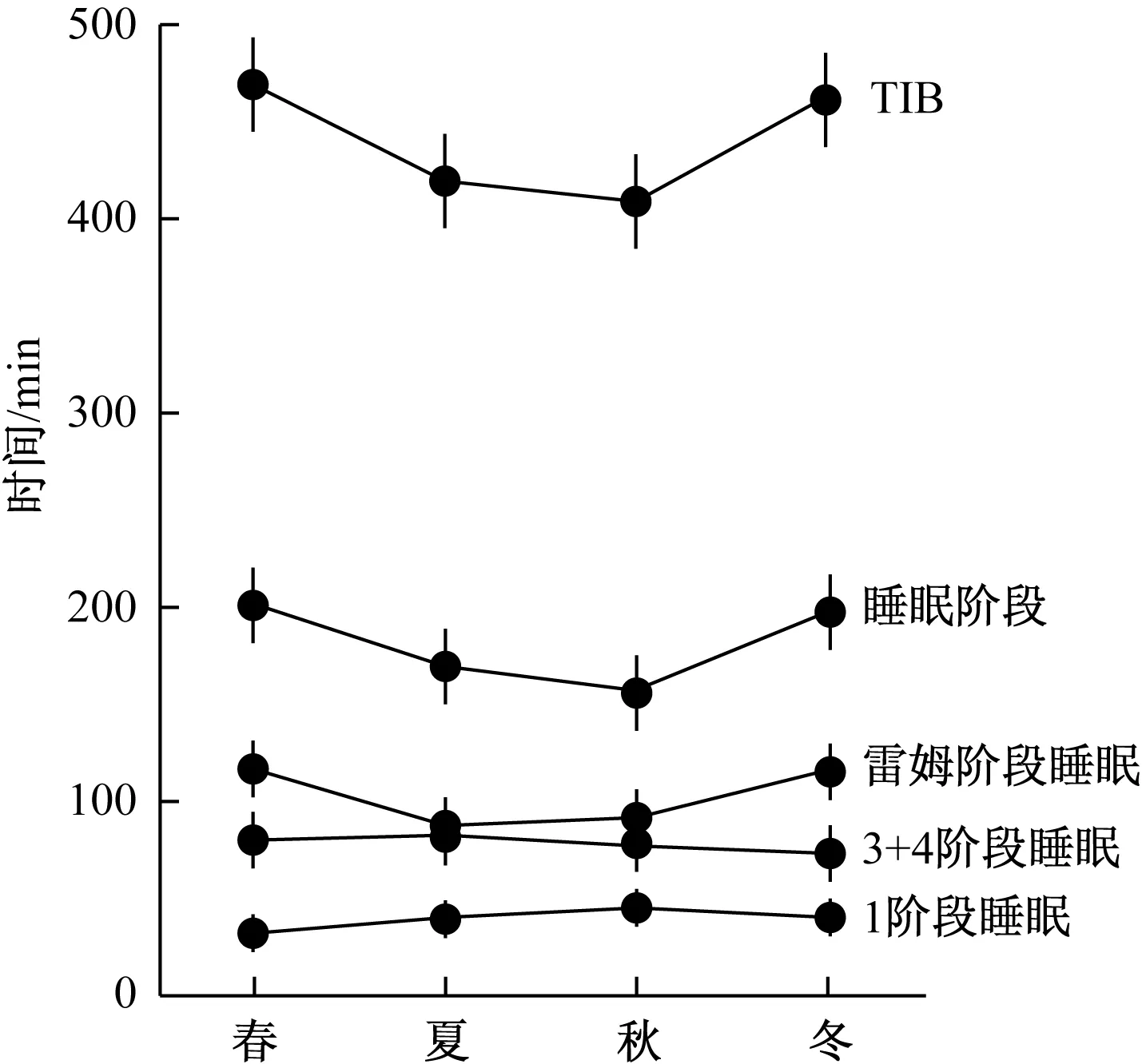
图4 睡眠脑波的季节变动[56]Fig.4 Seasonal Change of EEG
2.3 极地环境(极端的季节变动)与昼夜节律
极地的地理条件决定日照时间在一年之中有巨大的差异。Weitmann等人[57]测量了位于北极圈的挪威特罗姆瑟军事基地内的工作人员昼夜节律季节变化情况。研究并没有发现被试昼夜节律与季节之间的关系。但是,Kennaway等人[58]发现南极越冬人员(环境保护团体)的睡眠节律在极夜环境下发生了类恒暗环境中的自然偏移(Free-running)。Yoneyama等人[59]针对南极日本Dome Fuji Station的越冬队员(共计8名)昼夜节律变化状况进行了为期一年的测量与研究。研究结果如图5所示,冬季(4月)的褪黑激素分泌高峰相比夏季(11月)推迟了约4个小时(最大4.1小时)。
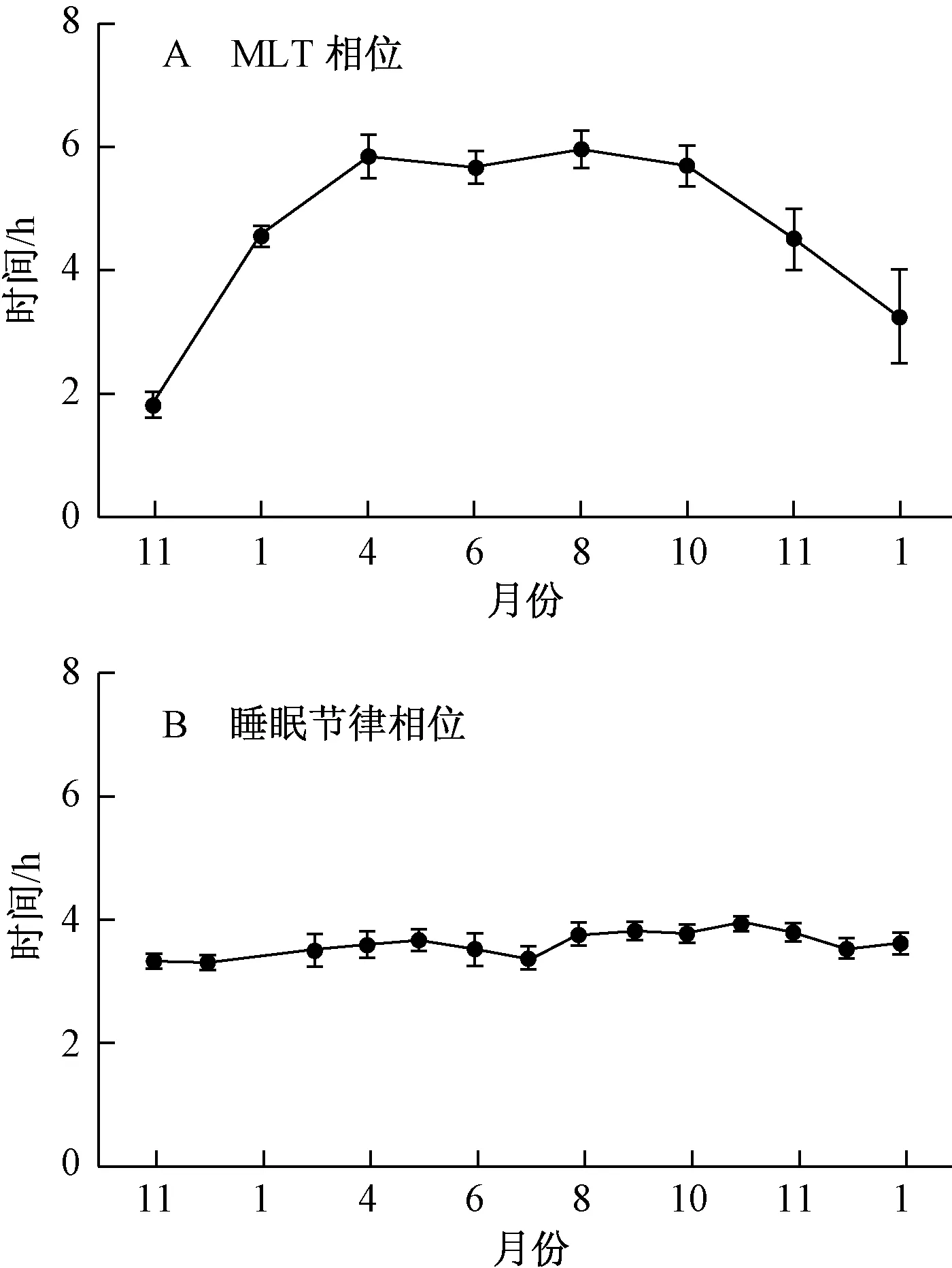
图5 南极越冬队员血液中MLT相位及睡眠节律香味的季节变动[59]Fig.5 Seasonal change in MLT and sleep rhythm of the wintering term
2.4 人体健康与昼夜节律
2000年后,Schernhammer等人[60]的研究结果显示:从事轮班制工作、晚间工作的女性,其乳癌患病率高于其他人群。Megdal等人[61]的研究表明:从事此类工作的女性,其乳癌患病率为正常人群的1.51倍。患病率的提高与昼夜节律紊乱引起的MLT分泌量降低及夜晚光环境对MLT分泌抑制作用有密切的关系[62]。动物实验结果表明:通过光照刺激抑制MLT分泌可以导致加速癌细胞生长[63]。盲人的乳癌发病率低于其他人群从侧面支撑上述观点[64]。同时有研究[62]表明:一般家庭寝室内过高的光照环境导致癌症发病率增高。
3 影响昼夜节律的其他因素
3.1 非光照环境因素
实验[65]表明,按时给SCN受损、失去昼夜节律的动物喂食,可以使其表现出类似昼夜节律的周期性(例如:睡眠/觉醒周期)特征。Coleman等人[66]的研究表明:在固定时间给鼠类投食,鼠类的行动及荷尔蒙分泌出现周期性节律。其节律在结束投食后仍然持续。解剖分析结果显示:视交叉上核的中枢昼夜节律没有受喂食周期影响,但存在于末端器官的末梢振动体出现脱离中枢振动体支配,直接与投食同步的现象。
此外,幼鼠在诞生初期由于视力尚未发育完全,因此无法完成自身昼夜节律与光照刺激的同步。在光同步形成之前的阶段,幼鼠的昼夜节律会与母鼠同步。这种昼夜节律同步现象称之为“母子同步”[67]。母子同步现象的成因并没有完全阐明,现阶段研究[68]认为:母鼠的哺育行为及体温周期性变化与母子同步现象有密切的关系。另有动物实验表明[69]:运动行为同样可以对生物昼夜节律产生影响。
3.2 分子层面昼夜节律的研究
日本东京大学深田吉孝、平野有沙课题组[70]与九州大学生体防御医学研究中心山敬一教授团队的合作研究发现:控制生物钟周期变化的中枢因子是CRY蛋白质(以下简称CRY)。CRY的质量随时间变化表现出增减振动规律。CRY的合成、分解驱动着包括昼夜节律在内的生物钟周期性变化。其中,已知的泛素化修饰酶FBXL3可以促进CRY的分解。该课题组的研究发现了泛素化修饰酶FBXL21,这种酶可以减缓CRY的分解速度,从而与FBXL3共同控制CRY质量的变化周期,进而在分子层面调节生物的昼夜节律。如图6所示,在恒暗环境下,野生健康鼠类(图6(a))的昼夜节律相位虽然有微小的偏移,但在50天的实验期间整体保持稳定;FBXL3缺失鼠类(图6(b))昼夜节律相位发生了明显的延迟现象;FBXL21缺失鼠类(图6(c))进入恒暗环境后,昼夜节律相位出现较明显的提前,运动周期明显减少,表现出嗜睡现象;FBXL3/FBXL21同时缺失的鼠类(图6(d))进入恒暗环境后,昼夜节律迅速减弱,在第30天左右开始昼夜节律基本消失。

图6 FBXL3/FBXL21缺失鼠类昼夜节律[70]Fig.6 The circadian rhythm of FBXL3/FBXL21 deleted mouse
4 总结与展望
昼夜节律影响着生物的生理活动,对人体的身心健康起着至关重要的作用。世界各国针对昼夜节律生理机制进行了深入的研究。但是,针对中国人昼夜节律的研究相对较少。2010年,同济大学郝洛西教授团队在“863计划”等国家科研项目的支持下,投入到中国人昼夜节律的相关研究中,期望通过实验研究,探索中国人的昼夜节律与光照刺激之间的相关性,并初步建立数据库,为进一步的科学研究及成果应用提供数据支持和理论基础。
致谢:深谢日本名古屋工业大学粥川裕平教授、日本东海大学高雄元晴教授、松下电器研究开发中心野口公喜先生对本文提供了巨大的理论支持;本文参考了《睡眠学》(日本睡眠学会编)中相关章节论述;感谢同济大学建筑与城市规划学院光环境研究室研究生陈尧东在行文中的帮助。
[1] Stevens R G. Light-at-night, Circadian disruption and breast cancer: Assessment of existing evidence.Int J Epidemiol,2009.
[2] Welsh et al. Individual neurons dissociated from rat suprachiasmatic nucleus express independently phased circadian firing rhythm. Neuron,1995,14:697-706.
[3] Honma et al. Circadian periods of single suprachias-matic neurons in rats. Neurosci Lett,1998,250:157-160.
[4] King et al. Positional cloning of the mouse circadian clock gene. Cell,1997,89:641-653.
[5] 日本睡眠学会.睡眠学[M].朝倉書店,2009:156.
[6] 出口武夫.生体リズムにおける松果体の役割.川上正澄,高坂睦年(編),生体リズムの発見機構,理工学社, 1984:107-118.
[7] Provencio I, Rodriguez I R, Jiang G, Hayes, et al. A novel human opsin in the inner retina. J. Neurosci.,2000,20(2):600-605.
[8] Berson, D M, Dunn F A, Takao M. Phototransduction by retinal ganglion cells that set the circadian clock. Science, 2002,295(5557):1070-1073.
[9] Gooley J J, Lu J, Fischer D, et al. A broad role for melanopsin in nonvisual photoreception. J Neurosci,2003,23(18):7093-7106.
[10] Panda S, Sato T K, Castrucci A M, et al. Melanopsin (opn4) requirement for normal light-induced circadian phase shifting. Science,2002,298(5601):2213-2216.
[11] 粥川裕平·他.メラトニンの基礎、臨床応用および限界.呼吸と循環,2002,50(7):705-710.
[12] 杉田義郎.睡眠相前進および睡眠相後退症候群.日本睡眠学会(編),生体リズムの発見機構,理工学社,1984:107-118.
[13] Khalsa S B, Jewett M E, Cajochen C, et al. A phase response curve to single bright light pulses in human subjects. J. Physiol.,2003,549(Pt3):945-952.
[14] McIntyre I M, Norman T R, Burrows G D, et al. Human melatonin response to light at different times of the night. Psychoneuroendocrinology,1989,14(3):187-193.
[15] 日本睡眠学会.睡眠学.朝倉書店, 2009:165.
[16] Czeisler C A, Duffy J F, Shanahan T L, et al. Stability, precision and near-24-hour period of the human circadian pacemaker. Science, 1999,284(5423):2177-2181.
[17] Duffy J F, Wright K P, Jr. Entrainment of the human ciracdian system by light. J Biol Rhythms,2005,20(4):326-338.
[18] Honma K, Hashimoto S, Nakao M, et al: Period and phase adjustments of human circadian rhythms in the real world. J Biol Rhythms,2003,18:261-270.
[19] 高橋良香·他.メラトニン抑制に関するアクションスペクトルの検証.日本生理人類学会誌,2005,10:108-109.
[20] Lewy A J, Wehr T A, Goodwin F K, et al. Light suppresses melatonin secretion in humans. Science,1980,210(4475):1267-1269.
[21] Lewy A J, Wehr T A, Goodwin F K, et al. Manic-depressive patients may be supersensitive to light. Lancet,1981,1(8216):383-384.
[22] Strassman R J, Peake G T, Qualls C R, et al. A model for the study of the acute effects of melatonin in man. J Clin Endocrinol Metab,1987,65(5):847-852.
[23] Hashimoto S, Nakamura K, Honma S, et al. Melatonin rhythm is not shifted by lights that suppress nocturnal melatonin in humans under entrainment. Am J Physiol,1996,270(5Pt2):R1073-1077.
[24] Bojkowski C J, Aldhous M E, English J, et al. Suppression of nocturnal plasma melatonin and 6sulphatoxymelatonin by bright and dim light in man. Horm Metab Res,1987,19(9):437-440.
[25] Brainard G C, Lewy A J, Menaker M, et al. Dose-response relationship between light irradiance and the suppression of plasma melatonin in human volunteers. Brain Resources,1988,54(1-2):212-218.
[26] McIntyre I M, Norman T R, Burrows G D, et al. Human melatonin suppression by light is intensity dependent. J Pineal Res,1989,6(2):149-156.
[27] McIntyre I M, Norman T R, Burrows G D, et al. Quantal melatonin suppression by exposure to low intensity light in man. Life Sci,1989,45(4):327-332.
[28] Aoki H, Yamada N, Ozeki Y, et al. Minimum light intensity required to suppress nocturnal melatonin concentration in human saliva. Neurosci Lett,1998,252(2):91-94.
[29] Zeitzer J M, Dijk D J, et al. Sensitivity of the Human Circadian Pacemaker to Nocturnal Light: Melatonin Phase Resetting and Suppression. J Physiol,2000,526:695-702.
[30] 戸田直宏·野口公喜.実生活を想定した光暴露条件による夜間メラトニン分泌抑制効果.日本生理人類学会誌,2011,16(1):39-42.
[31] Hebert M, Martin S K, Lee C, et al. The effects of prior light history on the suppression of melatonin by light in humans J Pineal Res,2002,33(4):198-203.
[32] Hashimoto S, Kohsaka M, Nakamura K, et al. Midday exposure to bright light changes the circadian organization of plasma melatonin rhythms in humans. Neurosci Lett,1996,221:89-92.
[33] Mishima K, Okawa M, Hhimizu T, et al. Diminished melatonin secretion in the elderly caused by insufficient environmental illumination. J Clin Endocrinol Metab,2001,86(1):129-134.
[34] Mishima K, Okawa M, Shimizu T, et al. Diminished melatonin secretion in the elderly caused by insufficient environmental illumination. J Clin Endocrinol Metab,2001,86:129-134.
[35] 井手渚紗·他.非イメージ形成の視覚と光受容器[R].日本建築学会九州支部,2010,第49号:89-92.
[36] Brainard G C, Hanifin J P, Greeson J M, et al. Action spectrum for melatonin regulation in humans: Evidence for a novel circadian photoreceptor. J Neurosci.,2001,21(16):6405-6412.
[37] Thapan K, Arendt J, Skene D J. An action spectrum for melatonin suppression: Evidence for a novel non-rod, non-cone photoreceptor system in humans. J Physiol,2001,535(Pt1):261-267.
[38] 森田健·他.メラトニンリズムに関与する受光器の分光感度に関する考察[C].日本照明学会第35回全国大会,2002:203.
[39] Lockley S W, Brainard G C, Czeisler C A. High sensitivity of the human circadian melatonin rhythm to resetting by short wavelength light. J Clin Endocrinol Metab, 2003,88(9):4502-4505.
[40] Cajochen C, Jud C, Munch M, et al. Evening exposure to blue light stimulates the expression of the clock gene per 2in humans. Eur J Neurosci,2006,23(4):1082-1086.
[41] Berson D M, Dunn F A, Takao M, Phototransduction by retinal ganglion cells that set the circadian clock. Science,2002,295(5557):1070-1073.
[42] Hattar S, Lia H W, Takao M, et al. Melanopsin-containing retinal ganglion cells: architecture,projections, and intrinsic photosensitivity. Science,2002,295(5557):1065-1070.
[43] Morita T, Tokura H. Effects of lights of different color temperature on the nocturnal changes in core temperature and melatonin in humans. Appl Human Sci,1996,15(5):243-246.
[44] Rea M S, Bullough J D, Figueiro M G, Human melatonin suppression by light: a case for scotopic efficiency. Neurosci Lett, 2001,299(1-2):45-48.
[45] Rea M S, Bullouht J D, Figueiro M G, Phototransduction for human melatonin suppression. J Pineal Res,2002,32(4):209-213.
[46] Kozaki T, Koga S, Toda N, et al. Effects of short wavelength control in polychromatic light sources on nocturnal melatonin secretion. Neurosci Lett,2008,439(3):256-259.
[47] Deguchi T, Sato M. The effect of color temperature of lighting sources on mental activity level. Ann Physiol Anthropol,1992,11(1):37-43.
[48] Kobayashi H, Sato M. physiological responses to illuminance andcolor temperature of lighting. Ann. Physiol Anthropol,1992,11(11):45-49.
[49] Viola A U, James L M, Schlangen LJ, et al.Blue-enriched white light in the workplace improves self-reported alertness, performance and sleep quality. Scand J Work Environ Health,2008,34(4):297-306.
[50] Revell V L, Skene D J. Light-induced melatonin suppression in humans with polychramatic and monochromatic light. Chronobiol Int, 2007,24(6):1125-1137.
[51] Figueiro M G, Bullough J D, Bierman A, et al. Demonstration of additivity failure in human circadian phototransduction. Neuro Endocrinol Lett,2005,26(5):493-498.
[52] Figueiro M G, Rea M S, Bullough J D. Circadian effectiveness of two polychromatic lights in suppressing human nocturnal melatonin. Neurosci Lett,2006,406(3):293-297.
[53] Rea M S, Figueiro M G, Bullough J D, et al. A model of phototransduction by the human circadian system. Brain Res Brain Res Rev, 2005,50(2):213-228.
[54] Gooley J J, Rajaratnam S M, Brainard G C, et al. Spectral responses of the human circadian system depend on the irradiance and duration of exposure to light. Sci Transl Med, 2(31), 31ra33.
[55] Honma K, Honma S, Kohsaka M, et al. Seasonal variation in the human circadian rhythm: Dissociation between sleep and temperature rhythm. Am J Physiol,1992,262:885-891.
[56] Kohsaka M, Honma K, Fukuda N, et al. Seasonality in human sleep. Experientia,1992,48:231-233.
[57] Weitmann E D, deGraaf A S, Sassin J F, et al. Seasonal patterns of sleep stages and secretion of cortisol and growth hormone during 24 hour periods in northern Norway. Acta Endocrinol,1979,78:65-76.
[58] Kennaway D J, Van Drop C F. Free-running rhythm of melatonin, cortisol, electrolytes and sleep in human in Antarctica. Am J Physiol,1991,260:1137-1144.
[59] 米山重人,橋本聡子,本間健一.南極におけるヒト概日リズムの季節変動.日生気誌,1999,36:83-87.
[60] Schernhammer E S, Laden F, Speizer F E, et al.Rotating night shifts and risk of breast cancer in women participating in the nurses’health study. J Natl Cancer Inst.,2001,93(20):1563-1568.
[61] Megdal S P, Kroenke C H, Laden F, et al. Night-work and breast cancer risk: A systematic review and meta-analysis. Eur.J.Cancer, 2005,41(13):2023-2032.
[62] Stevens R G, Blask D E, Brainard GC, et al. meeting report: The role of environmental lighting and circadian disruption in cancer and other diseases. Environ Health Perspect,2007,115(9):1357-1362.
[63] Blask D E, Brainard G C, Dauchy RT, et al. Melatonin-depleted blood from premenopausal women exposed to light at night stimulates growth of human breast cancer xenografts in nude rats. Cancer Res, 2005,65(23):11174-11184.
[64] Kliukjene J, Tynes T, Andersen A. Risk of breast cancer among norwegian women with visual impairment Br J Cancer,2001,84(3):397-399.
[65] Honma K, Honma S, et al. An animal model for the human circadian system. Biological Rhythms. Hokkaido University Press, 2005:153-170.
[66] Coleman D J, Harper S, Clarke J D, et al. Evidence for a separate meal-associated oscillator in the rat. Physiol Behav, 1982,29:107-115.
[67] Ohta H, Honma S, Honma K. Effects of nursing mothers on rPer 1 and rPer 2 circadian expressions in the neonatal rat suprachiasmatic nuclei vary with developmental stage. Eur J Neurosci,2002,15:1953-1963.
[68] Yamazaki A, Ohtuski Y, Yoshihara T, et al. Maternal deprivation in neonatal rats of different con ditions affects growth rate, circadian clock and stress responsiveness differentially. Physiol Behav,2005,86:136-144.
[69] Aschoff J, Gerecke U, Chr von Goetz, et al. Phase-responses and characteristics of free-running activity rhythms in the golden hamster: Independence of the pineal gland, Vertebrate Circadian Systems: Structure and physiology. Berlin:Springer-Verlag, 1982:129-140.
[70] Hirano Arisa, Yumimoto Kanae, Tsunematsu Ryosuke, et al. FBXL21 Regulates Oscillation of the Circadian Clock through Ubiquitination and Stabilization of Cryptochromes. Cell, 152(5):06-18.
